QuEChERS-超高效液相色谱-串联质谱法同时测定绿豆和赤小豆中10种农药及其代谢物残留研究
2018-12-21乔禹欣陈国峰马诚义
陶 波,乔禹欣,陈国峰,2,马诚义,马 红
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农业科学院农产品质量安全研究所,哈尔滨 150086)
绿豆[Vigna radiata(Linn.)Wilczek.]是我国主要食用豆类作物之一[1],主产区集中在黄河、淮河流域及东北地区[2],其产量和出口量均居世界首位[3]。绿豆营养价值较高,蛋白质含量高于谷类物质,约占24%,脂肪含量较低,约占1%,含丰富淀粉、维生素、矿物质、脂类及赖氨酸、蛋氨酸、色氨酸、酪氨酸等多种人体必需氨基酸[4],且药食同源,具有解毒、抗菌抑菌、降三高、抗肿瘤、预防癌症等功能[5]。赤小豆[Vigna angularis(Willd.)Ohwi et Ohashi]又名红小豆、赤豆,属一年生草本植物[6],起源于中国,种植于全国各地,主栽地区为华北、黄河中下游地区。赤小豆籽粒富含必需氨基酸、钙、磷等矿质元素[7],含有单宁、黄酮、多酚、生物碱、植酸、皂苷等生物活性物质[8]。近年来,随人们生活水平提高、膳食结构改变和保健理念增强,绿豆、赤小豆及其加工食品需求量逐年增加,绿豆、赤小豆种植面积扩大。由于防草除害需要,农药使用增加、残留严重。因此,建立适用于豆类作物中多类别、多品种药物快速高通量测定方法尤为重要,对保障作物安全生产及人类健康具有重要意义。
在多农药残留检测中,结构相似、极性化合物出现质谱图互相交错、干扰,甚至部分重叠,分离重叠农药峰成为残留分析方法建立的难点。农残分析方法主要有气相色谱法(Gas chromatography)、气相色谱-质谱法(Gas chromatographymass spectrometry)、气相色谱-串联质谱法(Gas chromatography tandam mass spectrometry)和液相色谱-串联质谱法(Liquid chromatography tandam mass spectrometry)。气相色谱法灵敏度高,但抗干扰能力差,对样品前处理净化要求较高。王建华等利用QuEChERS法-液相色谱-串联质谱法测定蔬菜中7种农药及其代谢物残留量[9];李婵君等利用QuEChERS前处理联合UPLC-MS/MS法检测花生中22种农药残留[10];阮华等采用QuEChERS-在线凝胶色谱-气相色谱-质谱法测定大米、黍子和小麦中34种农药残留[11]。国内谷物中多农药残留检测建立方法多见农药母体,代谢物检测关注较少。
试验选取10种用于绿豆和赤小豆生产的除草剂氟磺胺草醚、烯草酮、扑草净、灭草松、精喹禾灵、异丙甲草胺、噻吩磺隆、二甲戊乐灵、恶草酮、嗪草酮,GB 2763-2016及欧盟等对其代谢物均有限量要求[12]。
QuEChERS法具有快速简单、成本低、环境友好等特点[13-15],目前已广泛用于水果蔬菜粮食农药多残留检测[16-17]。本文以绿豆和赤小豆为研究对象,采用QuEChERS法提取和净化方法、MS/MS参数等作优化处理,选择PSA吸附剂对样品作分散固相萃取净化,建立绿豆和赤小豆中10种农药及其代谢物(氟磺胺草醚、烯草酮、烯草酮砜、烯草酮亚砜、精喹禾灵、灭草松、异丙甲草胺、二甲戊灵、噻吩磺隆、噁草酮、嗪草酮和扑草净)液相色谱-串联质谱检测方法。
1 材料与方法
1.1 材料与试剂
绿豆和赤小豆空白样品2017年10月购于哈尔滨市哈达批发市场,编号分别为LD1-10和HD1-10的绿豆和赤小豆样本,2017年10月采集自黑龙江省哈尔滨市、牡丹江市、齐齐哈尔市、吉林省长春市、辽宁省沈阳市、大连市、江苏省南京市、河北省石家庄市、贵州省贵阳市和安徽省合肥市;所有样本经高速中药万能粉碎机粉碎后,-20℃冰柜储存备用。
扑草净标准品(分子式为C10H19N5S,CAS No.7287-19-6)、氟磺胺草醚(C15H10ClF3N2O6S,CAS No.72178-02-0)、烯草酮(C17H26ClNO3S,CAS No.99129-21-2)、 烯草酮砜(C17H26ClNO5S,CAS No.111031-17-5)、烯草酮亚砜(C17H26ClNO4S,CAS No.111031-14-2)、灭草松(C10H12N2O3S,CAS No.250 57-89-0)、精喹禾灵(C17H13ClN2O4,CAS No.1006 46-51-3)、异丙甲草胺(C15H22ClNO2,CAS No.51 218-45-2)、噻吩磺隆(C12H13N5O6S2,CAS NO.792 77-27-)、二甲戊乐灵(C13H19N3O4,CAS No.40487-42-1)、恶草酮(C15H18Cl2N2O3,CAS No.19666-30-9)、嗪草酮(C8H14N4OS,CAS No.21087-64-9),纯度大于95%,购自德国Dr.Ehrenstorfe公司;乙腈、甲醇,色谱纯,购自迪马科技公司;乙腈,分析纯,购自天津市科密欧化学试剂有限公司;氯化钠,分析纯,购自北京益利精细化学品有限公司;甲酸,色谱纯,购自北京Dikma公司;乙二胺-N-丙基硅烷(PSA 40~60 μm),购自天津博纳艾杰尔科技有限公司;试验用水为超纯水。
1.2 仪器与设备
WATERS Xevo TQ-S超高效液相色谱仪-串联质谱仪(配电喷雾离子源)、BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)美国Waters公司;LXJ-ⅡB高速离心机,上海安亭科学仪器设备厂;IKA MS3 basic型涡流混合器,德国IKA公司;BT 2202 S电子天平,德国Sartorius公司;IKA T25均质器,德国IKA公司;HERMLE Z323K高速离心机,德国HERMLE公司;奥特赛恩斯AP-01P手提式隔膜真空泵,天津奥特赛恩斯仪器有限公司;FB-10T溶剂过滤瓶,杭州瑞析科技有限公司;KQ600B超声波清洗机,广州市予华仪器有限公司;HZQ-F160振荡器,北京佳源兴科技有限公司。
1.3 方法
1.3.1 样品前处理
称取绿豆、赤小豆样品各200 g,均匀粉碎后装袋保存于-20℃冰柜备用。
称取绿豆和赤小豆粉末各20 g(精确到0.01 g)样品于250mL烧杯,加入20mL水分散,加入40mL乙腈均质提取2 min,转入离心管,加入5 g NaCl,涡旋2 min后,以5 000 r·min-1离心5 min。取1 mL上层乙腈提取液于装有25 mg NH2净化剂2 mL离心管中,涡旋1 min,8 000 r·min-1离心3 min,过0.22μm有机系滤膜,待测。
1.3.2 标准溶液配制
农药单标准储备溶液配置:准确称取氟磺胺草醚、扑草净、灭草松、精喹禾灵、异丙甲草胺、噻吩磺隆、二甲戊乐灵、恶草酮、嗪草酮、烯草酮、烯草酮砜、烯草酮亚砜,乙腈配制成质量浓度均为1.0 mg·mL-1标准储备液混合标准工作溶液,各取1.0 mL上述单品农药标准储备液于50 mL容量瓶,乙腈定容至刻度,配制成质量浓度为20 mg·L-1混合标准工作液,储存于-40℃冰箱中备用。使用时用初始流动相逐级稀释成所需浓度工作溶液。准确称取20.00 g空白绿豆和赤小豆样品各5份,按1.3.1方法处理样品,经有机滤膜过滤后,加入混合标准工作液,配制成所需质量浓度基质校准系列工作溶液。
1.3.3 仪器条件
1.3.3.1 色谱条件
柱温:35℃;进样量:2 μL;流动相:A相为0.1%(V/V)甲酸溶液,B相为乙腈;二元梯度洗脱分离,洗脱程序:0~3 min,95%A;3~9 min,95%A~10%A;9~12 min,90%A;12~12.5 min,10%A~95%A;12.5~15 min,95%A。
1.3.3.2 质谱条件
离子源:电喷雾离子源(Electrospray ion source,ESI);扫描方式:氟磺胺草醚为负离子扫描,其余化合物均采用正离子扫描;碰撞气压力:3.0 kV;离子源温度:150℃;气化温度:450℃;脱溶剂气流量:1 000 L·h-1;锥孔气流量:150 L·h-1;检测方式:多重反应监测,见表1。
1.4 标准曲线绘制
将10种农药及其代谢物标准储备液用初始流动相稀释配制成质量分数为5、10、20、50、100 μg·L-1系列标准溶液,在上述色谱、质谱条件下利用UPLC-MS/MS开展试验,设置3次重复。绘制10种农药及其代谢物标准曲线,计算线性回归方程。
1.5 加标回收率试验
样品回收率测定采用标样添加方法,向绿豆、赤小豆样品中添加10种农药及其代谢物标准溶液,使绿豆和赤小豆样品中药剂质量分数分别为10、100、200 μg·kg-1,经样品前处理,提取净化后,加标样品利用超高效液相色谱-串联质谱测定其含量,试验设置3个重复,计算加标回收率。

表1 10种农药及其代谢物保留时间及质谱分析参数Table 1 Retention time and mass spectral parameters for ten kinds of pesticides and their metabolites
2 结果与分析
2.1 质谱条件优化
根据12种物质不同理化性质,氟磺胺草醚采用负离子扫描模式,其余物质采用正离子扫描模式,氟磺胺草醚分子式中对氧苯基含3个氟原子,氟相对电负性被指定为4,所有原子中电负性最大,氟磺胺草醚易丢失1个质子而电离,因而采用负离子模式扫描。从质谱调谐可看出,负离子模式下,当氟磺胺草醚进入一级质谱后产生稳定[M-H]-峰,氟磺胺草醚母离子为436.8,[M-H]-离子进入二级质谱经碰撞后产生m/z分别为194.7、285.8、222、316、72等碎片离子,其中m/z 194.7特征离子响应值高且稳定,因此将m/z 436.8/194.7作为定量离子对,选择响应值次高m/z 285.5作为定性离子。正离子模式下,其余11种物质均能产生稳定[M+H]+峰,灭草松母离子为241.1,[M+H]+离子进入二级质谱后,产生m/z分别为199.1、135.1、107、120等碎片离子,其中m/z 199.1特征离子是母离子脱去异丙基—CH(CH3)2后产生,m/z 199.1特征离子响应值高且稳定,因此将m/z 241.1/199.1作为定量离子对,选择响应值次高m/z 135.1作为定性离子。扑草净母离子242.0,扑草净[M+H]+离子进入二级质谱后,产生m/z分别为200.1、158、115.8、109、84等碎片离子,其中m/z 200.1特征离子是母离子脱去异丙基—CH(CH3)2后产生,m/z 158特征离子是m/z 200.1离子进一步脱去异丙基—CH(CH3)2后产生,m/z 200.1特征离子响应值高且稳定,因此将m/z 242.0/200.1作为定量离子对,选择响应值次高m/z 158作为定性离子。同理,对其余9种物质均采用稳定且响应值最高特质离子峰为定量离子,次高峰为定性离子。氟磺胺草醚和灭草松质谱图如图1所示。
2.2 色谱条件优化
为达到最佳重叠峰分离和质谱响应,试验对比5种流动相:甲醇-0.005 mol·L-1乙酸铵,甲醇-0.005 mol·L-1乙酸铵(含0.1%甲酸),甲醇-0.1%乙酸,甲醇(含0.1%甲酸)-水,乙腈-0.1%甲酸色谱分离效果。试验结果显示,流动相中加入少量甲酸(0.1%)可提高分析物离子化效率并改善色谱峰峰形,加入乙酸铵也可改善峰形,起缓冲盐作用。最终以乙腈-0.1%甲酸作为本试验流动相,优化确定最佳洗脱程序(见“1.3.3.1”)。结果表明,优化条件下,10种农药及其代谢物均可得到较好重叠峰分离度和色谱峰形,11种农药(正离子)和1种农药(负离子)MRM总离子流图见图2。

图1 氟磺胺草醚和灭草松二级质谱Fig.1 Production spectra of fomesafen and bentazone

图2 绿豆样品中10种农药及其代谢物(50 μg·kg-1)总离子色谱Fig.2 Total ion chromatogram of ten pesticides and their metabolites(50 μg·kg-1)in mung bean samples
2.3 提取方法优化
2.3.1 提取溶剂选择
根据本试验10种农药及其代谢物理化性质可知,乙腈、甲醇、丙酮、二氯甲烷、甲苯等有机溶剂均有较好溶解性。目前农药残留分析最常用提取溶剂有乙腈、丙酮和乙酸乙酯等。本研究比较乙腈、2:1(V/V)乙腈/水、0.1%甲酸乙腈、2:1(V/V)0.1%甲酸乙腈/水、1:1(V/V)丙酮/二氯甲烷对绿豆中10种农药及其代谢物提取效果。结果表明,1:1(V/V)丙酮/二氯甲烷作为提取溶剂时提取的杂质较乙腈多,且丙酮和二氯甲烷无法直接进液相色谱串联质谱联用仪,必须氮吹干后净化并转相,二氯甲烷毒性较大,当纯乙腈作为提取溶剂时,除精喹禾灵、二甲戊灵和恶草酮外,其他9种物质回收率均小于80%,其中噻吩磺隆回收率最低,仅为15.28%;而用0.1%甲酸乙腈作为提取溶剂时,其回收率较乙腈稍高,最低回收率为20.22%;当使用2:1(V/V)0.1%甲酸乙腈/水作为提取溶剂时,溶剂效应明显高于2:1(V/V)乙腈/水提取溶剂。由于流动相为乙腈和0.1%甲酸水,同时考虑净化过程溶剂性质,因此选取2:1(V/V)乙腈/水作为提取溶剂,此提取溶液中12种物质回收率为99.08%~109.63%。
2.3.2 提取方法优化
目前国内外农药残留分析主要提取方式为振荡、超声和均质3种。本研究分别比较3种提取方式及提取时间,分别采用振荡提取10、20、30、60 min,超声提取10、20、30 min,均质提取2、3、5 min,结果表明,振荡提取方式随提取时间延长,提取效果逐渐增强,振荡10 min时,10种农药及其代谢物回收率8.20%~12.65%,振荡时间延长至60 min时,平均回收率80.11%~104.64%;超声提取与振荡提取规律相似,随超声提取时间延长,提取率逐渐增大,超声10 min时上述10种农药及其代谢物回收率为65.62%~96.95%,当超声时间为60 min时,回收率81.44%~95.13%;分别比较均质提取2、3和5 min时回收率发现,当均质提取时间为2 min时10种农药及其代谢物回收率92.24%~106.80%,随提取时间延长,提取液杂质逐渐增多,具体表现在5 min绿豆和赤小豆基质效应较2 min高。因此同时考虑提取效果和提取时间,选择均质2 min作为本试验10种农药及其代谢物提取方式。
2.4 净化方法优化
本试验分析PSA、GCB、C18、NH24种不同净化剂及不同添加量对绿豆、赤小豆样品乙腈提取溶液净化效果。取绿豆和赤小豆样品乙腈提取液1 mL于2 mL离心管,分别在离心管中添加上述4种净化剂各25 mg,测定目标化合物加标回收率。上述结果表明,当使用NH2作为净化吸附剂时,净化后液体中还有微量色素,赤小豆中二甲戊灵回收率为125.09%,高于合理范围;GCB可有效去除基质中色素[18],也对某些农药有一定吸附作用[19],特别是对具有芳香环及结构对称性农药吸附力最强[20],使用GCB作为净化吸附剂时,精喹禾灵因含有喹喔啉六元环稠环易被GCB吸附,导致回收率小于55%;C18净化剂对除烯草酮砜和烯草酮亚砜其余10种化合物均有良好净化效果,平均回收率94.16%~113.56%;采用25 mg PSA净化剂净化时10种农药及其代谢物回收率85.35%~113.29%,均在合理范围(70%~120%)内,可能因PSA净化剂含有两个氨基可与有机酸、脂肪酸、色素、糖类等极性基质成分结合,且对目标农药和代谢物不具有吸附效果[21],因此本试验采用25 mg PSA作为吸附剂净化绿豆和赤小豆乙腈提取液。
2.5 基质效应
样品提取液添加法是由Matuszewski等提出的一种定量基质效应强度测定方法,可解决样品基质增强效应,回收率由校准前135.0%、127.0%的异常值,恢复为97.0%、93.0%。为明确样品基质效应是增强或抑制,阴性绿豆和赤小豆样品经上述优化后分散固相萃取、净化和检测步骤得到3种基质溶液,分别将其与丙酮溶剂配制的50、100 μg·L-110种农药及其代谢物混合标准溶液和样品基质配制标液,上机后,采用基质标样峰面积除以溶剂标样峰面积比值r反映基质增强。

表2 10种农药及其代谢物定量限、线性方程、相关系数Table 2 Limits of quantitation,linear equation,correlation coefficients for ten pesticides and their metabolites
试验农药在3种基质中均表现离子增强效应。绿豆空白基质样品乙腈提取液中添加10种农药及代谢物混合标准溶液配制基质标准溶液,与同浓度纯溶剂混合标准溶液农药质谱比较测定,研究绿豆和赤小豆基质对10种农药及代谢物基质效应。绿豆和赤小豆基质效应强弱由基质标样中测定农药定量离子质谱峰面积与溶剂标样质谱峰面积相比增加或减少百分比表达,若定量离子质谱峰面积超过15%则认定基质效应明显。结果表明,10种农药及2种代谢物存在明显基质增强效应。因此,为降低绿豆和赤小豆基质效应对定量结果准确性影响,试验过程中配制绿豆和赤小豆基质标准溶液校正定量结果,基质标准溶液需使用前现用现配。
2.6 方法验证
2.6.1 线性关系和定量限
将配制好质量浓度为5、10、20、50、100 μg·L-110种农药及其代谢物标准溶液,上机分析,得到相应响应值,标准品色谱图见图2,以峰面积响应值为纵坐标(y)、标样质量浓度为横坐标(x),绘制标准曲线。由表2可知,5~100 μg·L-1质量浓度范围内所有农药均呈较好线性关系,相关系数r均大于0.995,以10倍信噪比确定各农药化合物定量限(Limit of quantitation,LOQ)[22-23],所有农药及其代谢物定量限为0.1~1 μg · kg-1[24-25]。
2.6.2 回收率和精密度
向空白绿豆和赤小豆样品中分别添加不同浓度10种农药及其代谢物混合标准工作液作回收试验,按上述优化方法提取和净化,超高效液相色谱-串联质谱测定其含量,外标法定量,计算每个加标样品中10种农药及其代谢物平均加标回收率和标准偏差(RSD)。由表3可知,10种农药及其代谢物回收率90.2%~110.0%,RSD 0.8%~7.3%(n=5)。
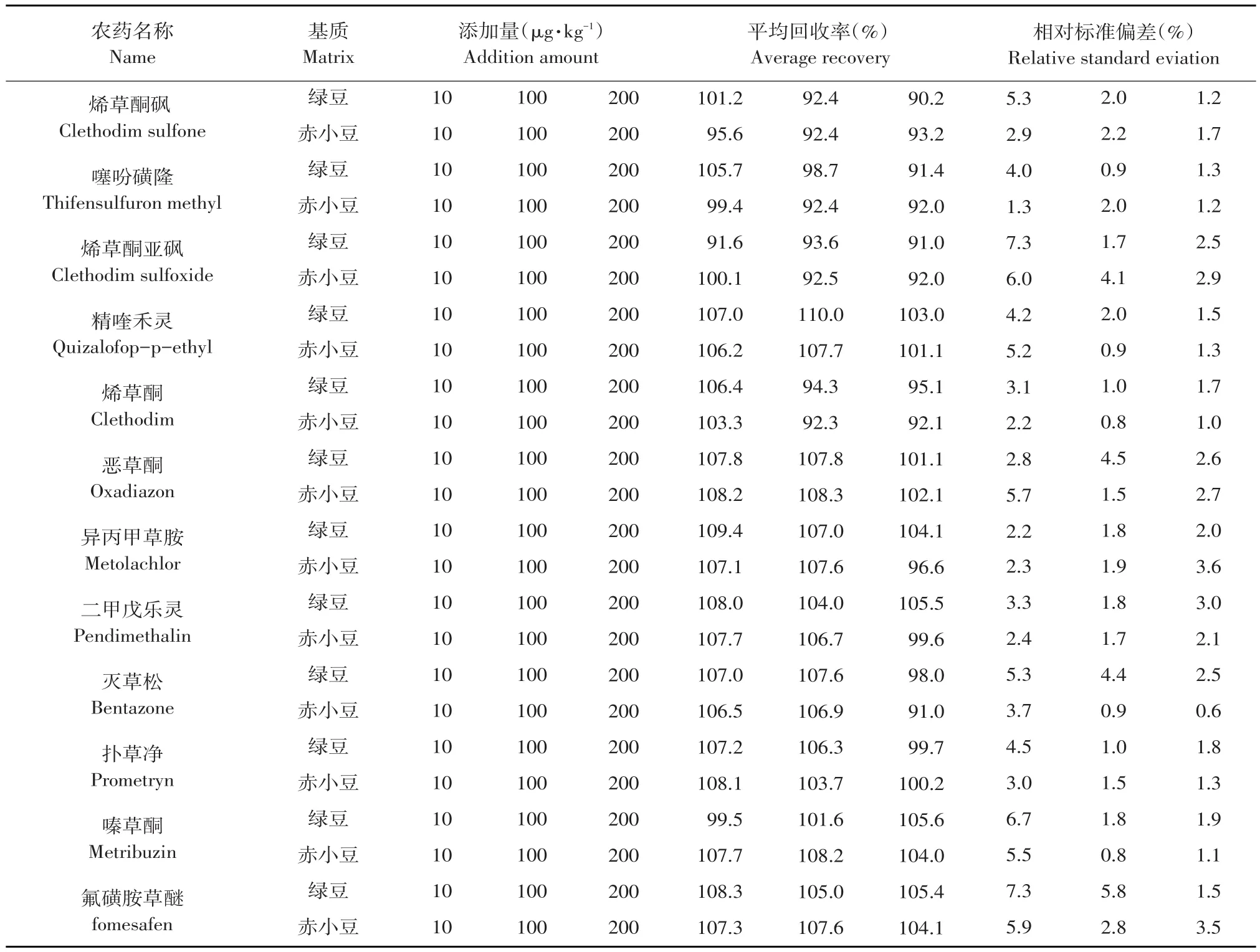
表3 加标回收率及精密度试验Table 3 Recoveries rate and precision experiment(RSDs)
2.7 实际样品检测结果
采用均质提取,PSA净化方法,分别对来自黑龙江、吉林、辽宁、江苏、河北、贵州、安徽7个省绿豆和赤小豆各10个样品测定上述10种农药和代谢物残留,结果如表4所示。
实际样品绿豆和赤小豆各10份样品中噻吩磺隆、精喹禾灵、烯草酮(含烯草酮砜和烯草酮亚砜)、恶草酮、异丙甲草胺、二甲戊灵和嗪草酮均未检出,灭草松共检出6项次,检出含量0.023~0.114 mg·kg-1;扑草净共检出3项次,检出含量0.010~0.057 mg·kg-1;氟磺胺草醚共检出10项,残留量0.043~0.106 mg· kg-1。

表4 绿豆和赤小豆中10种农药及其代谢物检出情况Table 4 Distribution of ten pesticidese and metabolites detected in mung bean and red bean shoots
3 讨论与结论
安文佳等利用固相萃取-气相色谱法检测绿豆中7种农药残留[26]。王德飘等建立气相色谱-电子捕获检测器(GC-ECD)检测绿豆和向日葵中福美双残留量方法[27]。刘畅研究快速检测红小豆、绿豆、高粱米中8种农残方法[28]。李成等研究高效液相色谱-串联质谱法测定红小豆中6种咪唑啉酮类除草剂残留检测方法[29]。目前,绿豆和赤小豆残留检测方法主要集中在杀虫剂和杀菌剂,农药及其代谢物同时检测关注较少。研究发现,部分农药代谢产物因其比农药母体具有更强环境稳定性和生态毒性,对生态环境和人体危害远高于农药母体。农药及其代谢物检测,对环境安全和食品安全更为重要,是未来农药残留检测热点和难点。目前国内外农药残留限量标准及法规不仅要求检测农药母体,对农药有毒代谢物残留检测要求也越来越高,因此必须建立农药及其代谢物同时检测方法。本试验研究绿豆和赤小豆生产中常使用的10种农药及2种代谢产物残留检测方法,目前尚无报道。
本研究建立分散固相萃取结合超高效液相色谱串联质谱法检测绿豆和赤小豆中氟磺胺草醚、烯草酮及其代谢物烯草酮砜和烯草酮亚砜等12种化合物残留量方法,通过优化绿豆和赤小豆样品前处理方法(提取方法、提取溶剂和净化方法)、色谱条件、质谱条件,最终采用20 mL 2:1(V/V)乙腈/水作为提取溶剂,考虑提取效果和提取时间,选择均质2 min作为提取方式,选择25 mg PSA作为分散固相萃取吸附剂。样品基质效应是质谱检测过程正常现象,检测样品基质、样品提取溶剂、提取方法等前处理因素均影响基质效应,基质效应通常是妨碍(离子抑制)或增强(离子增强)分析目标离子的形成效能,影响定量结果。基质可通过如下方法消除:①样品前处理时尽量处理干净;②仪器分析过程中,标准曲线采用基质匹配标准溶液绘制;③采用内标法作色谱分析校正。目前最常用方法是样品提取液添加法。王连珠等以提取液添加法研究青花菜、番茄、枝豆、萝卜、大葱等蔬菜基质中66种有机磷农药使用液相色谱-串联质谱法分析基质效应[30],结果表明可有效解决各蔬菜基质中色素等类复杂基质干扰问题,平均回收率为55.0%~122.0%,RSD为1.6%~18.0%,LOQ为0.1~8.0μg·kg-1。同位素内标法也是解决基质问题有效方法,但本方法涉及10余种农药品种,难以内标法同时检测,采用与被测物质性质相近物质作为内标存在偏差。因此,为明确基质效应对定量结果影响,配制绿豆和赤小豆乙腈提取液基质标准溶液校正定量结果,以上方法操作快速简便、稳定性好、准确可靠,满足限量检测要求。其中10种农药及其代谢物5~100 μg· L-1呈良好线性关系,相关系数(r)0.9978~0.9999。3个加标水平下,10种农药及其代谢物平均回收率90.2%~110.0%,相对标准偏差小于7.3%。完全符合绿豆和赤小豆中农药及其代谢物同时检测分析要求,为绿豆和赤小豆中农药及代谢物残留风险评估提供可靠方法,保障食品安全。本试验每种农药和代谢物均设定3个不同添加浓度,每个浓度添加5次重复,有效消除试验误差,结果有效。
