术前血清C1q、S100B、hs-CRP水平与ACS患者PCI术中发生冠状动脉无复流的关系
2018-12-21魏旭明张寒雪任明芬
魏旭明,张寒雪,任明芬
(1新乡医学院第二附属医院,河南新乡453002;2新乡医学院)
急性冠状动脉综合征(ACS)发病较急,由于冠状动脉不稳定斑块破裂、血栓形成,进而引起冠状动脉闭塞,最终导致缺血缺氧、诱发剧烈胸痛[1]。尽早行经皮冠状动脉介入治疗(PCI)开通梗死相关血管[2],恢复冠状动脉血流,已推荐为其首选的再灌注方法[3]。然而10%~30%的ACS患者行PCI术冠状动脉再灌注时仍有冠状动脉无血流或血流灌注较少,即冠状动脉无复流现象。无复流一旦发生将增加患者的远期死亡率[4]。近年研究发现,炎症因子在冠状动脉慢血流或无复流中起重要作用。血清补体成分1q(C1q)参与启动机体的防御、炎性反应的调控,还通过调节巨噬细胞炎性两极分化参与动脉粥样硬化的发展[5]。S100B是高级聚糖化终产物(RAGE)的配体之一。有研究发现,S100B可激活RAGE炎症反应[6],增加黏附分子和炎症因子的表达。超敏C反应蛋白(hs-CRP)亦是一种重要的炎症因子,与ACS的发展有密切关系[7]。因此,本研究探讨了术前血清C1q、S100B及hs-CRP水平对ACS患者PCI术中发生无复流的影响。
1 资料与方法
1.1 临床资料 选择2015年12月~2017年6月在新乡医学院第二附属医院接受PCI术治疗的ACS患者109例。纳入标准:缺血性胸痛持续时间≥30 min,含服硝酸甘油无法缓解;出现症状至入院时间≤12 h;冠状动脉造影提示ACS;患者同意且均置入支架。排除标准:24 h内溶栓治疗;严重肝、肾功能异常;严重心脏瓣膜病;近期患有感染性疾病;近期出现活动性出血;肿瘤。按照PCI术中是否发生冠状动脉无复流、慢血流分为对照组[血流正常,心肌梗死溶栓研究(TIMI)[8]血流3级]79例与无复流组(TIMI血流≤2级)30例,对照组中男42例,女37例;年龄41~76(59.24±8.76)岁;体质量指数(BMI)(26.58±1.77)kg/m2;有吸烟、糖尿病、高血压、高脂血症史分别为34、19、35、30例;Killip分级≥Ⅱ级11例;右冠状动脉(RCA)、左冠状动脉回旋支(LCX)、左冠状动脉前降支(LAD)病变分别为33、15、31例。无复流组中男17例,女13例;年龄40~75(58.72±8.25)岁;BMI(26.74±1.63)kg/m2;有吸烟、糖尿病、高血压、高脂血症史分别为16、8、17、13例;Killip分级≥Ⅱ级8例;RCA、LCX、LAD病变分别为12、8、10例。两组基线资料有可比性。
1.2 常规治疗方法 患者均给予拜阿司匹林片300 mg嚼服、替格瑞洛180 mg口服,1次/d;并给予抗凝、扩管、调脂、抑制心室重构、控制心率等常规治疗。
1.3 PCI术 PCI由经验丰富有冠状动脉介入资质的医生完成,选择股动脉或桡动脉路径,冠状动脉造影前经动脉鞘管给予普通肝素3 000 IU,再做冠状动脉造影明确冠状动脉病变并采集造影图像,然后根据患者的病变情况采取相应的PCI方案,再经动脉鞘管给予肝素100 IU/kg,选择合适的导引导管及导引导丝送至病变部位进行PCI,术后复查造影并记录相关动脉TIMI血流级别。
1.4 冠状动脉无复流、慢血流的判定 冠状动脉慢血流或无复流是指PCI术中冠状动脉无机械性阻塞,无显著残余狭窄或夹层,但仍然存在前向血流障碍。通常采用TIMI方法进行分级[8]:阻塞血管远段无血流为0级;造影剂越过阻塞血管端,但不能使整个远段冠状动脉床显影为1级;经过3~4个心动周期后,前向造影剂使冠状动脉血管完全显影2级;前向造影剂留在3个心动周期内使冠状动脉完全显影为3级。
1.5 观察指标的检测 所有ACS患者入院后行18导心电图检查,测血压,患者在PCI术前及术后抽取肘静脉血5 mL,置于离心机以3 000 r/min离心10 min,提取血清,放置于-70 ℃低温冰箱保存备用。常规检测血常规、凝血功能、心肌酶、肌钙蛋白I、肝功能、肾功能、血糖、血脂。血清脑钠肽、C1q及hs-CRP的检测均采取免疫透射比浊法,美国Beckman全自动生化分析仪完成。血清S100B采用ELISA法测定,检测试剂采用美国RD公司试剂盒,在河南省医用组织再生实验室测定。
2 结果
2.1 两组基本临床特征比较 对照组白细胞、中性粒细胞、血小板分别为(9.8±2.6)×109/L、(7.6±1.9)×109/L、(276.8±41.3)×109/L,无复流组分别为(10.9±2.8)×109/L、(8.9±2.5)×109/L、(294.3±44.7)×109/L。对照组支架长度、支架数量分别为(25.48±3.64)mm、(1.26±0.48)个,无复流组分别为(29.53±4.27)mm、(1.32±0.55)个。对照组血清肌酐、脑钠肽、C1q、S100B、hs-CRP分别为(70.53±23.56)μmol/L、(321.4±86.3)ng/L、(175.32±32.53)μg/mL、(88.34±14.71)pg/mL、(3.18±0.62)mg/L,无复流组分别为(75.48±24.62)μmol/L、(385.6±97.4)ng/L、(191.74±38.25)μg/mL、(104.18±18.06)pg/mL、(4.29±0.73)mg/L。与对照组相比,无复流组中性粒细胞、脑钠肽、C1q、S100B、hs-CRP均升高(P<0.05或<0.01)。两组白细胞、血小板、肌酐、植入支架长度及数量差异均无统计学意义(P均>0.05)。
2.2 慢血流或无复流的危险因素分析 将单因素统计有差异的变量中性粒细胞、脑钠肽、C1q、S100B及hs-CRP纳入Logistic回归分析中。结果显示,C1q(OR=1.024,95%CI:1.022~1.146,P=0.002)和hs-CRP(OR=1.328,95%CI:1.147~1.564,P=0.001)是ACS患者PCI术中慢血流或无复流发生的独立影响因素。见表1。
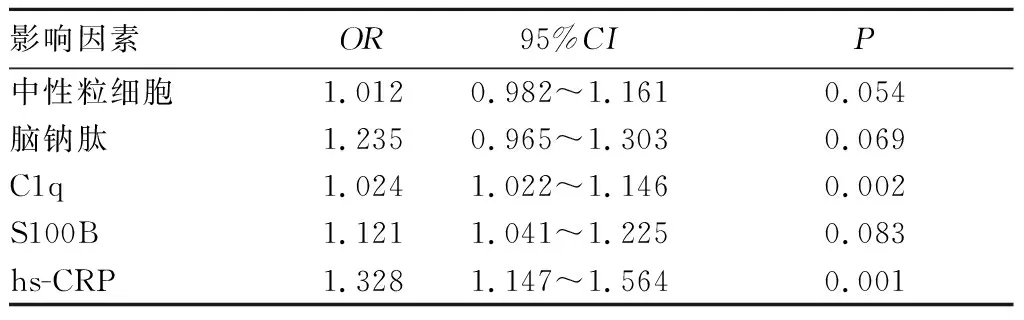
表1 PCI术中慢血流或无复流多因素Logistic回归分析
2.3 血清C1q、hs-CRP对ACS患者PCI术中慢血流或无复流的预测价值 应用ROC曲线分析血清C1q对ACS PCI术中慢血流或无复流预测的敏感性和特异性分别为65.7%和66.4%,曲线下面积(AUC)为0.771(95%CI:0.678~0.862)。hs-CRP对ACS患者PCI术中慢血流或无复流预测的敏感性和特异性分别为70.8%和71.2%,AUC为0.856(95%CI:0.812~0.953)。见图1。

图1 血清C1q、hs-CRP预测PCI术中冠状动脉慢血流或无复流的ROC曲线
3 讨论
ACS包括急性ST段抬高型心肌梗死、急性非ST段抬高型心肌梗死和不稳定型心绞痛,在行急诊PCI的过程中,有一部分患者出现无复流、慢血流现象,术中患者即出现胸痛胸闷不适,焦虑紧张[9],严重的甚至出现急性心衰、休克,远期发生心源性猝死风险高。既往研究发现,慢血流或无复流的发生与缺血再灌注损伤、内皮功能损伤、机体氧化应激、微血栓、血管舒缩功能障碍等有关[10],而炎症反应是缺血再灌注损伤的关键因素。新近研究表明,ACS患者PCI术中机体的高炎症反应状态在慢血流、无复流的发生中起着十分重要的作用。动脉粥样硬化是一种慢性血管炎症性病变,是导致ACS的主要病理生理基础。
C1q是是补体经典激活途径的始动因素[11],不但参与机体防御的启动,还介导单核巨噬细胞对凋亡细胞和循环免疫复合物等的清除,参与炎症反应调控。已经有很多研究发现,C1q直接与巨噬细胞作用并促进巨噬细胞清除堆积脂质和凋亡细胞[12],分泌抗炎症因子,这提示C1q可能具有限制粥样斑块进展的保护作用[13]。S100B通常由神经组织细胞分泌[14],但缺血的心肌细胞也能表达并分泌少量S100B蛋白[15]。S100B是RAGE的配体之一,可激活炎症反应,增加黏附分子和炎症因子的表达;其可激活过氧化物自由基的释放,而加重内皮损伤[16],还能诱导单核细胞趋化蛋白-1的表达,促进单核细胞与血管内皮细胞黏附,促进脂纹产生。hs-CRP已被证实是炎症和损伤的敏感标志物[17],正常人体中含量很少,当机体发生炎症时会促进hs-CRP的释放,发挥细胞黏附和吞噬作用,加重炎症反应,引起冠状动脉内膜损伤导致血管粥样硬化发展。本研究结果显示,PCI术前无复流组患者血清C1q、S100B、hs-CRP水平及中性粒细胞数、脑钠肽水平均高于对照组;进一步行多因素Logistic回归分析,结果显示血清C1q和hs-CRP是ACS患者PCI术中慢血流或无复流发生的独立相关因素,S100B不是ACS无复流影响的独立因子。ROC曲线分析亦提示血清C1q和hs-CRP对于慢血流或无复流的发生有预测价值。因此,联合测定血清C1q、S100B及hs-CRP有助于判断ACS患者PCI术中无复流的风险,便于术前早做准备,帮助我们从其他方面来预防无复流的发生,提高急诊PCI的质量。
