泡球蚴感染小鼠肝M2型巨噬细胞的变化
2018-12-21李斌王亮刘玉梅杨宁闫怡姜涛高剑丁剑冰马秀敏阿曼古丽牙生
李斌,王亮,刘玉梅,杨宁,闫怡,,姜涛,高剑,丁剑冰,马秀敏,阿曼古丽·牙生
(1新疆医科大学第一附属医院·省部共建中亚高发病成因与防治国家重点实验室,乌鲁木齐830011;2新疆医科大学基础医学院)
泡型包虫病是由多房棘球绦虫的幼虫泡球蚴作为主要病原体的一种致死率高、危害严重的人畜共患寄生虫病。泡型包虫病多始发于肝脏,泡球蚴在肝脏寄生后,从母泡囊会不断增殖出新的子泡囊,因其出芽式的生长方式与恶性肿瘤相似,故又有“虫癌”一称。巨噬细胞作为多种免疫细胞中重要的一员,有多种功能,可以在特异性免疫和非特异性免疫中同时发挥不同作用。有学者将巨噬细胞大致分为M1和M2两种极化类型,M1型巨噬细胞主要参与Th1型免疫反应,是通常理解的发挥正向作用的功能细胞;M2型巨噬细胞则主要参与Th2型免疫反应和体液免疫,其可以使细胞内的病原体受到相对较弱的杀伤力,同时加强清除机体残留物质的能力[1]。研究表明,在某些疾病的发展进程中,病原体会为了躲避巨噬细胞的噬菌作用从而迫使其从M1型向M2型发展,从而进一步加快疾病的发展进程[2]。2017年7月~2018年5月,本研究通过检测泡球蚴感染小鼠肝脏中M2型巨噬细胞的动态改变,探讨其在泡球蚴感染小鼠肝脏中的可能免疫机制,为泡球蚴感染的基础和临床研究提供初步实验依据。
1 材料与方法
1.1 材料 实验动物: 雌性BALB/c小鼠48只,保种BALB/c小鼠1只,6~8周龄,体质量18~22 g,购自新疆医科大学实验动物中心。主要试剂和仪器:CD163多克隆兔抗鼠抗体购自北京博奥森公司。磷酸盐缓冲液粉末、枸橼酸盐缓冲液粉末、生物素标记的通用型二抗试剂盒购自北京中衫生物技术有限公司。PrimeScriptTMRT Master Mix (Perfect Real Time)购自宝生物工程(大连)有限公司。
1.2 动物模型建立及分组 将感染泡球蚴的保种BALB/c小鼠处死,取出感染组织,分离出坏死组织,用5 mL注射器将嚢液吸出,剩余组织剪碎、研磨、200目尼龙网过筛,使用含青链双抗的生理盐水反复冲洗沉淀3次,最后1次沉淀后用PBS重悬,用0.5%伊红染料计数原头节的着色率及形态,确保原头节的存活率>90%后,准备腹腔注射。将48只BALB/c小鼠随机分为对照组,模型组各24只。模型组小鼠每只腹腔注射2 000个原头节,对照组小鼠每只注射等体积的生理盐水。
1.3 标本采集 分别于接种后90、180、300 d颈椎脱臼法处死8只对照组小鼠和对应模型组的全部小鼠,打开腹腔,暴露肝脏,无菌剥取小鼠的肝脏,一部分置于10%的中性甲醛溶液中,固定24 h以上,后用于HE染色和免疫组织化学检测。另一部分经液氮快速冷冻后转移至-80 ℃冰箱,后用于提取总RNA,待实时荧光定量PCR检测。
1.4 组织标本HE染色 将固定好的组织进行组织脱水、石蜡包埋、切片、脱蜡、水化后进行常规HE染色、封片,显微镜下观察病理学变化。
1.5 肝脏组织CD163蛋白表达水平的检测 采用免疫组化法。制片方法同HE染色,将制得的片子常规脱蜡至水后,使用3%过氧化氢室温孵育10 min,枸橼酸盐缓冲液95 ℃微波修复15 min,冷却至室温,滴加山羊血清工作液37 ℃封闭30 min,滴加一抗,4 ℃孵育过夜,室温放置1 h后滴加生物素标记的通用型二抗室温孵育2 h,DAB室温显色,苏木素复染后快速脱水封片。其中阴性对照的一抗使用PBS代替。镜下观察,每张肝组织免疫组化切片在400倍光镜下随机选取5个不同视野分别采集图像,将阳性表达和阴性表达所占的面积使用Image J软件进行统计,再算出阳性面积百分比和标准差。
1.6 肝脏组织Fizzl mRNA表达水平的检测 采用实时荧光定量PCR法。从-80 ℃冰箱分别取对照组、模型组接种90、180、300 d约100 mg肝组织,采用TRIzol法抽提总RNA,测定OD260/280值并记录浓度,OD260/280值在1.8~2.1。将所有标本总RNA浓度调整到500 ng/μL,各取总RNA 1 μL使用PrimeScriptTMRT Master Mix (Perfect Real Time)试剂盒逆转录cDNA,将制成的cDNA标本分别取2 μL加入PrimeScriptTMRT Master Mix (Perfect Real Time)试剂盒中的qPCR体系,于实时荧光定量PCR仪上检测Fizz1、GAPDH的表达量。实时荧光定量PCR中所用的引物由上海生工公司合成,其上游引物序列:5′-AACTTTGGCATTGTGGAAGG-3′,下游引物序列:5′-CACATTGGGGGTAGGAACAC-3′;Fizz1基因作为目的基因,其上游引物序列:5′-TCCAGCTAACTATCCCTCCACTGT-3′,下游引物序列:5′-GGCCCATCTGTTCATAGTCTTGA-3′。选择小鼠GAPDH基因作为内参。记录反应后各组Ct值,采用2-ΔΔCt相对定量法对各目标基因进行定量。
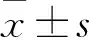
2 结果
2.1 各组大体观察结果 肉眼所见:对照组小鼠解剖后未见肝脏和腹腔存在异常变化,肝脏质地柔软、光滑,色泽红润,无明显粘连,肝脏解剖位置正常。模型组接种90 d解剖后发现,小鼠腹腔内弥散许多囊泡,大小不等,多为小囊泡融合而成。与对照组相比,肝脏质地稍硬,体积稍增大,色泽较暗淡,与周围组织和胸腔存在部分粘连,解剖位置已偏离正常位置。接种180 d解剖后发现,小鼠腹腔中存在大量囊泡,部分体积较大,囊泡中存在坏死、钙化,与被侵蚀的组织分界较模糊。被囊泡侵蚀的肝脏颜色暗淡,部分已经变黄、变白,质地偏硬,体积较对照组有所缩小,与胸腔和周围脏器粘连明显且不易分离,已明显偏离正常解剖位置。接种300 d解剖后发现,腹腔内粘连严重,囊泡体积巨大,被囊泡侵蚀的肝脏已不能完整分离,其部分颜色暗淡,质地较硬,已完全脱离正常解剖位置。镜下观察:对照组小鼠肝组织结构正常,肝小叶结构完整,肝细胞边界清晰,排列整齐,可见肝细胞质疏松化,偶见炎性细胞聚集。模型组接种90 d肝小叶结构较完整,可见炎性细胞浸润加重,部分胆管增生,可见囊泡的囊壁形成,囊壁内侧偶见头节。接种180 d,正常肝小叶结构紊乱,部分肝细胞坏死明显,出现空泡样变性,大量炎性细胞浸润,纤维结缔组织增生明显。接种300 d,部分肝小叶结构已不可见,空泡样变性明显,大量炎性细胞浸润,纤维结缔组织继续增生。
2.2 不同时期小鼠肝脏组织CD163表达比较 在感染后不同时间段,对照组小鼠肝脏中很少或者基本不表达CD163。相比于对照组, 90 d时模型组肝脏组织中CD163的表达升高(P<0.05);180 d时CD163的表达水平达到峰值(P<0.01);300 d时CD163的表达呈现出下降趋势,但仍比对照组高(P<0.05)。见图1、表1。

图1 不同时期小鼠肝脏组织CD163的免疫组化结果(×400)
注:A:对照组;B、C、D:模型组接种90 d、180 d、300 d。

表1 两组不同时期小鼠肝脏组织CD163蛋白表达比较
2.3 两组不同时期肝脏组织Fizz1 mRNA表达比较 对照组肝脏组织中Fizz1 mRNA相对表达量在90、180、300 d基本稳定。与同期对照组相比,90 d,模型组肝脏中Fizz1 mRNA的相对表达量增加(P=0.004);180 d,模型组Fizz1 mRNA的相对表达量达到峰值(P=0.000);而300 d,模型组Fizz1 mRNA的相对表达量有所下降,但差异有统计学意义(P=0.001)(见图2、表2)。

图2 两组不同时期肝脏组织Fizz1 mRNA的表达比较

表2 各组小鼠肝脏中Fizz1 mRNA的相对表达量比较
3 讨论
寄生虫病在人类传染病中占有十分重要的地位,泡型包虫病是一种流行在畜牧地区的人畜共患寄生虫病,具有潜伏期长、病死率高等特点。人因误食多房棘球绦虫的虫卵成为中间宿主而患病,并且患者的原发病灶多为肝脏。巨噬细胞是固有免疫和适应性免疫的重要组成部分,在感染性疾病中发挥了重要作用。本实验以泡球蚴感染的小鼠为模型,检测了感染中、后期小鼠肝脏组织中M2型巨噬细胞的动态变化,试说明其与泡球蚴感染中晚期的关系。
肝脏中巨噬细胞占非实质细胞的35%[3],在调节生理机能、维持各项功能的动态平衡、炎症反应中是不可或缺的一部分。特异性和可塑性是巨噬细胞的特点,在不同微环境和细胞因子的综合影响下,巨噬细胞可以极化成不同类型,即经典活化的M1型和替代活化的M2型。M1型具有释放促炎因子、调节Th1型免疫、抗原的提呈等功能;而M2型则表现出“抑炎”功能,可以促进血管生成和组织修复。IL-4、IL-10、IL-13等均可刺激巨噬细胞实现M2型极化,STAT6信号通路在被IL-4/IL-13激活后可以增加M2型极化所必需的相关基因表达,如Mrc1、Ym1、Fizz1。CD163作为M2型巨噬细胞的特异性标记之一,起调节人体免疫的作用。它可识别肿瘤坏死因子样凋亡弱诱导因子,并与其特异性结合,发挥抗炎作用,对部分病原体进行实时监测;在炎性反应刺激下,CD163与其配体相结合后,通过信号转导,促使单核细胞与上皮细胞黏附,诱导IL-10等炎性因子释放。但不能简单地将CD163的功能概括成抗炎作用,它在免疫调节中的作用十分复杂,具体机制还有待更深入研究[4~6]。研究表明,在血吸虫感染过程中,肝脏的早期免疫反应类型以Th1型为主,随着感染的进行,逐渐向Th2型转变,巨噬细胞的极化类型也从M1型转化成M2型[7]。
Wynn等[8]研究表明,通过诱导产生M2型巨噬细胞极化,抑制M1型巨噬细胞促炎因子的释放,可抑制肝脏纤维化进程。Abdallahi等[9]认为,M2型巨噬细胞极化抑制Th1细胞分泌的促炎因子释放,会有利于蠕虫的生长。Blériot等[10]研究表明,IL-4能诱导单核来源的巨噬细胞从M1型转化为M2型,同时可作用于尚存的巨噬细胞,使其局部增殖并分化为M2型巨噬细胞,后者通过分泌IL-10,活化精氨酸酶,进而刺激单核细胞来源的M1型巨噬细胞的凋亡[11~14]。M2型巨噬细胞能通过分泌大量抗炎因子,如TGF-β、IL-10等,削弱炎症反应,介导免疫耐受,如在小鼠细粒棘球蚴感染后期,体内IL-10持续高表达[15]。
本实验通过免疫组化以及qRT-PCR法检测了泡球蚴感染中后期小鼠肝脏内M2型巨噬细胞的特异性标志和基因表达变化。结果显示,与对照组相比,模型组在感染90 d后,M2型巨噬细胞的特异性标志和基因的表达都升高;随后在感染180 d后,表达量到达了峰值;在感染300 d后,它们的表达量都开始出现下降趋势,却依然保持在较高水平。表明在感染中后期,为了避免大量炎性细胞继续加重组织的损伤,机体启动了保护机制促使M2型巨噬细胞增殖,促进损伤的组织进行修复,抑制炎性细胞过强的作用;但同时也降低了其对病原体的杀伤能力,这也可能是导致泡球蚴逃避机体免疫功能的一个原因。
综上所述,巨噬细胞在寄生虫病中有着重要的免疫调节功能,因此我们在疾病进展的不同时期调控不同极化类型的巨噬细胞数量和比例,使其达到一个理想的状态,从而使疾病在一定程度上得到控制,这可以为疾病的研究和治疗提供一个新思路。本研究揭示了在泡球蚴感染中后期M2型巨噬细胞的变化,为下一步研究M2型巨噬细胞在泡型包虫病中的调控机制的研究提供了理论依据。
