兔脊柱结核模型中结核分支杆菌对人工骨与钛金属的黏附性比较
2018-12-21孙厚杰鄢陵蔡小军韩建华范华华李代君
孙厚杰,鄢陵,蔡小军,韩建华,范华华,李代君
(遵义市第一人民医院,贵州遵义536000)
植骨融合内固定技术在脊柱结核病灶清除后能有效修复骨缺损、维持脊柱正常序列、重建脊柱稳定性[1,2]。但植骨材料的选择一直困扰着业内专家、学者。自体骨取骨量大、患者痛苦。异体骨排异反应、可能导致疾病传播。二者的广泛应用受到一定限制。目前利用钛金属作为植骨支撑材料用于结核病灶内已被多数专家学者所接受[3,4],但缺点是由于接触界面硬度不一致导致的钛网下沉及X射线遮挡效应等不利于观察融合效果。近年,n-HA/PA66复合材料在修复非感染性骨缺损方面得到良好的应用,是一种安全而有效植骨填充材料[5]。但其能否像钛金属一样安全应用在结核性骨缺损中关键在于结核分支杆菌对该材料有无黏附性及黏附力强弱。2016年1月~2018年2月,我们通过建立动物结核模型观察结核分支杆菌对两种植骨材料的黏附情况,比较脊柱结核病灶清除后两种不同材料人工骨植入的安全性问题。
1 材料与方法
1.1 材料 动物:健康新西兰白兔35只(SPF级),雌雄不限,体质量2.0~3.0 (2.65±0.25)kg,由遵义医学院动物实验中心提供。动物经严格消毒,饲养条件:温度(23±3)℃,相对湿度70%±10%,采用兔标准SPF级饲料饲养。实验植骨材料:人型结核分枝杆菌标准菌株(H37Rv)由新疆畜牧科学院兽医研究所提供;n-HA/PA66复合生物材料人工骨由四川国纳科技有限公司提供;钛金属材料由山东威高医疗器械有限公司提供;氯胺酮(0.1 g/2 mL)由福建古田药业有限公司生产;安定(10 mg/2 mL)由天津金耀药业有限公司生产;阿托品(0.5 mg/mL)由天津药业集团新郑股份有限公司生产。
1.2 动物攻毒建模术 模型制备主要参照文献[6]建模方法,并在此基础上结合相关文献[7~9]和实际情况有所改进建立模型。将实验动物用氯胺酮、安定、阿托品联合麻醉[氯胺酮、安定、阿托品按2∶2∶1(容积比)比例配制,生理盐水稀释1倍,用量约为2.5 ml/kg,耳缘静脉缓慢静注)],麻醉成功后,左侧卧位固定在兔专用固定器上,右侧腰背部脱毛、备皮,备皮直径约6 cm,术区消毒、铺巾,采用无菌器械沿右侧第12肋末向下至髂嵴作约6 cm纵切口的侧方入路,显露腰5、6椎体。于腰5椎体下缘近下终板处,从右前上方向左后下方,与椎体近端呈60°进入,钻孔(L: 0.5 cm、r: 0.25 cm),在注入结核分支杆菌前先加用硬化剂,然后填入医用明胶海绵,用注射器缓慢向明胶海绵中注入结核菌悬液(菌量: 107CFU/mL)0.1 mL,用骨蜡封闭骨钻孔,防止结核分支杆菌向周围血液及组织扩散,采用1-0丝线间断缝合切口,皮下涂洒注射用青霉素粉剂(80万U/只),无菌纱布覆盖切口,固定,动物术后单独隔离饲养,自由活动。术后2个月内观察动物一般状态,如进食、活动、精神状态、体温、体质量等。密切注意切口情况(有无感染,如感染则立即淘汰)。术后当日及每周1次检测血ESR、CRP,监测有无结核感染情况。术后当日、1个月、2个月进行X线片检查,观察造模区域有无脓肿和死骨形成,如有则记录病灶数目、范围、骨质破坏程度。X线检查应统一曝光参数:正位片(44 kV、9.0 mAs、投照距离110 cm),侧位片(45 kV、8.0 mAs、投照距离110 cm)。
1.3 分组及处理 将20只建模成功动物模型按成功时间序列号分成钛金属植入组和人工椎体植入组,每组10只。麻醉及显露同攻毒建模术,适当清理周围软组织脓液与坏死组织(勿过度清理病灶以免影响结核分支杆菌正常黏附),制备内置物植入空间,将严格灭菌消毒的微型钛板和n-HA/PA66人工骨材料,分别植入实验动物结核病灶内,缝合处理同建模。术后当日及每周检测1次体温,血浆ESR、CRP,了解结核病灶进展情况。
1.4 材料表面黏附细菌数目观察 植入内植物2个月后,采用过量的异戊巴比妥钠麻醉处死,原切口进入术区,大体观察结核病灶进展情况、周围软组织变化、有无脓肿及脓肿大小。通过扫描电镜观察钛金属、人工骨表面有无细菌黏附、聚集及产生类似生物保护膜。取出植入材料后,先用PBS缓冲液冲洗5遍,以除去表面未黏附的细菌。然后放置于4%戊二醛溶液中固定4 h以上,再用乙醇梯度脱水(依次为50%、70%、80%、90%浓度),自然干燥后喷金镀膜备用。扫描电镜下,每块材料随机抽取20个观察区,每个观察区面积为50 μm×50 μm,累计材料表面所黏附细菌数目。
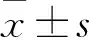
2 结果
2.1 造模后8周内动物体温、ESR及CRP变化 椎体下终板钻孔后填塞明胶海绵,注入结核菌株。建模2个月后模型兔出现黄白色腰大肌脓肿,脓肿内有砂砾样感,X线显示腰5椎体明显骨破坏,累及腰6上终板及腰5~6椎间隙。造模后,动物血ESR在第1周明显上升,以后逐渐降低,血CRP逐渐降低,体温在第1周有短暂升高后逐渐回落,说明在造模过程中结核分支杆菌植入成功,无其他病原体感染。见表1。
2.2 两组扫描电镜观察结果 结核分支杆菌对两种植骨材料的黏附数量均很少,说明对两种材料的黏附性较弱,细菌呈棒/杆状、“Y”、“r”或“L”形,均未形成明显保护膜及黏质样物;人工材料其表面所黏附菌量较钛网表面多。见图1。

表1 建模成功模型8周内ESR、CRP、体温变化

图1 扫描电镜检查结果
注:a电镜观察钛金属表面结核分支杆菌黏附情况;b电镜下人工骨材料表面结核分支杆菌黏附情况。
2.3 两组结核分支杆菌黏附数量比较 钛金属植入组结核分支杆菌数量为(81.10±3.81)个,人工椎体植入组为(97.80±5.14)个。两组比较,P=0.211。
3 讨论
目前脊柱结核外科治疗的经典术式为病灶清除植骨融合内固定术[10]。植骨材料主要有自体骨、异体骨和人工替代材料。前二者受到一定限制,自体骨易发生供骨区感染及取骨量的限制,而异体骨易发生宿主反应及疾病传播,故人工替代材料的发现尤为重要。Oga等[11]从细菌黏附的角度研究表明,与金葡菌比较,结核分支杆菌不易黏附金属异物表面,抗结核药物仍能起作用。后来Ha等[12]的研究也为结核病灶中植入钛合金材料的安全可行性提供了理论依据:钛金属组织相容性好,取材方便,支撑固定可靠,无自体骨及异体骨生物学方面限制;结核分支杆菌对钛合金的亲和力、黏附性小,不易形成生物膜。所以,作为植骨支撑材料,钛网已被普遍用于脊柱结核病灶清除后植骨融合环节。研究[13,14]发现,钛网也有其不足及应用限制,如接触界面硬度不一致,钛网下沉,使前柱高度有一定的减失,减失速率一般为4°~6°/2年;同时,钛金属对X射线的遮挡效应导致不利于观察植骨融合效果,故寻求发现更优良的植骨材料成为国内外学者探求的目标。
植骨材料相关感染是导致植骨融合失败的主要原因,而此类感染与细菌对材料的黏附密切相关,如细菌形成保护性生物膜则造成感染持续不愈,治疗失败。植物材料置入体内后,表面很快被覆盖各种吸附蛋白,细菌首先可逆地附着于材料表面,随后细菌依靠其菌毛、鞭毛、荚膜及分泌的细胞外黏质物(ESS)形成黏附并不断繁殖,较多的ESS与细胞外基质蛋白如纤维蛋白原等共同形成生物膜,加速细菌的黏附,并保护细菌免受药物及免疫攻击,常规保守治疗无效,导致植入失败。n-HA/PA66作为新型植骨材料已被成功应用于创伤骨科植骨融合中,其具有良好生物相容性、骨传导性、成骨活性及生物力学特性。但是脊柱结核属感染性病灶,结核分支杆菌对n-HA/PA66的黏附性是决定其能否应用于结核病灶内的首要问题。
本研究通过扫描电镜观察,两种植骨材料表面黏附的结核分支杆菌数量很少,仅少量细菌呈棒杆状、“Y”、“r”或“L”形,细菌周边亦未见明显黏质样物或明显保护膜。因此可见,结核分支杆菌对两种材料的黏附能力均较弱,原因可能与材料特性有关,也可能与结核分支杆菌无菌毛、鞭毛、荚膜等黏附“配体”,导致此菌活动力差有关。提示钛金属及n-HA/PA66人工材料均能安全应用于脊柱结核病灶中进行植骨融合。
周劲松等[15]研究发现,细菌的黏附与材料的性质关系不大,与材料表面的光滑度有一定关联,呈负相关。本研究中扫描电镜观察发现,n-HA/PA66人工材料表面所黏附菌量明显较钛金属表面多。其机理可能为:粗糙表面黏附表面积较大,其表面自由能、疏水性的会发生变化,表面的沟纹、凹陷部位为细菌黏附提供了“优势”部位。由此同一材料其表面光滑度是细菌黏附力的重要影响因素。故出现此结果的原因可能与n-HA/PA66人工材料表面光滑度不及钛金属有关。
本研究还发现,尽管结核分支杆菌对两类材料黏附性有差异,但统计学分析细菌黏附数量的差异无统计学意义。提示n-HA/PA66人工材料可能也可用于脊柱结核病灶中进行植骨融合。由于本研究样本量小,可能存有误差,结果不具有普遍性,加之n-HA/PA66人工材料表面硬度、光滑度不及钛金属,故应用于临床治疗结核性骨缺损还应慎重。
