siRNA沉默HDAC6对宫颈癌Hela细胞顺铂敏感性的影响
2018-12-21秦海霞尚翠玲李少平朱利红张全华王世进
秦海霞,尚翠玲,李少平,朱利红,张全华,王世进
宫颈癌是发病率仅次于乳腺癌的常见女性恶性肿瘤,严重威胁女性生命安全[1]。顺铂是宫颈癌一线化疗药物基石,但由于先天性或获得性耐药,使得部分患者无法获益[2]。组蛋白去乙酰化酶6(histone deacetylase 6,HDAC6)是重要的Ⅱ型组蛋白去乙酰化酶家族成员,其通过促多种基因乙酰化达到促肿瘤细胞侵袭和迁移的作用[3]。研究表明,HDAC6在宫颈癌组织中高表达,且其表达水平与宫颈癌临床分期、浸润程度及淋巴转移密切相关,提示HDAC6参与宫颈癌发生发展,并且发挥类似促癌基因的作用[4-5]。抑制HDAC6表达是否可起到抗宫颈癌作用,其对宫颈癌顺铂敏感性的影响又如何均尚未可知。本研究拟利用小分子干扰RNA(small interference RNA,siRNA)技术降低宫颈癌Hela细胞中HDAC6表达,并观察HDAC6表达变化对宫颈癌顺铂敏感性的影响,以期为宫颈癌分子靶向治疗提供理论依据,现报道如下。
1 材料与方法
1.1材料人宫颈癌细胞系Hela购于美国ATCC;DMEM培养基、PBS、胰酶、胎牛血清购于Gibco公司;MTT试剂盒购于博士德生物有限公司;RNA提取试剂盒购于博士德生物有限公司;Lipofectamine TM 2000脂质体购于美国Invitrogen公司;HDAC6单克隆抗体、Bcl-2单克隆抗体、Bax单克隆抗体、β-actin单克隆抗体购于大连Takara公司;细胞凋亡检测试剂盒购于BD公司;HDAC6 siRNA、Control siRNA由广州锐博科技有限公司构建。
1.2细胞培养及转染复苏Hela细胞,用DMEM培养液(1%双抗+10%FBS)悬浮细胞,37 ℃、5% CO2恒温培养。收集对数生长期的Hela细胞并接种于6孔培养板中,然后继续置于37 ℃、5%CO2恒温培养箱中培养24 h,待贴壁细胞长满底部面积的40%~50%时进行转染。细胞随机分为3组,每组3孔,即空白对照组、Control siRNA组和HDAC6 siRNA组。空白对照组加入PBS;Control siRNA组和HDAC6 siRNA组分别转染Control siRNA和HDAC6 siRNA,转染操作严格按试剂盒说明书进行。转染结束后继续恒温培养6 h,更换培养基并继续培养细胞;转染后48 h,收集各组细胞进行后续实验。
1.3RT-PCR法检测HDAC6表达转染后各组细胞,与顺铂药物作用48 h后,收集100 μg·μL-1顺铂处理后的细胞,采用Trizol试剂盒分别提取各组细胞总RNA,逆转录总RNA至cDNA,之后取1 μL逆转录产物行RT-PCR(SYBR Green法),以β-actin为内参。HDAC6上游引物序列:5’-AGGTAAAGG-GGAAGAAACAAA-3’;HDAC6下游引物序列:5’-TGCGGATGAGTTGTTTCTGGC-3’。β-actin上游引物序列:5’-CATGTCGAGTTAAGGAGAAGC-3’;β-actin下游引物序列:5’-CTTTTAGTGGAGTGCCACAGG-3’。采用2-ΔΔCt分析法对荧光定量PCR结果进行分析,在获得每个样品的Ct值之后求其平均值,随后再减去各自的内参平均Ct值,以此得到ΔCt。比较两个样本间的ΔCt值相减得到ΔΔCt值,随后求得2-ΔΔCt以得到相对基因表达差异的倍数。
1.4Westernblot法检测HDAC6蛋白表达收集转染后各组细胞并提取细胞蛋白,定量蛋白浓度后行SDS-PAGE凝胶电泳,转至硝酸纤维膜,将膜置于5%封闭液4 ℃封闭4 h,PBS洗涤3次,分别加入HDAC6单克隆抗体(1∶2 000)孵育过夜,PBS洗涤3次,二抗(1∶500)孵育4 h,PBS洗涤3次,按ECL试剂盒说明书行电化学发光检测。
1.5流式细胞仪检测顺铂诱导的细胞凋亡收集转染细胞,加入顺铂至终浓度100 μg·μL-1,继续培养48 h,PBS洗涤2次,加入500 μL结合缓冲液重悬细胞,依次加入5 μL Annexin V-FITC、5 μL磺化丙啶,室温避光孵育15 min,上流式细胞仪检测细胞凋亡。
1.6MTT法检测细胞对顺铂敏感性收集转染细胞,将细胞置于37 ℃、5%CO2恒温培养24 h,分别加入顺铂至终浓度为0、12.5、25、50、100、200 μg·μL-1,继续培养48 h后离心弃上清每孔加入5 mg·mL-1MTT溶液(每孔20 μL),继续37 ℃、5%CO2恒温继续培养4 h,离心弃上清,加入100 μL DMSO,振荡至结晶物充分溶液,采用全自动酶标仪测450 nm处OD值。细胞抑制率(%)=(1-实验组OD值/对照组OD值)×100%。计算各组细胞对顺铂的50%抑制浓度(inhibitory concentration, IC50)。
1.7顺铂诱导的凋亡基因表达收集转染后各组细胞,加入顺铂至终浓度100 μg·μL-1,继续培养48 h,提取细胞蛋白。蛋白浓度定量后SDS-PAGE凝胶电泳转膜,将膜置于5%封闭液4 ℃封闭4 h,PBS洗涤3次,分别加入Bcl-2、Bax单克隆抗体(1∶2 000)孵育过夜,PBS洗涤3次,二抗(1∶500)孵育4 h,PBS洗涤3次,按ECL试剂盒说明书行电化学发光检测。目的蛋白相对表达量=目的条带灰度值/同一样本内参灰度值。

2 结果
2.1RT-PCR检测HDAC6mRNA表达HDAC6 siRNA组HDAC6 mRNA表达(82.3±24.5)显著低于空白对照组(352.7±89.2)及Control siRNA组(361.7±77.6)(均P<0.05),见图1。
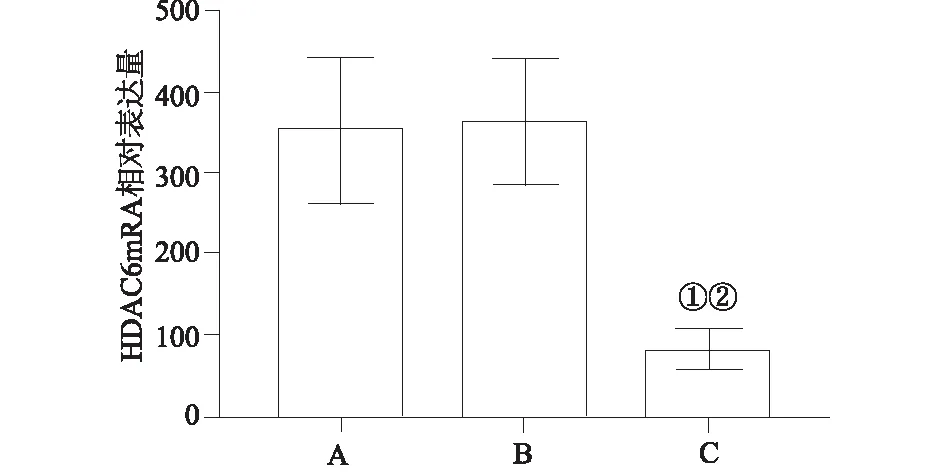
A:空白对照组;B:control siRNA组;C:HDAC6 siRNA组。①与A组比较,P<0.05;②与B组比较,P<0.05。图1 RT-PCR法检测HDAC6 mRNA表达
2.2各组HDAC6蛋白表达HDAC6 siRNA组HDAC6 蛋白表达(118.7±20.9)显著低于空白对照组(558.4±105.5)及Control siRNA组(564.9±98.5)(均P<0.05),见图2。
2.3HDAC6siRNA对凋亡的影响流式细胞术结果显示,HDAC6 siRNA组细胞凋亡率(37.6±8.7)%,显著高于空白对照组的(5.8±1.1)%及Control siRNA组的(6.4±1.3)%,见图3。
2.4HDAC6siRNA的顺铂敏感性不同浓度顺铂作用48 h后,HDAC6 siRNA组细胞存活率显著低于空白对照组及Control siRNA组(均P<0.05),见图4。

A:空白对照组;B:control siRNA组;C:HDAC6 siRNA组。①与A组比较,P<0.05;②与B组比较,P<0.05。图2 HDAC6 蛋白表达

A:空白对照组;B:control siRNA组;C:HDAC6 siRNA组。①与A组比较,P<0.05;②与B组比较,P<0.05。图3 各组细胞凋亡率比较

图4 各组细胞存活率比较
2.5HDAC6siRNA对凋亡基因表达的影响Western blot结果显示,HDAC6 siRNA组Bcl-2 蛋白表达(179.5±44.6)显著低于空白对照组(494.1±65.3)及Control siRNA组(487.2±74.1)(P<0.05),Bax蛋白表达(448.6±70.8)显著高于空白对照组(189.7±60.3)及Control siRNA组(194.2±68.4)(P<0.05),见图5。

A:空白对照组;B:control siRNA组;C:HDAC6 siRNA组。①与A组比较,P<0.05;②与B组比较,P<0.05。图5 Western blot法检测Bcl-2、Bax蛋白表达
3 讨论
宫颈癌起病隐匿,大多数患者确诊时已为中晚期,即使采用含铂类药物化疗,患者临床受益率和症状缓解率也不尽人意,其原因与铂类药物原发性及继发性耐药有关[6-7]。因此,探讨宫颈癌铂类耐药机制是提高宫颈癌化疗敏感性和改善临床预后的关键。
组蛋白的乙酰化和去乙酰化是恶性肿瘤发生发展的基础。HDCA6属于微管蛋白去乙酰化酶,定位于人染色体Xp11.23上,由1个锌指基序和2个功能性去乙酰化结构组成,其可通过依赖性和非依赖性去乙酰化通路调控微管蛋白聚集,促进肿瘤细胞的趋化性运动,从而参与肿瘤细胞的侵袭和迁移[8-10]。Wang等研究显示,抑制HDAC6表达可促进顺铂诱导的非小细胞肺癌细胞DNA损伤及细胞凋亡,提示HDAC6表达水平高低可能是影响非小细胞肺癌细胞对顺铂的敏感性的重要因素[11]。本组前期研究发现,利用siRNA技术沉默宫颈癌Hela细胞中HDCA6表达可显著抑制细胞增殖,同时促进细胞凋亡,其机制与调控细胞增殖相关蛋白p21及细胞凋亡相关蛋白Bax、Bcl-2表达有关,提示HDCA6参与宫颈癌的发生与发展,但其对宫颈癌顺铂敏感性的调控作用尚未可知。本研究结果显示,HDCA6 siRNA组宫颈癌Hela细胞中HDCA6 mRNA及蛋白表达显著高于空白对照组及Control siRNA组(均P<0.05),同时HDCA6 siRNA组IC50值显著低于空白对照组及Control siRNA组(均P<0.05),提示利用siRNA技术沉默宫颈癌Hela细胞中HDCA6表达可提高宫颈癌细胞对顺铂的敏感性。
如前所述,HDCA6可调控细胞增殖相关蛋白p21表达,而后者可通过抑制cyclin/cdk2活性负向调控细胞周期进程,其表达缺失已被证实与肿瘤细胞化疗耐药有关。故推测,沉默HDCA6表达可上调细胞增殖相关蛋白p21表达,从而减少宫颈癌细胞对顺铂的耐药性[12]。此外,流式细胞仪检测结果显示,HDCA6 siRNA组Hela细胞凋亡率显著高于空白对照组及Control siRNA组(均P<0.05),提示利用siRNA技术沉默宫颈癌Hela细胞中HDCA6表达可促细胞凋亡。进一步分析凋亡基因表达发现,HDAC6 siRNA组Bcl-2 蛋白表达显著低于空白对照组及Control siRNA组(均P<0.05),Bax蛋白表达显著高于空白对照组及Control siRNA组(均P<0.05)。Bcl-2和Bax分别是Bcl-2家族中的抑凋亡蛋白和促凋亡蛋白,Bcl-2/Bax比值是决定细胞是否进入凋亡状态的关键因素。当Bcl-2/Bax平衡倾向Bax亢进时,Bax同源二聚体迅速形成,易于诱导细胞凋亡[13-14]。本研究结果提示,鉴于Bcl-2/Bax在细胞凋亡中的核心调控地位,故推测HDAC6可通过调控Bcl-2/Bax表达,促进细胞凋亡,这可能也是沉默HDAC6表达后宫颈癌细胞顺铂敏感性提高的主要分子作用机制。
综上所述,利用siRNA技术沉默HDAC6表达可提高宫颈癌Hela细胞对顺铂的敏感性,而促进细胞凋亡可能是其主要作用机制。
