胰岛素样生长因子-1对全脑缺血大鼠学习记忆能力的影响
2018-12-20李永莉刘黎明张全波吴碧华
李永莉 赵 婧 刘黎明 张全波 刘 利 吴碧华
1.川北医学院附属医院老年科,四川南充 637000;2.川北医学院附属医院儿科,四川南充 637000
随着人口老龄化的加剧,脑缺血导致的血管性认知功能障碍(VCI)的发病率和死亡率逐渐提高,VCI患者生活能力和社会功能严重降低,已经给家庭和社会造成沉重的负担[1]。胰岛素样生长因子-1(IGF-1)在中枢神经系统中分布广泛,是一种作用于神经的非选择性营养因子,能够促进神经细胞的生长发育,并调控其功能[2-3]。IGF-1水平与认知障碍相关[4-5]。IGF-1与对应受体结合后,通过PI3K/AKT信号通路将信号传入核内,导致相应神经元功能和结构的改变[6]。本研究采用四血管阻断法建立大鼠的全脑缺血模型,再分别给予IGF-1、IGF-1+PPP(IGF-1受体阻断剂)进行干预,探讨IGF-1改善全脑缺血大鼠学习记忆能力的作用及其机制。
1 材料与方法
1.1 实验动物
Wistar雄性大鼠110只[川北医学院实验动物中心提供,实验动物合格证号为SCXK(川)2013-18],体重约300 g,8~10周龄。大鼠饲养间自然光照,温度20℃,相对湿度45%~75%,饮食不限。采用简单随机分组,将110只Wistar雄性大鼠分为正常组、假手术组、全脑缺血模型组、模型给药组1及模型给药组2,正常组和假手术组各10只,全脑缺血模型组、模型给药组1及模型给药组2各30只。本研究经川北医学院附属医院实验动物伦理委员会批准同意。
1.2 侧脑室置管术
腹腔内注射10%水合氯醛麻醉后颅骨中线备皮。将大鼠固定在脑立体定位仪上,根据Paxions等[7]的脑立体定位图谱在颅骨上定位,并安置固定螺钉。在脑立体定位仪上固定微量注射导管,垂直埋设导管(硬膜下4.5 mm左右处)并固定,最后缝合创面。
1.3 全脑缺血模型的建立及给药干预
1.3.1 全脑缺血造模方法 侧脑室置管术后第6天建立全脑缺血模型。以10%水合氯醛麻醉大鼠,在操作台上以俯卧位固定大鼠。按改良的Pulsinelli四血管法来建立全脑缺血的动物模型[8-9]。以自制烧灼器凝闭双侧椎动脉,再使气管两侧的颈总动脉游离并放置线系活结,把线缝合进切口。24 h后提起颈总动脉的放置系结,夹闭合双侧颈总动脉20 min。全脑缺血造模成功标准[10]:①大鼠双侧颈总动脉夹闭后1 min内意识丧失;②眼球逐渐变白,瞳孔散大,对光反射消失;③翻正反射消失,自主呼吸加快。
1.3.2 假手术组 手术过程除不结扎双侧颈总动脉外,其余同全脑缺血造模方法。
1.3.3 各组给药方法 全脑缺血模型组、模型给药组1、模型给药组2大鼠分别侧脑室注射生理盐水10 μL、IGF-1(0.2 μg/μL)10 μL、IGF-1+PPP(阻断剂 PPP 腹腔注射20 mg/kg,侧脑室注射IGF-1晚于腹腔注射30 min),1次/d,给药时间共7 d。假手术组大鼠侧脑室注射生理盐水10 μL。
1.4 Morris水迷宫试验
分组前,先进行水迷宫实验。采用定位航行和空间探索连续测试大鼠5 d,记录基础数据,并筛选游泳能力好、正常状态的大鼠。连续给药7 d后,再次行水迷宫实验测试各组大鼠,并收集相关数据。
1.5 HE染色和免疫组化试验
水迷宫试验后以10%水合氯醛麻醉大鼠,心脏输注新鲜4%多聚甲醛。手术剔除头骨,取出变硬的大脑,并将大脑浸泡在4%多聚甲醛中12 h使之固定。从大脑底部视交叉前等距切分厚度为2 mm的脑组织,常规固定;采用石蜡包埋,大脑组织的石蜡切片厚度约为 5 μm。
1.5.1 HE染色 对大脑组织的石蜡切片进行常规的HE染色,用光学显微镜放大400倍观察大鼠海马CA1区各神经细胞形态,并选择5个视野,拍片保存。
1.5.2 免疫组化测定 采用免疫组化方法处置大脑组织的石蜡切片,用光学显微镜放大400倍观察大鼠海马CA1区,并选择5个视野,拍片保存。每个标本选5个切片,图片采用Image Pro Plus 6.0处理,统计指标为IOD值。
1.6 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,方差齐并符合正态分布,组间比较采用SNK检验;方差齐不符合正态分布或,组间比较采用Krμskal-Wallis H秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 水迷宫实验
各组大鼠造模前原平台象限游泳时间、跨跃平台次数、平均逃避潜伏期差异均无统计学意义(P>0.05)。给药后,与正常组比较,全脑缺血模型组和模型给药组1的原平台象限游泳时间、跨跃平台次数明显减少,平均逃避潜伏期显著增加(P<0.05);与全脑缺血模型组比较,模型给药组1的原平台象限游泳时间更长、跨跃平台次数更多(P<0.05),平均逃避潜伏期更短(P<0.05);与模型给药组1比较,模型给药组2的原平台象限游泳时间更短、跨跃平台次数更少(P<0.05),平均逃避潜伏期增加(P<0.05)。 见表1。
2.2 HE染色
HE染色结果显示,全脑缺血模型组及模型给药组2大鼠海马CA1区锥体细胞异常,层次紊乱、细胞减少、排列稀疏,细胞核不规则,部分固缩。与全脑缺血模型组比较,模型给药组1海马CA1区细胞数增加,排列整齐均匀,结构较清晰。见图1。
表1 造模前和给药后各组大鼠水迷宫实验结果比较(±s)
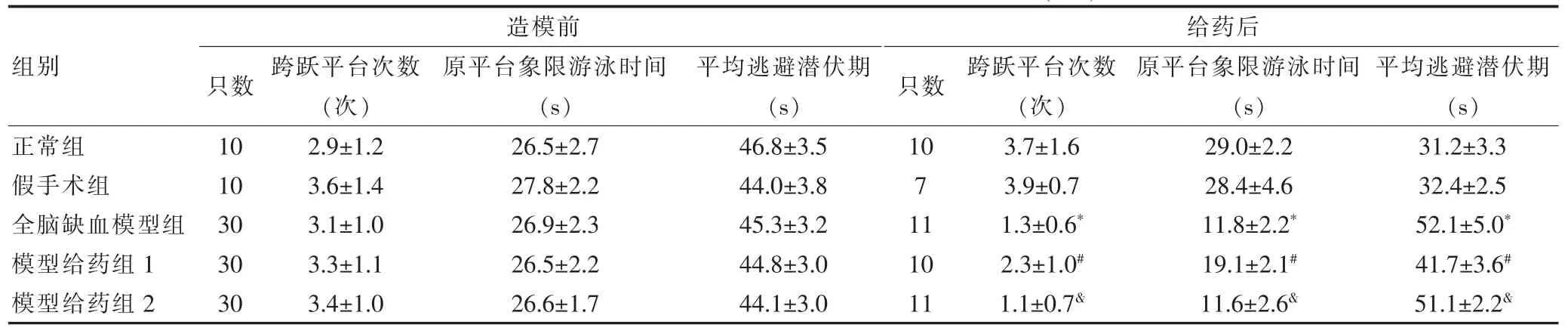
表1 造模前和给药后各组大鼠水迷宫实验结果比较(±s)
注:与正常组比较,*P<0.05;与全脑缺血模型组比较,#P<0.05;与模型给药组1比较,&P<0.05
组别正常组假手术组全脑缺血模型组模型给药组1模型给药组2造模前只数 跨跃平台次数(次)原平台象限游泳时间(s)平均逃避潜伏期(s)给药后只数 跨跃平台次数(次)原平台象限游泳时间(s)平均逃避潜伏期(s)10 10 30 30 30 2.9±1.2 3.6±1.4 3.1±1.0 3.3±1.1 3.4±1.0 26.5±2.7 27.8±2.2 26.9±2.3 26.5±2.2 26.6±1.7 46.8±3.5 44.0±3.8 45.3±3.2 44.8±3.0 44.1±3.0 10 7 11 10 11 3.7±1.6 3.9±0.7 1.3±0.6*2.3±1.0#1.1±0.7&29.0±2.2 28.4±4.6 11.8±2.2*19.1±2.1#11.6±2.6&31.2±3.3 32.4±2.5 52.1±5.0*41.7±3.6#51.1±2.2&

图1 各组大鼠海马CA1区HE染色结果(400×)
2.3 免疫组化
免疫组化结果显示,假手术组和正常组差异无统计学意义(P>0.05);与正常组和假手术组比较,全脑缺血模型组的p-Akt、p-mTOR蛋白表达显著增加(P<0.05);与正常组、假手术组和全脑缺血模型组比较,模型给药组1的p-Akt、p-mTOR蛋白表达更高(P<0.05)。与全脑缺血模型组比较,模型给药组2的p-Akt、p-mTOR蛋白表达差异无统计学意义(P>0.05);与模型给药组1比较,模型给药组 2的p-Akt、pmTOR蛋白表达显著减少(P<0.05)。见表2。
3 讨论
3.1 IGF-1
IGF-1与脑缺血损伤呈现相关性[3]。郭义君等[11]指出,急性颅脑损伤患者血浆IGF-1水平明显降低,且与认知功能密切相关。褚忠海等[12]发现皮质下缺血性脑血管病患者血清IGF-1降低。吴至凤等[13]研究提示IGF-1水平低下可能是脑瘫儿童认知水平损害的原因。
表2 各组大鼠海马CA1区p-Akt、p-mTOR的IOD值(±s)
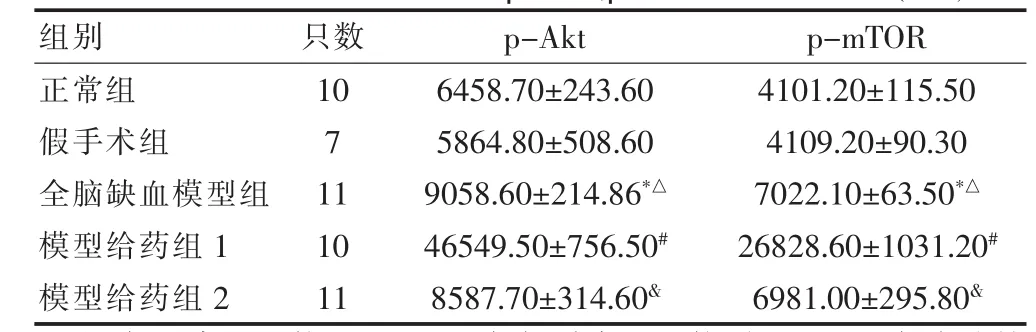
表2 各组大鼠海马CA1区p-Akt、p-mTOR的IOD值(±s)
注:与正常组比较,*P<0.05;与假手术组比较,△P<0.05;与全脑缺血模型组比较,#P<0.05,与模型给药组1比较,&P<0.05
组别 只数 p-Akt p-mTOR正常组假手术组全脑缺血模型组模型给药组1模型给药组2 10 7 11 10 11 6458.70±243.60 5864.80±508.60 9058.60±214.86*△46549.50±756.50#8587.70±314.60&4101.20±115.50 4109.20±90.30 7022.10±63.50*△26828.60±1031.20#6981.00±295.80&
IGF-1可以通过血-脑屏障的IGF-1受体进入大脑,从而发挥作用[14]。经鼻、皮下和静脉等方式给予IGF-1有效。Rizk等[15]发现静脉给予IGF-1,可减少大鼠脑梗死面积,同时能改善神经元的凋亡。石广滨[16]研究显示IGF-1能够改善痴呆模型大鼠学习记忆能力,且小剂量改善效果比大剂量好。槐雅萍[17]在脑室置管7 d后,对C57BL/6小鼠行脑反复缺血再灌注手术,手前及术后24 h经侧脑室给予2 μL IGF-1,可以改善VaD小鼠的学习记忆能力。外源性IGF-1对改善血管性认知障碍大鼠学习记忆的作用及其相关机制鲜有报道。给药方式、剂量、持续时间等仍需要进一步的研究。本研究考虑到外周给药虽然能够透过血脑屏障,但能够到达脑组织中的具体浓度不明确,且不同大鼠之间可能存在个体差异,对实验结果存在影响,故仍然选择侧脑室置管进行侧脑室给药的方式。注射剂量选择小剂量,即 0.2 μg/μL,注射时间为连续7 d,初步探讨作外源性给予IGF-1的作用。HE染色和水迷宫结果提示,外源性的IGF-1能够改善海马CA1区细胞凋亡,明显提高全脑缺血再灌注大鼠的学习记忆能力,这一作用能够被其受体阻断剂抑制。
3.2 PI3K/AKT信号通路与血管性认知障碍
磷脂酰肌醇-3-激酶/蛋白激酶B(phosphoinositide 3 kinase/Akt,PI3K/Akt)是一条参与细胞生长发育的重要信号转导通路[16]。PI3K是磷脂激酶激酶家族中的重要成员,具有蛋白激酶活性以及脂类激酶活性。Akt是一种丝氨酸/苏氨酸蛋白激酶,是PI3K/Akt信号通路的主要信号分子。该通路被PI3K激活后,活化底物,从而对细胞的生长、发育、凋亡产生影响。全脑缺血或者是局灶性脑缺血以后,p-Akt(Ser473)增加,而总Akt的表达没有变化,提示缺血损伤的神经元存活与Akt的磷酸化相关,与总Akt的水平无相关性[18]。PI3-Akt通路可分成多条信号支流发挥其作用,其中雷帕霉素靶蛋白(mTor)是该通路下游非常重要的效应器。近年来,大量研究表明IGF-1通过mTor发挥作用,阻断mTor信号能够抑制体外的少突胶质细胞生长[19]。Yi等[20]的研究显示,缺血性大鼠磷酸化的p-mTor表达明显增加,而mTor水平不变,说明磷酸化的mTor在通过中发挥作用。所以本研究选择p-Akt和pmTor蛋白作为检测PI3K/Akt信号通路的指标。全脑缺血模型组大鼠p-Akt和p-mTor蛋白表达均显著性提高,与文献[18,20]相符。给予IGF-1后,成模大鼠学习记忆能力改善,p-Akt和p-mTor蛋白表达增加;加用IGF-1受体阻断剂后p-Akt和p-mTor蛋白表达与未给予IGF-1成模大鼠差异无统计学意义(P>0.05)。由此,推测外源性IGF-1可改善大鼠学习记忆能力,该作用可能与PI3K/Akt通路的激活,p-AKt和p-mTOR蛋白表达上调密切相关。
