漫话同位素示踪法
2018-12-20张淑铭林颖韬俞如旺
张淑铭 林颖韬 俞如旺,*
(1福建师范大学生命科学学院 福州 350117; 2福建教育学院 福州 350025)
同位素是指一类原子核内具有相同质子数,但中子数不同,在元素周期表中处于同一位置的核素。其中,某些核素会因其不稳定的性质自发衰变成新核素,同时放出一种或多种射线,如α、β-、β+、γ、X等,这种特性称为放射性。具有放射性的核素称为放射性核素或放射性同位素,不具放射性的核素称为稳定同位素。
同位素示踪法则是一种以同位素作为示踪物质,对研究对象的特征和行为进行示踪观察的信息获取方法,分为两类: 放射性同位素示踪法和稳定同位素示踪法。
1 同位素示踪法的基本原理
同位素示踪法的基本原理: 利用同位素及其化合物与相对应普通元素及其化合物具有相同化学和生物学性质,但核物理性质不同的特点,将同位素作为标记物,制备成含有同位素的化合物,代替相应非标记化合物进行标记。由于放射性同位素能够放出射线,因此可通过射线的感光作用进行放射自显影,或利用射线的电离作用、荧光现象进行核探测器检测。而稳定同位素虽不具有放射性,但其在原子质量上与普通的相应同位素有差别,因此可以通过质谱仪、气相层析仪、核磁共振仪等质量分析仪来测定。
2 放射性同位素示踪法的实验过程
2.1 选择示踪剂 根据实验项目需要选择合适的示踪剂。一般与待标记有机物中所含的元素、放射性同位素的半衰期、射线种类及辐射能量以及同位素的毒性等有关[1]: ①为了达到实验的理想效果,一般选用研究对象中的特征元素进行示踪;②根据实验周期,选用半衰期合适的放射性同位素,一般能保证检测结束时,放射性同位素的含量为给入量的70%为宜;③用的核素宜为纯α、β、γ射线的发射体,保证射线能量在1.0~2.5MeV的适宜范围内;④所选示踪剂尽量避免高毒性。如实验必需,则应控制其用量在对人体和环境无害的范围之内。综上,将中学生物学探究活动中常用的几种放射性同位素的特征[2]整理成表1。
2.2 确定标记方法 根据示踪剂的性质、形态以及研究目的和对象的不同,示踪剂的标记方式也有所不同。
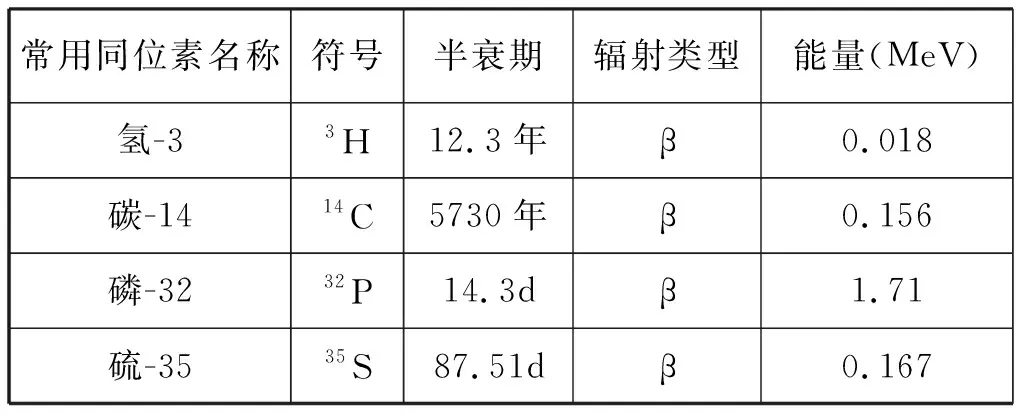
表1 中学生物学探究活动中涉及的放射性同位素的特征
对植物体的标记方法有: ①“植物营养室”培养法。在密闭的植物营养室中,通入放射性气体供植物进行光合作用。②植物地上部引入法。将示踪剂配制成浓度合适的溶液,通过涂抹、喷雾、注射等方法将示踪剂从植物的地上部引入植物体内。③植物根部引入法。即将示踪剂加入栽培介质如水、沙、土等,供给植物生长。
对于动物体的标记方法有: ①注射法。即利用针管等,将示踪剂直接注射入机体内。②口服法。通过进食、饮水、胃管或投丸等途径引入。③涂布渗入法。清除动物部分皮毛,将示踪剂涂抹于脱毛处。④吸入法。将挥发性示踪剂装入密闭系统,通过呼吸作用吸入动物体内。
对于微生物的标记方法通常用含放射性物质的培养基进行培养标记。
上述三大类标记方法在中学生物学教材中均有涉及。例如,探究光合作用有机物生成路径的实验中,卡尔文即是利用“植物营养室”培养法,在密闭的小室中,向小球藻供以14CO2进行光合作用;探究分泌蛋白合成与运输路径的实验中,詹姆森等通过注射法,向豚鼠的胰腺腺泡细胞注射3H标记的亮氨酸;探究生物体遗传物质的实验中,赫尔希与蔡斯则是利用含32P与35S的大肠杆菌作为活体培养基,实现对噬菌体DNA及蛋白质外壳的标记。
2.3 制备放射性生物样品 不同形态的样品,其制备方法也有所不同。植物体常用打孔法或匀浆法,如探究光合作用有机物生成路径实验即是通过研磨小球藻,制备匀浆样品。动物体组织既可采用匀浆法,也可进行细胞组织切片的制作,如探究分泌蛋白合成与运输路径的实验中,采取的方法即制备豚鼠胰腺腺泡细胞的超薄切片。对于沉淀等干物质的样品制备,则需先将其置于70~80℃的烘箱中烘干,并用研钵研磨制取粉末,再放入烘箱烘干,之后取出干燥制成薄膜状样品。液体样品一般可直接进行测量,或利用热风吹、电热板或红外灯进行干燥铺样。如在噬菌体侵染大肠杆菌的实验中,对沉淀物采取薄膜样品制备,而上清液则利用仪器烘干进行铺样检测。
2.4 测量样品放射性 放射性的检测主要通过核探测器测量以及放射自显影技术。
2.4.1 核探测器选择依据及检测原理 测量放射性的核探测器主要有气体电离探测器、闪烁计数器以及半导体探测器3种。其中气体电离探测器包括电离室、正比计数管以及盖革-弥勒计数器3类。闪烁计数器根据闪烁体的形态不同分为固体和液体闪烁计数器两类。
在示踪实验中,核探测器的选择与同位素放射的射线性质有关。放射α射线的同位素,采用电离室进行检测;放射低能β射线的同位素,采用正比计数管或盖革-弥勒计数器检测;放射中能β射线以及高能β射线的同位素,采用β计数管或正比计数管检测;放射γ射线的同位素,则采用γ计数管或晶体闪烁计数器检测。中学教材中涉及到的放射性同位素,其射线性质均为β射线,其中3H、14C、35S放射的是低能β射线,32P放射的是中能β射线,因此检测仪器一般选用正比计数管或盖革-弥勒计数器。
结合教材中噬菌体侵染大肠杆菌的实验,对盖革-弥勒计数器的结构及工作原理进行简要介绍。盖革-弥勒计数器由高压电源、盖革-弥勒计数管(G-M管)以及定标器组成。其中,高压电源为计数管提供电压;定标器记录由计数管输出的脉冲;G-M管根据其外形可分为钟罩型和圆柱型,内部充有惰性气体。
在噬菌体侵染大肠杆菌的实验中,使用的为钟罩型计数管(图1)。在实验中,分别将分离后的上清液以及沉淀物置于计数管内,由于32P以及35S衰变放射出β射线,使管内原有的气体被电离形成离子对。负离子被阳极吸引移向阳极,在此过程中,负离子会与管内气体发生碰撞,产生次级电子,在快到达阳极时,次级电子急剧倍增,产生“雪崩”现象,形成脉冲数,后经放大由定标器记录。而正离子则被阴极吸引,当移到阴极时,会再次产生电子,从而形成下一个脉冲数。由于管内惰性气体会与正离子发生电荷中和,因此防止了持续放电的情况。在测量过程中,通过改变电压,分别记录不同电压下的脉冲数,制作计数管的特性曲线进行数据分析,得出放射性强度。该实验的最终结果,在被35S标记的实验组上清液中,检测到较高的放射性。而在被32P标记的实验组沉淀物中,检测到较高的放射性,从而确定了DNA为遗传物质[3]。

图1 钟罩型计数管
2.4.2 放射自显影技术原理 中学生物学教材中分泌蛋白合成与运输的实验,即是利用该项技术进行放射性检测。科学家分别在不同时间处死豚鼠,并制备其胰腺腺泡细胞的超薄切片。之后,将卤化银乳胶膜均匀敷于切片表面,置于暗室中曝光。由于3H衰变放射出β射线,与卤化银晶体颗粒反应,使其转变为金属银颗粒形成潜影,再经显影、定影后,即可用显微镜进行观察。该实验最终使用最佳的三次显影效果确定了分泌蛋白合成与运输的路径。
3 稳定同位素示踪法的实验过程
稳定同位素示踪法的实验过程与放射性同位素示踪法相比较为简便,其示踪剂的选择以及给入过程与之相同,在此不作赘述。以下简要介绍稳定同位素示踪过程中样品的制备以及测量的方法。
3.1 制备生物样品 常见的样品制备方法有: ①含N同位素样品的制备,利用凯氏法或杜氏法将含氮有机生物样品转化为分子态的氮(N2);②含C同位素样品的制备,通过燃烧法将碳转化为气态的CO2;③含O同位素样品的制备,利用不含氧的催化剂在高温条件下使有机物转化为气态的CO2。
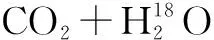
尽管同位素示踪法应用广泛,但仍存在局限性,并不能解决所有的问题,往往需配合其他技术才能发挥作用。在中学教材中,探究DNA复制方式的实验,即是将稳定同位素示踪法与平衡密度梯度离心技术相结合。将含有14N和15N标记的大肠杆菌培养液,在浓缩的CsCl溶液中进行高速密度梯度离心。在离心的过程中,DNA由于受到离心力场的作用,聚集到溶液密度等于其自身浮力密度的区域。因子代DNA含有不同N标记的亚基,其密度也就不同,致使结果出现不同位置的条带,进而可通过紫外照相及紫外扫描确定条带位置。最终结果表明,DNA的复制方式为半保留复制,即每个子代只得到亲代的一个亚基且世代稳定遗传[5]。
