重组人甲状旁腺素1-34治疗绝经后骨质疏松症的临床研究
2018-12-19陆彬彬高爱国
陆彬彬 高爱国
南京医科大学附属无锡市人民医院,江苏 无锡 214021
骨质疏松症是以骨密度降低及骨组织微细结构破坏为主要特征的全身性、隐匿性疾病,易致患者骨强度降低、骨脆性增加,从而导致全身骨痛、驼背变矮,严重者会发生骨质疏松性骨折,主要为胸腰椎体压缩性骨折及髋关节骨折。目前临床上出现了以重组人甲状旁腺素1-34为代表的促进骨形成的抗骨质疏松药物,但由于骨质疏松治疗时间较长,患者依从性较差,此药物的临床应用报道很少。本次研究采用基因重组技术制备的人甲状旁腺素1-34(特立帕肽)治疗绝经后骨质疏松症,连续应用26周,并于治疗前及治疗后的13和26周测定腰椎(L1-4)和股骨近端骨密度(BMD),采静脉血测定骨代谢指标,应用VAS评分评价患者的疼痛程度,记录不良反应。通过对比治疗前后患者骨密度、骨代谢指标及疼痛程度的变化来评价该药物的临床疗效。
1 材料和方法
1.1 病例资料
对我院2016年5月至2017年5月入院诊断为骨质疏松症的老年女性患者进行研究对象的筛选,绝经时间≥3年,平均年龄(71±9)岁,平均身高(167±10)cm, 平均体重(53±9)kg。
纳入标准:所有选取研究对象在治疗前均采用双能X线骨密度测量仪检测骨密度,根据WHO推荐的“原发性骨质疏松症诊断标准”,骨密度用T-Score(T 值)表示,T值≤-2.5 个标准差为骨质疏松;T值≥-1.0 个标准差为正常。
排除标准:①之前已连续使用重组人甲状旁腺激素1-34超过 3 个月 (短期使用的,经过1年洗脱期可以入组);②之前 1 年里长期系统使用糖皮质激素或其他影响骨代谢的药物;③之前 3 个月内接受过双膦酸盐、雌激素、雷洛昔芬或降钙素治疗;④之前接受过锶盐治疗;⑤有肾上腺、甲状旁腺、甲状腺、性腺等影响骨代谢的内分泌疾病;⑥患有心、肝、肾、肺等严重原发系统疾病;⑦患者拒绝接受重组人甲状旁腺激素1-34药物治疗[1]。
1.2 研究方法
筛选出的所有患者入组后均口服元素钙 500 mg/d(钙尔奇D,美国惠氏制药有限公司)和维生素 D(罗盖全,上海罗氏制药有限公司)200U/d,连续服用26周后加用重组人甲状旁腺素1-34(特立帕肽,美国礼来公司),用法为每天皮下注射 20μg特立帕肽。通过门诊测定患者腰椎(L1-4)和股骨近端骨密度(BMD),采静脉血测定血清骨钙素(OC)、碱性磷酸酶水平,应用疼痛视觉模拟评分法(VAS 评分)评价患者的疼痛程度,并记录下用药期间的不良反应情况。
1.3 观察指标
①疼痛视觉模拟评分法(VAS 评分):评价患者的疼痛程度,即在标有 VAS评分的直尺上,两端分别标明有 “0”和 “10”字样。 “0”cm 代表无痛, “10” cm 代表最剧烈的疼痛。患者根据自己感受的疼痛程度,在对应的直线上标出相应位置,即为评分值。评分值越高,表示疼痛的程度越重。②骨密度测量:采用双能X线骨密度测量仪分别在用药前及用药后13、26周时测定患者全身、腰椎1-4和股骨颈的骨密度(BMD),所有步骤由计算机自行进行定位、数据采集及处理。③骨代谢指标:取清晨空腹肘静脉血5 mL,分离血清后进行测定。碱性磷酸酶:是组织非特异性碱性磷酸酶的一种特殊形式,由成熟阶段成骨细胞合成并分泌,与细胞外骨基质结合,是反映骨形成的特异敏感指标。骨钙素:血清中骨钙素可迅速被降解,使得其片段可被抗体检测,其中 N-MID 片断稳定性及灵敏度好,可用于监测骨代谢水平,反映近期成骨细胞活性,骨代谢越快,骨钙素水平越高,反之则越低。④不良反应:通过随访记录用药期间发生的不良反应情况。
1.4 统计学处理
2 结果
2.1 入组患者基线资料
应用特立帕肽治疗前患者基线资料见表1。

表1 患者基线资料Table 1 The baseline data of the 〗
2.2 应用特立帕肽治疗前及治疗后13、26周BMD变化
应用特立帕肽治疗前及治疗后13、26周BMD变化见表2。
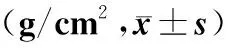
表2 特立帕肽治疗前及治疗后13、26周BMD变化Table 2 The change of BMD before and after 13 and 26 weeks of teriparatide
注:与治疗前比较,*P<0.05。
治疗13周时,腰椎L1-4、股骨颈、大粗隆和股骨干骨密度改善不明显(P>0.05),治疗26周时,腰椎L1-4和股骨颈骨密度较治疗前明显增高(P<0.05),而大粗隆和股骨干骨密度改善不明显(P>0.05)。
2.3 应用特立帕肽治疗前及治疗后13、26周骨代谢指标变化
应用特立帕肽治疗前及治疗后13、26周骨代谢指标变化见表3。

表3 特立帕肽治疗前及治疗后13、26周骨代谢指标变化Table 3 The change of bone metabolic index before and after 13 and 26 weeks of teriparatide
注:与治疗前比较,*P<0.05。
治疗13周时,血清骨钙素和骨碱性磷酸酶较治疗前升高(P<0.05)。治疗26周时,血清骨钙素和骨碱性磷酸酶呈持续升高趋势(P<0.05)。
2.4 应用特立帕肽治疗前及治疗后13、26周VAS评分变化
应用特立帕肽治疗前及治疗后13、26周VAS评分变化见表4。

表4 特立帕肽治疗前及治疗后13、26周VAS评分变化Table 4 The change of VAS before and after 13 and 26 weeks of teriparatide
注:与治疗前比较,*P<0.05。
治疗13周时,疼痛缓解明显(P<0.05),治疗26周时,疼痛明显减轻(P<0.05)。
2.5 治疗后发生不良反应情况
治疗后发生不良反应情况见表5。
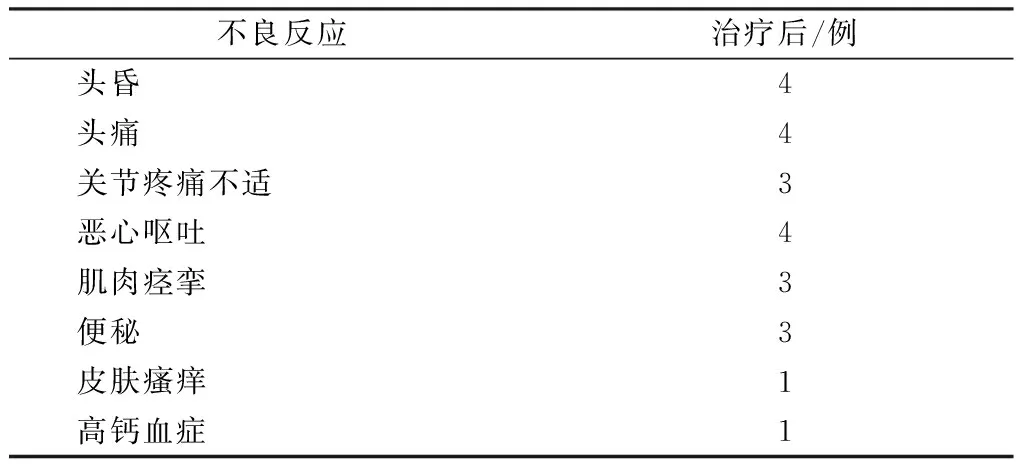
表5 治疗后发生不良事件Table 5 The adverse events after the treatment
治疗期间不良反应的情况均较轻微,没有给予特殊处理即自行缓解。
3 讨论
骨质疏松是一种骨骼脆性增加和易发生骨折的全身性疾病,以低骨量和骨组织的微结构破坏为特征。 据世界卫生组织统计, 目前骨质疏松的患病率已在全世界多发病、常见病中位居前列,全世界患病人数超过 2 亿。骨质疏松性骨折的直接致残和间接致死率高,因此早期预防和治疗骨质疏松有重要意义[2]。
目前在临床上治疗绝经后骨质疏松症应用最广泛的药物为抑制骨吸收类药物,如:双膦酸盐、降钙素、雌激素、易普拉芬等。此类药物主要通过抑制骨吸收来提高骨密度,但难以维持正常骨量及骨强度,适合于骨代谢呈高转换的患者。在骨质疏松性骨折的围术期应用抑制骨吸收类的药物会影响患者的骨折愈合,存在一定风险且患者长期服用会出现疗效下降和不良反应。而临床上出现的以重组人甲状旁腺素1-34(特立帕肽)为代表的促进骨形成的药物可以弥补这些不足。
特立帕肽是经生物合成技术,以大肠杆菌为宿主生产的hPTH的活性片段,保持其中34个氨基酸序列与hPTH的N端氨基酸序列的一致,具有hPTH的生物活性。hPTH在血液中具有调节钙磷代谢的功能,是由84个氨基酸所组成的直链多肽分子,分子中不含半胱氨酸,其氨基端为hPTH的活性端,主要与PTH I型受体结合影响成骨过程[3];羧基端具有免疫反应效应,可由hPTH降解生成也可由甲状旁腺分泌。hPTH 受体属于G蛋白偶联受体超家族,分为hPTH Ⅰ型和hPTH Ⅱ型。hPTH Ⅰ 受体主要位于骨骼及肾组织,对hPTH及相关蛋白拥有相同的激活力和亲和力,其中hPTH的N端肽链与hPTH Ⅰ受体结合可促进骨细胞生长;hPTH Ⅱ受体主要位于胰腺及脑组织,与hPTH Ⅰ受体具有部分同源性,可选择性结合hPTH, hPTH的C端肽链与hPTH Ⅱ受体结合可促进骨细胞凋亡[4]。特立帕肽不仅保存了与hPTH Ⅰ受体结合调节成骨细胞的作用,同时能消除了hPTH的C端肽链所带来的促骨细胞凋亡作用[5]。
特立帕肽可发挥不同的生物活性来介导和调节全身骨代谢:增强成骨细胞分化、激活骨衬细胞及抑制成骨细胞凋亡等。其可通过 hPTH Ⅰ受体激活磷脂酶C,增加IP3和DG,进而激活PKC(蛋白激酶C),导致活性成骨细胞凋亡减少、数量增多,促进成骨细胞及骨衬细胞增殖;也可通过激活腺苷酸环化酶,催化生成cAMP(环磷酸腺苷),激活PKA(蛋白激酶A)来刺激骨衬细胞、成骨细胞及骨髓基质干细胞表面的hPHT Ⅰ型受体,进一步促进成骨细胞分化、延长成骨细胞寿命;也可通过调节细胞因子来间接调节骨代谢,如诱导促生长因子(IGF-1)与成骨细胞结合,刺激骨生长等[6],在治疗骨质疏松症方面有独特疗效。
目前国外已有部分临床研究,如Gomberg等[7]通过前瞻性研究对因退行性腰椎滑脱而施行椎管减压椎弓根螺钉固定植骨融合术后,使用特立帕肽和利塞膦酸钠的绝经后骨质疏松患者进行比较,一组每日皮下注射20μg特立帕肽(29例),另一组每周口服利塞膦酸钠(28例),结果显示术后1年两组疼痛改善无显著性差异,骨愈合率分别为82%和62%,平均骨愈合时间分别为8周和10周,认为皮下注射特立帕肽较口服利塞膦酸钠更有效。后续研究发现,12个月 后 特 立 帕 肽 组 椎 弓 根 螺 钉 松 动 率(7%~13%)较利塞膦酸钠组(13%~26%)明显降低(P<0.05),认为特立帕肽可提高腰椎骨髓和椎弓根皮质质量。如Sato 等[8]对绝经后骨质疏松女性患者进行随机筛选,每日给予皮下注射特立帕肽治疗,通过双能X 线测定治疗前及治疗后 18 个月患者的骨密度进行对比,结果显示在每日给予皮下注射20 μg特立帕肽后,腰椎骨密度增加 9%,股骨颈骨密度增加 3%,桡骨远端骨密度无明显变化;而每日给予皮下注射40 μg 特立帕肽后,腰椎骨密度增加 13%,股骨颈骨密度增加 6%,桡骨远端骨密度无明显变化。在一项研究中[9],428例糖皮质激素诱导发生骨质疏松的患者分别接受皮下注射20μg/d特立帕肽和应用10μg/d阿仑膦酸钠进行治疗,随访36个月后,结果显示特立帕肽组骨形成标志物如Ⅰ型原胶原氨基端前肽(PINP)和骨钙素(OC)显著增加,骨吸收标志物如CTX仅在应用特立帕肽治疗的6个月间增加较明显;而阿仑膦酸钠组在该三个指标上均明显降低。可见作为促进骨吸收的代表药物,特立帕肽能提高骨质疏松患者骨密度,增强骨骼强度,降低胸腰椎、髋部等骨折的风险,并且在改善骨结构,促进骨折愈合方面也有显著的临床疗效。且特立帕肽不良反应较轻,相对安全可靠。其与传统的抗骨质疏松药物对比,拥有更突出的效果。
本次研究综合分析了患者骨密度、骨代谢指标及VAS评分,可以更加准确的评价特立帕肽应用于骨质疏松症的临床效果。通过比较应用特立帕肽治疗前后患者在BMD、骨代谢指标、VAS评分上的变化,发现治疗13周时,血清骨钙素和碱性磷酸酶较治疗前升高,疼痛缓解明显,但对骨密度的影响较小;治疗26周时,腰椎L1-4和股骨颈骨密度较治疗前明显增高,血清骨钙素和碱性磷酸酶也呈持续升高趋势。可见特立帕肽有激活成骨细胞活性,改善骨骼细微结构的功能,可增加骨密度、促进骨形成、改善骨骼质量、加速骨折愈合,具有独特的治疗优势。此外在治疗期间,通过随访记录患者不良反应的情况,发现大部分患者不良反应的发生均较轻微。当然,由于人力、物力的限制,且考虑到长期观察患者的依从性会降低,仅对患者进行观察26周,没有观察到特立帕肽对患者的长期影响。虽然在动物试验中发现,应用特立帕肽两年的大鼠约有45%发生恶性骨肿瘤,在特立帕肽上市后,很少报道发生骨肉瘤或骨肿瘤病例,并没有证据可以说明两者间有因果关系[10]。
特立帕肽在国内的临床使用尚未普及,部分问题需继续研究,如患者在接受24个月后,是否能继续用药、继续用药的最佳时间或继续用药的临床疗效情况,目前还没有足够的临床研究可以证实;特立帕肽能否制作成口服药来加以推广和简化患者的治疗方式;特立帕肽与其他抗骨质疏松药物的联合使用及具体联合用药的方式等都需更多的临床试验加以证明。
