PI3K/Akt信号通路在肢体缺血后处理减轻脑缺血再灌注损伤中的实验研究
2018-12-19王国峰刘伯芹官明德
王国峰, 刘伯芹, 王 滨, 官明德
急性缺血性脑卒中严重危害人们的健康,急性缺血性脑卒中的治疗,无论是目前公认和首选的静脉溶栓,还是动脉溶栓、机械取栓、血管成形、支架术等血管内介入治疗,最终目的都是为了开通血管,实现缺血脑组织再灌注。但同时,在脑组织缺血再灌注(ischemia-reperfusion,IR)过程中,会出现IR损伤,进一步加剧神经细胞的死亡。2017年急性缺血性脑卒中早期血管内介入治疗流程与规范专家共识中也明确指出,血管再通后的过度灌注综合征是一种非常严重的并发症[1]。如何最大限度降低IR损伤已成为目前脑血管领域研究的热点问题。近年来大量研究发现,肢体缺血后处理(limb ischemic postconditioning,LIP)可通过多种机制参与IR的保护[2]。其中,磷脂酰肌醇3激酶(phosphatidyl inositol 3 kinase,PI3K)、丝-苏氨酸蛋白激酶(serine-threonine kinase,Akt)信号通路在IR损伤中扮演重要角色。PI3K/Akt信号通路激活后可通过多种途径抑制细胞凋亡,减轻IR损伤,发挥其神经保护作用[3,4]。但是,关于PI3K/Akt信号途径在LIP减轻脑IR损伤中的研究,国内外尚未见报道。本研究通过创建大鼠LIP模型,检测脑缺血再灌注后p-Akt、Caspase-9、Bcl-2的表达,探讨PI3K/Akt信号途径在LIP减轻脑IR损伤中的作用。
1 材料与方法
1.1 实验动物及分组 健康雄性Wistar大鼠42只,SPF级,3月龄,体重250~300 g,由青岛市药物检验所实验动物中心提供(动物合格证号:SCXK(鲁)20130010)。实验动物随机分为3组,分别为对照组、缺血再灌注组(IR)、肢体缺血后处理组(LIP),每组均14只。其中,7只用于TTC染色测定脑梗死体积,剩余7只用于测定p-Ak、Caspase-9、Bcl-2表达。所有实验动物予实验开始前适应环境7 d,单笼饲养,自由饮食。实验动物及实验过程符合中华人民共和国科技部颁布的《关于善待实验动物的指导性意见》要求[5]。
1.2 模型制作 ①IR模型制备:采用线栓法,参照Zea-Longa等[6]大脑中动脉局灶性脑缺血模型的制备方法,10%水合氯醛腹腔注射麻醉后仰卧于手术台上,分离左侧颈总、颈外及颈内动脉,结扎颈外动脉远端,动脉夹夹闭颈总及颈内动脉,在颈外动脉结扎线近端距分叉5 mm处剪一约0.2 mm小口并导入线栓(线栓直径0.24 mm),经颈总动脉分叉部进入颈内动脉,向上深入至分叉以上(18.5±2)mm,遇阻力停止。结扎颈外动脉近心端,松开颈总和颈内动脉夹,2 h后轻轻抽出栓线至分叉处形成再灌注。②LIP模型制备:参照Ren等[7]处理方法制作肢体缺血后处理模型,局灶性脑缺血2 h后再灌注前,分离左侧股动脉,使用动脉夹夹闭左侧股动脉,行3个循环5 min缺血和5 min再灌注的肢体缺血后处理。对照组均为假手术,给予暴露颈总动脉及左侧股动脉,不插线栓,不实施后处理。IR组在缺血2 h再灌注前亦分离左侧股动脉,但不实施后处理。按Menzies[8]等级评分法,在动物清醒状态下,出现右前肢不能伸展、爬行时向右侧转圈并存活至规定时间点作为造模成功的标准。所有动物均在再灌注24 h后处死。死亡动物通过随机原则补齐数量并重新造模。
1.3 TTC染色检测梗死体积 TTC染色按照谢惠芳等[9]的处理方法进行操作。每组随机选取7只大鼠,快速断头取脑,距额极2 mm向后连续等距切取5个冠状脑片,间距2 mm,37 ℃水浴,避光、体积分数0.01TTC缓冲液染色30 min,蒸馏水冲洗、40 g/L多聚甲醛的PBS溶液中固定保存。正常脑组织染为红色,梗死组织为白色。使用Simple PCI图像分析软件(美国Compix公司)计算梗死体积百分比=(非缺血侧体积-缺血侧正常脑组织体积)/非缺血侧体积×100%,非缺血侧体积或者缺血侧正常脑组织体积= (s1+s2+s3+s4+s5)×2 [s表示每片应该计算的面积,2表示每片厚度(mm)]
1.4 免疫组化法检测p-Akt、Caspase-9、Bcl-2蛋白表达 对p-Akt、caspase-9、Bcl-2蛋白的检测采用免疫组织化学染色法,参照试剂盒提供的实验步骤进行操作:石蜡切片脱蜡至水,3%H2O2室温10 min,切片浸入0.01 mol/L的枸橼酸盐缓冲液,微波炉加热至沸腾后断电,间隔5 min后,反复2次。滴加5%的BSA封闭液,室温20 min。滴加1∶100工作浓度的一抗,4℃过夜后。滴加生物素化二抗,37 ℃孵育30 min。滴加试剂SABC,37℃孵育30 min。DAB室温显色,镜下控制反应时间。所有切片均在同一光强度下,同一放大倍数下进行,胞浆出现棕色颗粒为阳性着色。在低倍镜下选择观察缺血灶周围区视野,主要在皮质区取4个象限选择视野,然后在高倍镜下计数阳性细胞。(即用型SABC试剂盒、DAB显色试剂盒、抗p-Akt、caspase-9、Bcl-2单克隆抗体均购于武汉博士德生物技术有限公司)。
1.5 原位杂交法检测Caspase-9、Bcl-2 mRNA的表达 对caspase-9、Bcl-2 mRNA的检测采用原位杂交法,其中对大鼠caspase-9 mRNA探针序列为:①5’-CCTGT GGCCA CTGCC TCATT ATCAA CAATG-3’;②5’-GGCTG TCAGG CCAGC CACCT GCAGT TCCCA-3’;③5’-GAAGA CCTGC CTCCT GCCCT GCTTA GGGTC-3’。对大鼠Bcl-2 mRNA探针序列为:①5’-GATGA AGTAC ATCCA TTATA AGCTG TCACA-3’;②5’-GCGCT CAGCC CTGTG CCACC TGTGG TCCAC-3’;③5’-GGGAG ATGTC ACCCC TGGTG GACAA CATCG-3’。严格按照试剂盒说明操作:脱蜡至水,灭活内源性酶;滴加3%柠檬酸新鲜稀释的胃蛋白酶暴露mRNA核酸片段;室温后固定10 min;滴加20 μl预杂交液,样品置于湿盒中,恒温箱40 ℃4 h;滴加20 μl杂交液,将原位杂交专用盖玻片的保护膜揭开后,盖在切片上,恒温箱40 ℃杂交过夜;杂交后洗涤、滴加封闭液,37 ℃孵育30 min;滴加生物素化鼠抗地高辛,37 ℃孵育60 min;滴加SABC,37 ℃孵育20 min;滴加生物素过氧化酶:37 ℃孵育20 min;DAB显色30 min,水洗、封片。光镜下观察,胞浆出现棕黄色颗粒者为阳性细胞。所有切片均在同一光强度下,同一放大倍数下进行,在低倍镜下选择观察视野,皮质区取4个象限选择视野,然后在高倍镜下计数阳性细胞。(即用型SABC试剂盒、PBS缓冲液、DAB显色试剂盒、大鼠Caspase-9、Bcl-2原位杂交试剂盒均购于武汉博士德生物工程有限公司)。
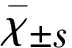
2 结 果
2.1 脑梗死体积 TTC染色对照组脑组织呈均匀红色,无梗死灶。LIP组与IR组脑组织染色均见白色缺血灶,主要位于额、顶、颞叶皮质,纹状体及海马区亦可见缺血灶(见图1)。而LIP组脑梗死体积显著小于IR组(P<0.05)(见表1、图1)。
2.2 p-Akt蛋白表达 p-Akt蛋白在对照组即有表达,包括皮层、纹状体及海马区内的神经元胞浆内,表现为棕色颗粒。缺血再灌注后p-Akt蛋白表达有所升高,肢体缺血后处理可明显增加p-Akt蛋白的表达,LIP组p-Akt蛋白表达较对照组及IR组比较均有统计学意义(P<0.05)(见表1,图2)。
2.3 Bcl-2、Caspase-9蛋白及mRNA表达 Bcl-2蛋白在对照组表达较多,IR后,Bcl-2蛋白表达有所下降,LIP可明显增加缺血灶周边区Bcl-2蛋白的表达,且LIP组Bcl-2蛋白表达较对照组及IR组比较均有统计学意义(P<0.05)(见表1、图3)。Caspase-9蛋白在对照组极少表达,散在于神经元细胞浆中,阳性细胞呈棕黄色颗粒。IR后,Caspase-9蛋白表达明显增加,分布于缺血灶周边神经元细胞浆,皮质、纹状体区均可见到,LIP后Caspase-9蛋白表达有所下降,且LIP组Caspase-9蛋白表达较IR组明显减少,差异有统计学意义(P<0.05)(见表1、图4)。Bcl-2 mRNA、Caspase-9 mRNA表达变化较Bcl-2蛋白、Caspase-9蛋白变化大致相同,Bcl-2 mRNA在对照组表达较多,IR后,Bcl-2 mRNA表达有所下降,LIP可明显增加缺血灶周边区Bcl-2 mRNA的表达,且LIP组Bcl-2 mRNA表达较对照组及IR组比较均有统计学意义(P<0.05)(见表1,图5)。Caspase-9 mRNA在对照组极少表达,IR后,Caspase-9 mRNA表达明显增加,LIP后Caspase-9 mRNA表达有所下降,且LIP组Caspase-9 mRNA表达较IR组明显减少,有统计学意义(P<0.05)(见表1,图6)。
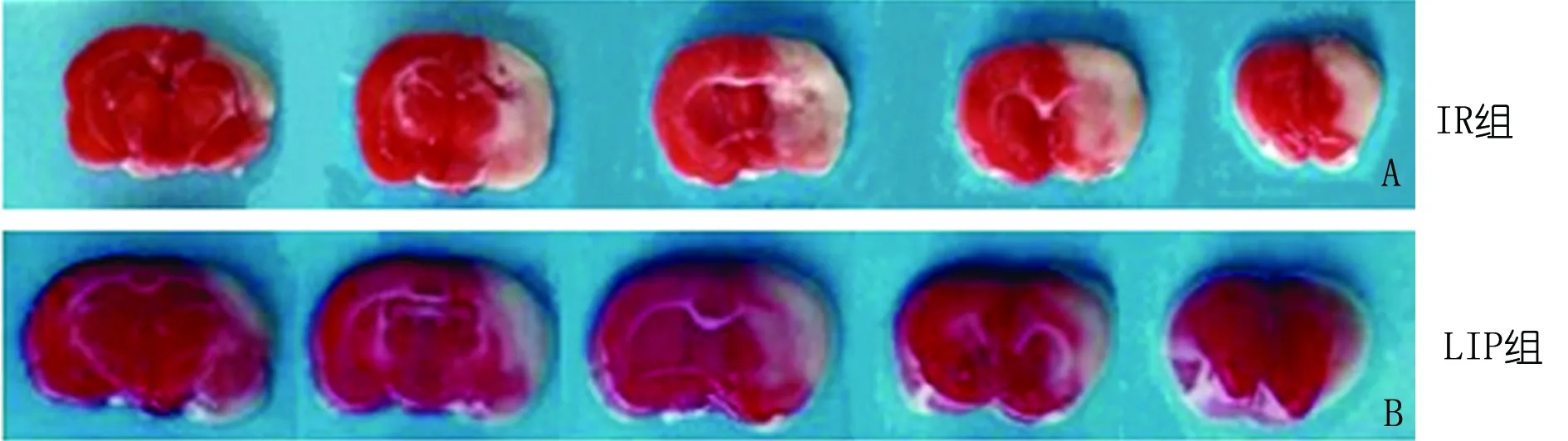
图1 脑梗死体积TTC染色
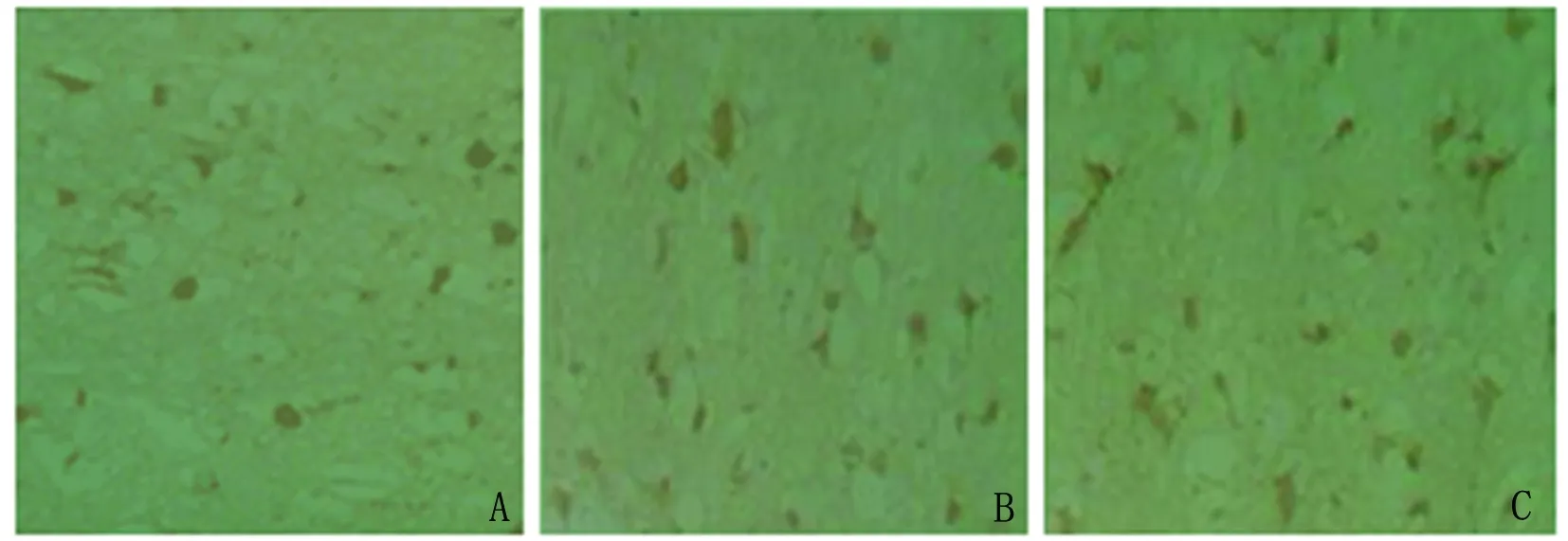
图2 p-Akt蛋白表达,A为对照组,B为IR组,C为LIP组(SABC,×400)

图3 Bcl-2蛋白表达,A为对照组,B为IR组,C为LIP组(SABC,×400)

图4 Caspase-9蛋白表达,A为对照组,B为IR组,C为LIP组(SABC,×400)

图5 Bcl-2 mRNA表达,A为对照组,B为IR组,C为LIP组(DAB,×400)
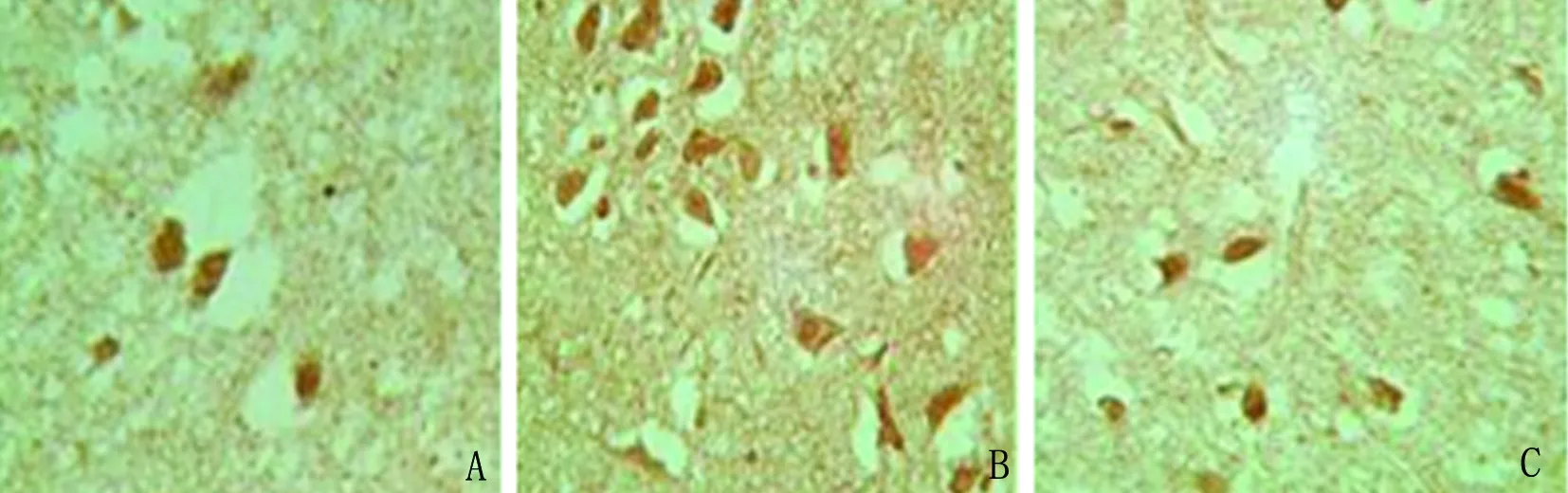
图6 Caspase-9 mRNA表达,A为对照组,B为IR组,C为LIP组(DAB,×400)

组别梗死体积百分比p-Akt蛋白Bcl-2蛋白Caspase-9蛋白Bcl-2 mRNACaspase-9 mRNA对照组IR组LIP组F值 P值038.29±2.2731.11±3.00∗25.350.006.90±0.978.94±1.10﹟14.74±1.51∗﹟78.140.00 14.91±1.2011.30±1.66﹟18.61±1.81∗﹟37.590.001.6±0.52 9.77±1.47﹟4.97±1.07∗﹟96.640.0013.16±1.9112.00±2.1117.57±1.78∗﹟16.130.002.61±1.0710.70±1.58﹟5.84±0.89∗﹟78.810.00
与IR组比较*P<0.05,与对照组比较﹟P<0.05
3 讨 论
急性缺血性脑卒中早期治疗的目的最终都是为了开通血管,实现缺血脑组织的再灌注,但在脑IR过程中,由于自由基过度形成、钙离子超载、兴奋性氨基酸、炎性介质、细胞凋亡等一系列的变化,会出现神经细胞的再损伤,而PI3K/Akt信号通路是一种重要的细胞信号通路,激活后可通过多种途径抑制细胞凋亡,减轻缺血再灌注损伤。活化的Ras能直接结合并激活P13K的P110催化亚基,PI3K活化后将二磷酸磷脂酰肌醇转化生成第二信使三磷酸磷脂酰肌醇,然后通过激活生存信号激酶Akt等靶蛋白来调控细胞生存。其中,Akt又称蛋白激酶B(protein kinases B,PKB),是一种丝氨酸/苏氨酸蛋白激酶,主要通过PI3K激活。PI3K可使Akt的Ser473和Thr308位点磷酸化,激活后的Akt可通过对含有丝氨酸/苏氨酸残基的底物磷酸化,譬如激活其下游的Bcl、Caspase等发挥其广泛的生物学效应,包括促进细胞凋亡、抗细胞凋亡、促细胞生存等功能[10,11]。而LIP在脑梗死急性期具有明显的神经保护作用,其机制也可能是通过降低神经细胞凋亡水平来实现[12]。
缺血后处理是相对于先前提出的缺血预处理而言,由于缺血事件存在太多的不可预见性,在缺血预处理得不到广泛临床应用的情况下,缺血后处理的研究就显得颇为重要,但在实际工作中,由于急性缺血再灌注受于时间窗的限制、靶器官缺血的复杂多变以及增加原位缺血可能会进一步加剧缺血组织的损害等诸多因素,这种原位缺血后处理[13]的临床应用也受到限制。伴随研究的深入,LIP的概念逐渐被提出,在机体重要器官发生致命的缺血缺氧损伤后,再灌注发生开始前或开始后,通过给以肢体进行短暂、可逆的非创伤性缺血缺氧刺激,可激活机体的内源性保护机制,诱导内源性保护因子的产生,并通过多种细胞信号通路途径,作用于靶器官,从而降低靶器官的损伤[14,15]。我们实验中通过3个循环5 min缺血、5 min再灌注的方式反复夹闭健侧股动脉建立大鼠LIP模型,发现LIP组大鼠脑梗死体积较IR组明显减小,说明通过短暂、反复夹闭健侧股动脉的LIP是一种可以减轻脑IR损伤的方法。
在动物实验模型中发现[16],远程缺血后处理可通过提高fibulin-5 mRNA和蛋白的表达从而激活PI3K/AKT信号途径来抑制细胞凋亡。我们在实验中发现,缺血再灌注后p-Akt蛋白表达有所升高,LIP可明显增加p-Akt蛋白的表达,说明脑缺血再灌注可影响p-Akt蛋白的表达,而通过夹闭健侧股动脉的LIP可进一步激活Akt,刺激p-Akt蛋白的表达。同时,活化的Akt对其下游底物产生影响,其中,缺血灶周边区Bcl-2的表达明显增加,Caspase-9表达明显减少。而上调的Bcl-2可能通过抑制内质网Ca2+的释放、调节核内外运输及、阻止促凋亡基因信号传递、抑制氧自由基等多种途径发挥抗细胞凋亡作用。同时,Caspase-9作为Caspase级联瀑布反应的启动蛋白酶,LIP后Caspase-9表达减少可通过降低其下游的Caspases始动和级联瀑布效应从而减少细胞凋亡、减轻缺血再灌注损伤。由此可见,LIP可加强Akt的磷酸化,并上调Bcl-2、下调Caspase-9表达,通过介导PI3K/Akt信号通路,多种途径减轻脑IR损伤。
尽管缺血后处理在脑保护中的作用研究比较多,但是PI3K/Akt信号途径在LIP的研究鲜有报道,本实验首次通过夹闭健侧股动脉的LIP来检测再灌注后p-Akt 蛋白及其下游Bcl-2、Caspase-9蛋白及其mRNA的表达,并探讨了PI3K/Akt信号通路在脑IR损伤中的保护作用。当然,本实验也存在许多不足之处,未进行PI3K/Akt上游及下游其它靶蛋白的检测,同时,缺血再灌注超过24 h后p-Akt、Caspase-9、Bcl-2的表达变化及细胞凋亡、炎性反应、神经发生等因素的检测亦有待进一步研究。
综上所述,夹闭健侧股动脉的LIP可上调p-Akt蛋白、Bcl-2 蛋白及其mRNA,下调Caspase-9蛋白及mRNA表达,并减轻脑梗死体积。PI3K/Akt信号通路可能在LIP减轻脑IR损伤中发挥了重要保护作用,这为临床中对急性脑梗死再灌注损伤的治疗提供新的思路,也为急性脑梗死在脑保护方面提供初步实验依据。
