基于T2*值和P300对脑铁含量在阿尔茨海默病认知功能障碍中的研究
2018-12-19宋慧慧顾卫国
陈 浩, 宋慧慧, 顾卫国, 孙 岩, 张 媛
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变,轻度认知功能损害(Mild cognitive impairment,MCI)是AD的前期状态,与AD具有相同的病理生理基础[1],因此对MCI的早期预测显得尤为重要。氧化应激损伤在MCI及AD的发病机制中扮演重要的角色,铁在其中起核心作用[2,3],已有研究显示T2*值可以估测脑铁含量[4,5]。目前对MCI及AD认知功能评价手段多依赖于神经心理学测试,而事件相关电位P300是反映认知功能的一个重要的、稳定的、可靠的指标,可弥补主观的认知神经心理学测试的不足。既往有关于AD患者脑铁异常沉积的研究针对的对象多为重度AD患者,且认知测量手段多为神经心理学测试。因此,本研究以MCI、轻度AD为研究对象,检测相关脑区T2*值及事件相关电位P300相关参数,评估局部脑铁含量与认知功能之间的相关性,并探讨相关脑区铁异常沉积作为临床诊断指标的可行性,旨在为AD的临床早期诊断及早期干预提供影像学参考。
1 对象与方法
1.1 对象
1.1.1 轻度认知功能损害(MCI)组 选择2015年1月~2016年12月我院门诊或住院MCI患者22例,男12例,女10例;平均年龄为(63.5±7.9)岁;平均病程为(1.2±0.7)y;平均受教育年限为(6.9±4.2)y;简易精神状态量表(the Mini-Mental State Examination,MMSE)评分24~27分,临床痴呆评定 (Clinical Dementia Rating,CDR)评分0.5;无胆碱酯酶抑制剂使用史,有认知损害但日常生活能力保留,不符合痴呆诊断标准者。排除意识障碍以及其他可能引起认知损害的原因,如脑血管疾病(包括脑出血、脑梗死),血清学检查除外叶酸水平低下、VitB12水平低下及甲状腺功能低下,头部MRI平扫除外脑梗死灶、软化灶及其他占位性病变等。
1.1.2 AD组 24例,男性13例,女性11例,平均年龄(65.7±11.4)岁,平均病程为(1.9±1.2)y;平均受教育年限为(6.5±4.6)y。均符合美国国立神经病学、语言机能障碍和国立卒中研究所老年期痴呆及相关疾病学会的关于AD的诊断标准,简易智力状态量表(MMSE)评分21~23分,CDR评分为1,Hachinski缺血指数<4分,MRI排除血管性痴呆和其他可导致痴呆的神经系统疾病,无严重躯体疾病和烟酒等物质滥用情况,无胆碱酯酶抑制剂使用史,排除抑郁症,即汉密尔顿抑郁量表17项版本(Hamilton Depression Scale,HAMD-17)<17分。
1.1.3 正常对照组 选取与患者性别、年龄及教育年限相匹配的苏州市广济医院职工和家属25例为对照组,MMSE评分≥28分,CDR评分0,躯体检查和实验室检查结果均未见异常,排除神经、精神疾病,无严重烟、酒等物质滥用情况。其中男性13例,女性12例;平均年龄为(62.8±8.1)岁;平均受教育年限为(7.1±4.9)y。3组间年龄、性别、教育年限等差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准,全部受试者对本研究知情,并签署知情同意书。
1.2 方法
1.2.1 MRI扫描方式与序列 所有受试者在检查前静坐休息30 min,并向其解释检查过程,以保证对检查高度合作,并强调检查时严格避免头部移动以保证图像质量。采用德国西门子3.0T超导型MRI成像系统行头部MR扫描。先行常规T1WI、T2WI及弥散加权(DWI)横断面成像,以排除颅脑其他器质性病变。在常规成像检查序列之后,使用多回波梯度回波序列采集头部轴位T2*WI,扫描参数为重复时间(TR)=100 ms,回波时问(TE)=10 ms,反转角(FA)=25°,激励次数(Nex)=3,视野(FOV)=250 mm×250 mm,矩阵=128 mm×100 mm,层厚5 mm,扫描时长40 s。
1.2.2 T2*图像后处理及T2*值的测量 将所获得的原始数据传输至Siemens工作站上,利用工作站自带的自动分析软件进行处理,获取T2*图,分别由2名放射科医师(1名高年资医师、1名主治医师)经过训练后盲法手动勾画感兴趣区(双侧额叶白质、内侧颞叶皮质、海马、红核、黑质、尾状核头、苍白球、壳核、和丘脑),计算机将自动给出感兴趣区内的T2*值,并在1 w后重复测量,结果取平均值,同时将每一受试者左、右侧别脑区的信号取平均值。为减少人为误差,同时采用Kappa检验以检测测量的一致性。
1.2.3 事件相关电位P300检查 P300检查由本院神经电生理室1名中级职称专业检查技师进行统一操作,采用德国Brain Products 公司的ERP 记录与分析系统,电极放置按国际10/20系统配位法,记录电极置于Cz点,参考电极置于双耳,前额正中接地,所有电极间电阻<5 kΩ,。所用电极为直径8 mm氯化银盘状电极。使用听觉Oddball法,通过耳机给予声刺激,强度为80 dB。1000 Hz的低频纯音为非靶刺激,概率80%;2000 Hz的高频纯音为靶刺激,概率为20%,两种信号以4∶1的比例随机出现,共250次,强度为80 dB,100 ms升/降及100 ms平台时间,分析时间700 ms。每位受试者均进行2轮,第1轮为学习和适应,第2轮正式记录并采样分析。若受试者辨别失误率超过20%则该试验无效。脑电由头皮引出后,经美国尼高力公司的脑诱发电位仪型号Brovo分别对2种信号叠加和显示,脑电波伪迹由记录仪自动辨别和排除,直至获得250次有效刺激后方告试验结束。整个测试在安静的室内进行,受试者坐于椅上,全身肌肉放松并保持头脑清醒及注意力集中。测试前向受试者说明测试目的和要求。主要观测指标为Cz点记录到的潜伏期N2、P3和波幅P3。
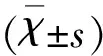
2 结 果
2.1 3组局部脑区T2*值比较 方差分析结果显示,各组T2*值均符合正态分布且具有方差齐性。3组内侧颞叶皮质(F=3.45,P<0.05)、海马(F=10.09,P<0.01)、黑质(F=4.37,P<0.05)的T2*值差异有统计学意义。额叶白质、红核、尾状核头、苍白球、壳核、丘脑差异均无统计学意义(P均>0.05)(见图1)。
LSD-t检验结果显示,MCI组和正常对照组铁沉积差异有统计学意义的区域包括海马(LSD-t=2.33,P<0.05)、黑质(LSD-t=2.06,P<0.05)。轻度AD组和正常对照组铁沉积差异有统计学意义的区域包括内侧颞叶皮质(LSD-t=2.62,P<0.05)、海马(LSD-t=4.49,P<0.01)、黑质(LSD-t=2.85,P<0.05)。MCI组和AD组铁沉积差异有统计学意义的区域包括海马(LSD-t=2.04,P<0.05)(见表1)。
2.2 3组P300潜伏期N2、P3和波幅P3比较 方差分析结果显示,潜伏期N2、波幅P3差异有统计学意义(F=12.24、26.44,P均<0.01);潜伏期P3在3组之间差异无统计学意义(F=1.85,P>0.05)。LSD-t检验结果显示,MCI、AD患者潜伏期N2较对照组长(LSD-t=2.01、4.93,P均<0.05);MCI、AD患者波幅P3较对照组短(LSD-t=-2.17、-7.13,P均<0.05);潜伏期P3差异无统计学意义(LSD-t=0.90、1.92,P均>0.05)。AD组较MCI患者组潜伏期N2长(LSD-t=2.79,P<0.01)、波幅P3短(LSD-t=-4.75,P<0.01)(见表2)。
2.3 相关分析 MCI组海马T2*值与潜伏期N2呈负相关、波幅P3呈正相关(r=-0.73、0.57,P均<0.05);AD组内侧颞叶皮质、海马、黑质T2*值与潜伏期N2均呈负相关(r=-0.84、-0.82、-0.48,P均<0.05;AD组内侧颞叶皮质、海马、黑质T2*值与波幅P3均呈正相关(r=0.50、0.41、0.43,P均<0.05)(见图2)。
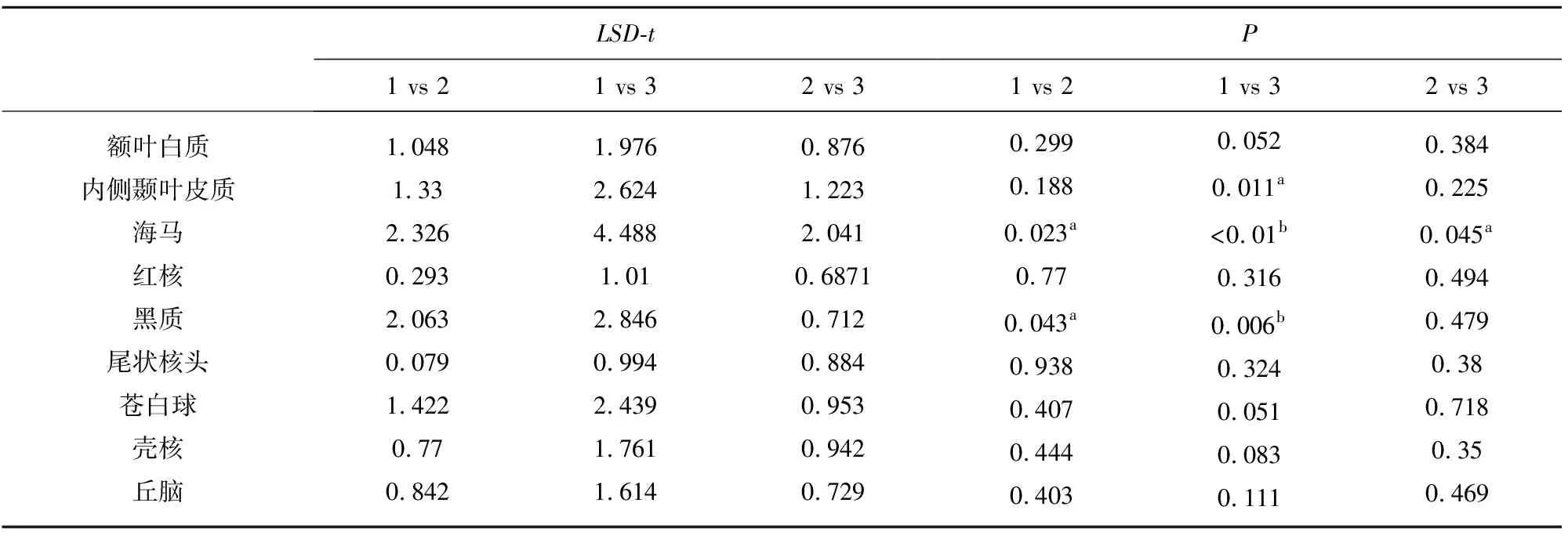
表1 3组脑区T2*值两两比较
注:1:对照组,2:mCI组,3:AD组;a:P<0.05,b:P<0.01
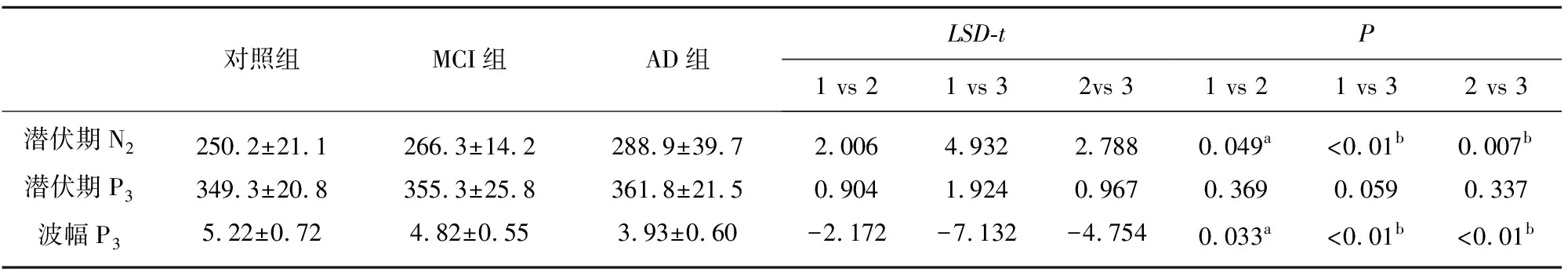
表2 3组P300潜伏期N2、P3和波幅P3比较
注:1:对照组,2:mCI组,3:AD组;a:P<0.05,b:P<0.01
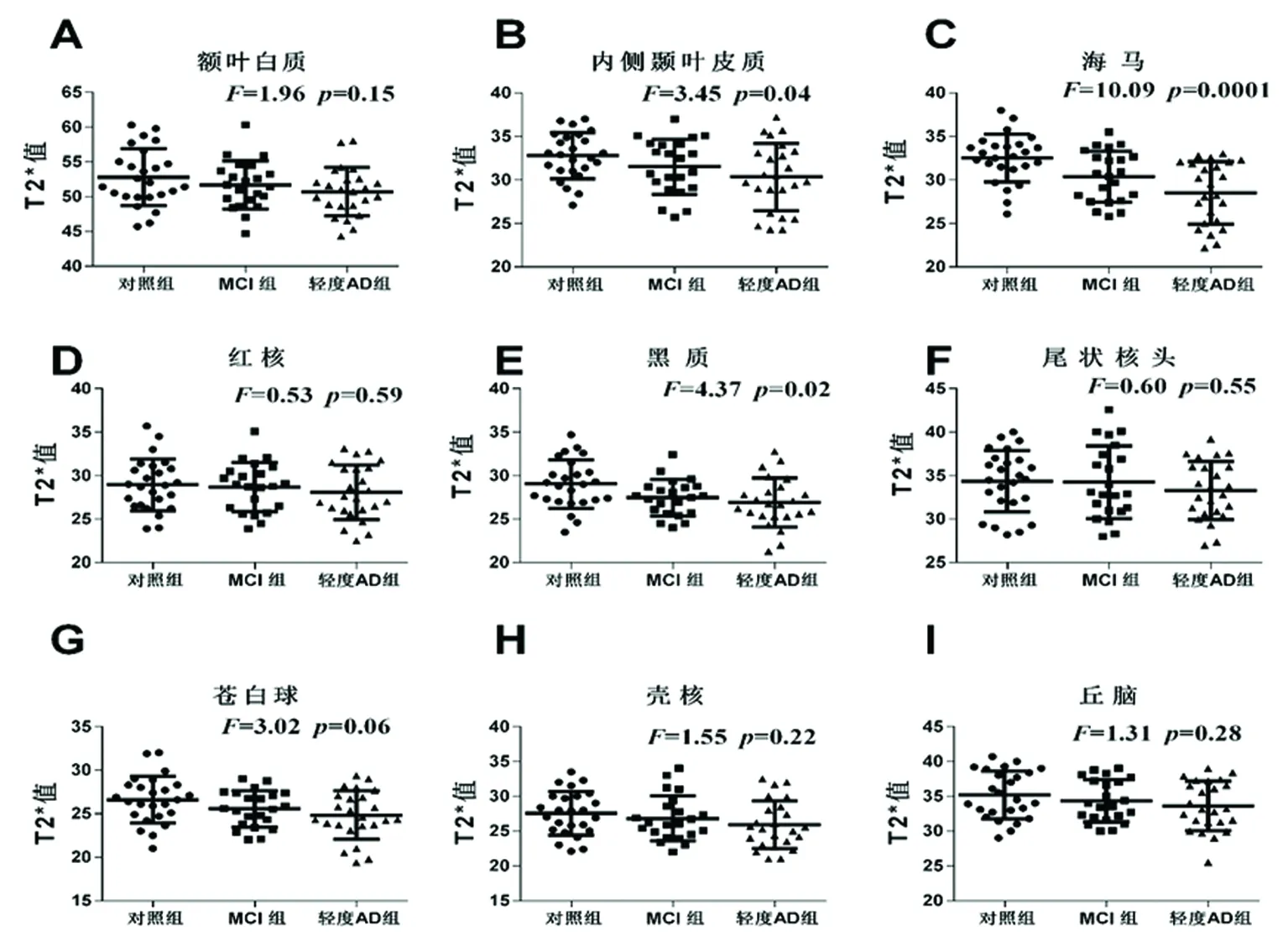
图1 3组局部脑区T2*值比较

图2 相关脑区T2*值与潜伏期N2、波幅P3散点图
3 讨 论
随着中国人口老龄化进程的加快及随着个体年龄的增长,AD的患病率和发病率不断上升,而临床诊断的AD患者多都处于中晚期,现有的治疗并不能阻止或逆转疾病的进展,因此对于AD的早期预测显得尤为重要。目前AD的发病机制仍不明了,较为公认的主要是淀粉样前蛋白的异常导致蛋白成分漏出细胞膜,导致神经元纤维缠结和细胞死亡,即脑血管淀粉样变性(cerebral amyloid angiopathy,CAA),而铁的过量沉积可明显抑制淀粉前蛋白的加工过程[6],并可引起周围组织弛豫时间的改变,即T2时间[7]。本研究结果显示,MCI患者表现为海马、黑质区域铁含量的异常增多,轻度AD患者除了上述脑区,内侧颞叶皮质亦受累。与已有的组织病理学研究证实的亚临床AD及MCI患者大脑皮层铁含量显著增高基本一致[8]。Ramin等[5]通过定量分析AD患者的T2信号强度发现豆状核壳、红核区的T2*值显著降低。上述研究与我们的结果不相一致的原因可能与研究对象的异质性以及测量方法的不同有关。
事件相关电位 P300结果显示无论是MCI或轻度AD较对照组均表现为潜伏期N2延长,波幅P3降低,且轻度AD组变化更显著。现已有足够的证据证明事件相关电位P300对AD早期认知功能改变较为敏感,可反应早期的注意力和记忆力改变,表现为潜伏期延长、波幅缩短[9,10],这与我们的研究结果基本相符,也提示MCI及AD患者加工听觉信息时,大脑对外部刺激进行选择注意、分类、编码、识别的速度变慢,且大脑的有效资源动员程度降低[11]。有研究提示P300潜伏期和波幅的改变可作为MCI转化为AD过程的监测指标[12],但Papaliagkas等[13]发现他们之间并没有明显的关联性。不一致的原因可能与患者的年龄较广泛,痴呆类型不一样以及样本不具有代表性等有关。
本研究相关分析结果显示,MCI患者海马、黑质,轻度AD患者海马、内侧颞叶皮质及黑质区的T2*值与潜伏期N2、波幅P3均有明显的相关性,提示海马、内侧颞叶皮质及黑质铁过量沉积更能反应认知功能受损的程度。这与Ding关于海马区铁含量与神经心理学测试结果呈明显相关性的研究结果基本相符[14]。颞叶在AD的病理生理学中扮演了重要的角色,尤其是海马[15],且其在疾病的早期即已发生萎缩[16,17],结合本实验结果笔者推测可能与早期神经原纤维缠结、血管淀粉样蛋白聚集变性等这些病理生理改变导致正常的铁平衡遭到破坏,而过量的铁沉积又会进一步加剧β-淀粉样蛋白的聚集对神经细胞的神经毒性作用[18],这种恶性循环最终引起海马、内侧颞叶结构及功能异常,以及随后出现的认知功能下降。研究的结果显示黑质区铁含量亦异常沉积,笔者猜测这一改变引起多巴胺神经元的丢失,这可能与部分AD患者伴有PD或椎体外系运动障碍的症状密切相关。
目前关于神经影像学及电生理联合应用于AD早期阶段的报道甚少,本研究显示MCI、轻度AD患者存在海马、黑质及内侧颞叶T2*值异常,且与认知功能相关,这或可作为固定的测量指标,用以反映AD患者早期铁过量沉积这一病理生理学改变,为临床AD早期诊断及早期干预提供一个有价值的辅助指标。但本研究的局限是一存在样本量较少、图像扫描技术匮乏;二是本研究为横向研究,尚不清楚AD有关上述指标的转化结局。今后还需扩大样本量,同时对同一病例进行不同时间点的随访观察的纵向研究。
