天麻素注射液对丛集性头痛抗氧化能力、炎症反应及免疫功能的影响
2018-12-18李井文魏江山
李井文,魏江山
洪泽县人民医院神经内科,江苏 淮安 223100
丛集性头痛又被称为组胺释放性头痛、偏头痛、睫状神经痛以及霍通综合征[1]。近年,随着人们生活压力的增加及生活方式的改变,本病发病率显著升高,在青中年脑力劳动者中发病率接近30%,因其对患者生活质量、工作能力等的综合影响而越来越受到重视[2-3]。目前对于本病的发病机制尚未完全明了,故缺乏有效的治疗手段以及药物,多以对症支持治疗为主[4]。现代医学研究表明[5],天麻素注射液具有较好的扩张脑血管、改善脑部血流、增加椎基底动脉血流量等作用,同时还具有一定的降压、镇静与抗血小板聚集效果[6-7],已经广泛用来辅助治疗丛集性头痛,虽然其能有效改善患者临床症状[8],但对患者抗氧化能力、炎症反应及免疫功能影响目前尚无相关报道,为弥补以上空白,本研究主要探讨天麻素注射液对丛集性头痛患者抗氧化能力、炎症反应及免疫功能的影响,现报道如下:
1 资料与方法
1.1 临床资料 将2011年2月至2015年8月在洪泽县人民医院收治的丛集性头痛患者80例按照随机数字表法分为2组,每组40例,观察组中男26例,女14例;年龄18~60 岁,平均(45.6±2.5)岁;丛集性头痛病程 1~15 年,平均(5.5±1.1)年;对照组中男25例,女15例;年龄 18~60 岁,平均(45.6±2.6)岁;丛集性头痛病程1~15年,平均(5.4±1.0)年,2组基线资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准[9]符合2010年中华中医学会《中医病症诊断疗效标准》。
1.3 纳入标准 纳入:1)头痛视觉模拟评分超过3分者;2)符合诊断标准者;3)治疗前2周未针对头痛进行任何医学干预治疗者;4)年龄18~60岁;5)研究方案经医院伦理委员会批准,且患者及家属知情同意。
1.4 排除标准 排除:1)合并精神疾病、颈椎结核或恶性肿瘤、严重心肺肝肾功能障碍、糖尿病者;2)血压超过180/110 mmHg者;3)妊娠及哺乳期妇女;4)对使用药物过敏者及签字拒绝入组者。
1.5 治疗方法 2组患者均行对症支持处理,并且在发病时口服麦角胺咖啡因片(哈尔滨泰华药业股份有限公司,批号:20110315、20140106)1~2 mg,同时给予吸氧及卧床处理,呕吐者给予止吐药物,严重疼痛时给予解热镇痛药物等。
1.5.1 对照组 给予尼莫地平(山东健康药业有限公司,批号:201103H159,201401H009,规格:30mg/片)每次40mg,早中晚各1次,餐后口服。
1.5.2 观察组 在对照组基础上肌肉注射天麻素注射液(江西国药有限责任公司,批号:2011030101、2014011005,规格:0.2 g∶2 m)每次100 mg,1次/d,2组连续治疗14天为1个疗程。
1.6 观察指标 对2组患者进行为期6个月的随访。采用美国BioRad 450型全自动生化检测仪(美国BioRad公司提供)及分光光度法检测丙二醛(MDA),采用酶速率法检测超氧化物歧化酶(SOD),采用比色法检测谷光甘肽过氧化物酶(GSH-px)水平,采用酶联免疫吸附法(ELISA)检测肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)及超敏C反应蛋白(hs-CRP),采用ELISA法测定免疫球蛋白IgG、IgA及IgM水平,由具有5年以上工作经验的检验医师严格按照说明书进行。成人正常值MDA为3.52~4.78nmol/mL,SOD 为 242~620 U/L,GSH-px 为 26~34 U/L,TNF-α 为 1~10 ng/mL,IL-1 为 130~250 ng/mL,hs-CRP 为≤10 mg/L,IgG 为 23.6~9.6 mg/L,IgM 为 3.05~3.85 mg/L,IgA 为 3.14~4.66 mg/L。
1.7 统计学方法 应用SPSS 13.0软件分析数据,计量资料以(±s)表示,组间均数比较采用t检验,组间率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 MDA、SOD、GSH-px变化情况 观察组SOD及GSH-px水平高于对照组(P<0.05),MDA水平低于对照组(P<0.05),见表1。
表 1 2 组患者 MDA、SOD、GSH-px 变化情况(±s)
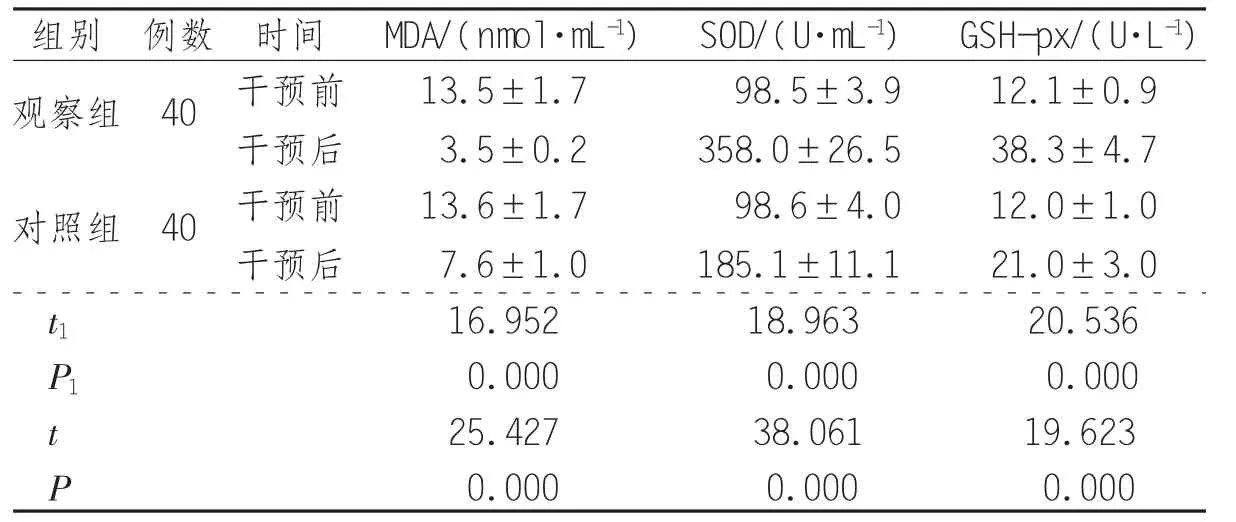
表 1 2 组患者 MDA、SOD、GSH-px 变化情况(±s)
注:t和P为干预后2组组间比较,t1和P1为观察组干预前后比较
组别 例数 时间 MDA/(nmol·mL-1) SOD/(U·mL-1) GSH-px/(U·L-1)观察组 40 干预前 13.5±1.7 98.5±3.9 12.1±0.9干预后 3.5±0.2 358.0±26.5 38.3±4.7对照组 40 干预前 13.6±1.7 98.6±4.0 12.0±1.0干预后 7.6±1.0 185.1±11.1 21.0±3.0 t1 16.952 18.963 20.536 P1 0.000 0.000 0.000 t 25.427 38.061 19.623 P 0.000 0.000 0.000
2.2 TNF-α、IL-1、hs-CRP变化情况 观察组患者 TNF-α、IL-1及hs-CRP水平均低于对照组(P<0.05),见表2。
表 2 2 组患者 TNF-α、IL-1、hs-CRP 变化情况(±s)
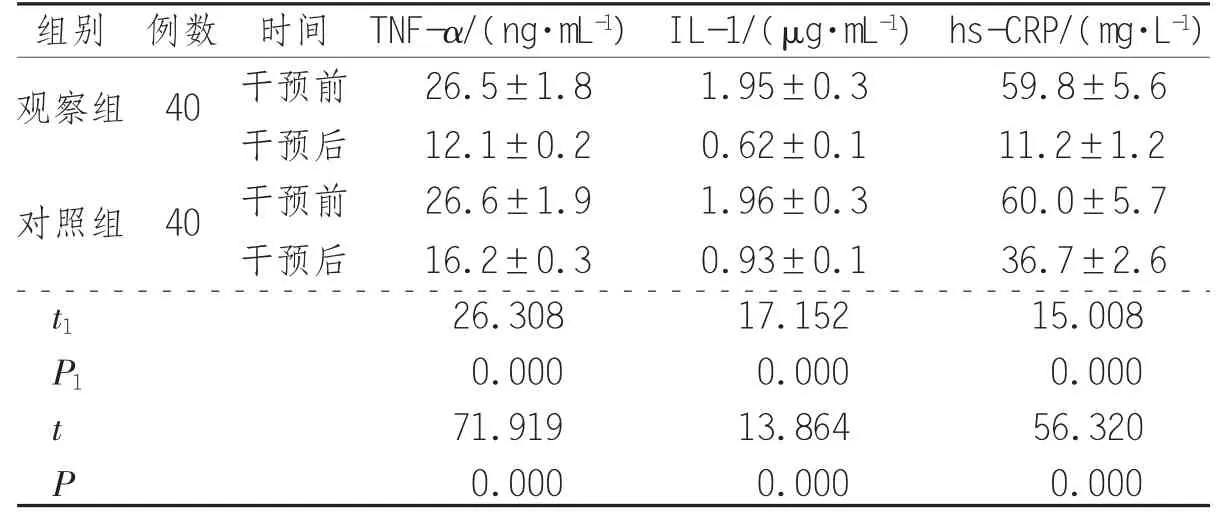
表 2 2 组患者 TNF-α、IL-1、hs-CRP 变化情况(±s)
注:t和P为干预后2组组间比较,t1和P1为观察组干预前后比较
组别 例数 时间 TNF-α/(ng·mL-1) IL-1/(μg·mL-1) hs-CRP/(mg·L-1)观察组 40 干预前 26.5±1.8 1.95±0.3 59.8±5.6干预后 12.1±0.2 0.62±0.1 11.2±1.2对照组 40 干预前 26.6±1.9 1.96±0.3 60.0±5.7干预后 16.2±0.3 0.93±0.1 36.7±2.6 t1 26.308 17.152 15.008 P1 0.000 0.000 0.000 t 71.919 13.864 56.320 P 0.000 0.000 0.000
2.3 IgM、IgG、IgA变化情况 观察组IgM、IgG和IgA水平高于对照组(P<0.05),见表 3。
表3 2组患者免疫球蛋白变化情况比较(±s) g/L

表3 2组患者免疫球蛋白变化情况比较(±s) g/L
注:t和P为干预后2组组间比较,t1和P1为观察组干预前后比较
组别 例数 时间 IgM IgG IgA观察组 40 干预前 0.6±0.1 5.1±0.6 1.0±0.1干预后 1.6±0.03 9.5±0.12 3.9±0.2对照组 40 干预前 0.6±0.1 5.1±0.6 1.0±0.1干预后 1.3±0.02 8.8±0.10 1.8±0.15 t1 69.899 71.528 76.305 P1 0.000 0.000 0.000 t 52.623 28.342 53.126 P 0.000 0.000 0.000
3 讨论
丛集性头痛好发于中青年男性,其发病机制目前主要有血管源性学说以及神经源性学说两大类[6-8]。以往西药治疗主要以对症支持处理为主,其中扩血管药物常用麦角胺咖啡因片及尼莫地平[9]。临床证实,短期内使用麦角胺咖啡因片与尼莫地平临床效果较好,但长期应用容易产生耐药性,且不良反应较多[10]。故目前临床急需一种有效替代该药的治疗方法[11]。天麻素主要由天麻提取,具有多种药理效果,其中以扩张脑血管从而提高脑血流量效果最为明显[12],另外还具有一定的镇静、催眠作用,已被广泛应用于治疗头痛相关性疾病[13-15]。
本研究结果显示,观察组SOD及GSH-px水平高于对照组,MDA水平低于对照组(P<0.05)。表明联合应用天麻素注射液能有效降低机体氧化应激反应。观察组患者TNF-α、IL-1及hs-CRP水平低于对照组,IgM、IgG和IgA水平高于对照组,提示天麻素注射液可有效减轻丛集性头痛患者机体炎症反应,提高患者机体免疫能力。究其原因可能为天麻素注射液能促进体内SOD释放,降低MDA水平,进而有效抑制机体脂质过氧化反应[16],减少体内氧或羟自由基水平,减轻氧化应激对神经细胞的损伤[17],改善患者头痛症状[18],提高体内炎症组织中血管通透性[19],减轻机体炎症反应性渗出改变,促进水肿消退以及炎症性细胞的代谢,故机体炎症反应因子显著降低[20]。联用天麻素注射液能减轻机体因头痛导致的应激反应而抑制机体免疫功能,减轻因交感神经系统兴奋导致的体液免疫功能受损情况[21],减轻机体炎症反应后更好地确保并提高患者体液免疫功能[22]。
综上所述,针对丛集性头痛患者,联用天麻素注射液能有效减轻机体氧化应激与炎症反应,提高机体体液免疫功能。
