炎宁糖浆抗炎活性及其作用机制研究
2018-12-18杨燕妮孙晓波匡海学曹景文王艳红刘恩临舒尊鹏
杨燕妮,王 毅,孙晓波,匡海学,姜 海,曹景文,王艳红,刘恩临,舒尊鹏,
(1. 广东药科大学中药学院,广东 广州 510006;2. 中国医学科学院北京协和医学院药用植物研究所,北京 100193;3. 黑龙江中医药大学教育部北药基础与应用研究重点实验室,黑龙江 哈尔滨 150040;4. 哈尔滨市康隆药业有限责任公司,黑龙江 哈尔滨 150025)
炎宁糖浆(国药准字Z20090915)为哈尔滨市康隆药业有限责任公司生产的一味中成药,收载于2015版《中国药典》,由玄参科鹿茸草属多年生草本植物鹿茸草MonochasmasheareriMaxim.ex Franch.、鸭跖草科鸭跖草属多年生草本植物鸭跖草Commelinacommunis、茜草科耳草属多年生草本植物白花蛇舌草HedyotisdiffusaWilld.三味中药组成,具有清热解毒、消炎止痢的功效,临床上用于上呼吸道感染、扁桃体炎、尿路感染、急性菌痢、肠炎等多种炎症型疾病[1-2]。
现代研究表明,鹿茸草具有抗炎、止咳作用[3],其主要化学成分为苯乙醇苷类、黄酮类等[4];鸭跖草具有抗炎[5]、镇痛、止咳、抗氧化、抗流感病毒、保肝等药理作用,含黄酮类、生物碱类、香豆素类、萜类、甾体等成分[2,6];白花蛇舌草具有抗癌、抗氧化、抗炎等药理作用,其主要化学成分为萜类、黄酮类、蒽醌类、多糖类等[7]。基于炎宁糖浆的抗炎系统药效研究未见报道,本实验分别在体内及体外炎症模型中,探讨炎宁糖浆及其单味药的抗炎作用及相关机制,旨在为炎宁糖浆的临床应用提供一定的科学依据。
1 实验材料
1.1实验动物SPF级,ICR小鼠体质量(20±2)g,SD大鼠体质量(180±10)g,♀♂各半,由广东药科大学实验动物中心提供,合格证号分别为SCXK(粤)20170029和SCXK(粤)20170119。所有小鼠和大鼠均分笼,并饲养于广东药科大学实验动物中心,适应性喂养1周后开始实验。饲养条件:温度(25±1)℃,相对湿度(45±5)%,光暗各12 h,自由进食饮水。
1.2药物与试剂
1.2.1药物 炎宁糖浆组成所需的3种药材由哈尔滨市康隆药业有限责任公司提供,并由广东药科大学中药学院中药资源系李书渊教授鉴定为:玄参科鹿茸草属多年生草本植物鹿茸草(MonochasmasheareriMaxim. ex Franch.),茜草科耳草属多年生草本植物白花蛇舌草(HedyotisdiffusaWilld.),鸭跖草科鸭跖草属多年生草本植物鸭跖草(Commelinacommunis)。样本留存在广东药科大学中药学院(样品号分别为20170712A、20170712B和20170712C)。阿司匹林购自济南永宁制药股份有限公司,产品批号为170904。
1.2.2细胞株与试剂 人单核巨噬细胞株THP-1细胞,购自上海中国科学院细胞所;10%胎牛血清的RPMI 1640培养液购自Gibco公司;IκBα (6A920)、NF-κB p65 (C-20)、TBP (H-102)抗体,购自Santa Cruz公司;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS) (V1131)、环氧合酶-2(cyclooxygenase-2,COX-2)(L20)抗体,购自Bioworld公司;β-actin抗体购自博士德公司;内毒素(lipopolysaccharide,LPS)购自美国Sigma公司;四甲基偶氮唑盐(MTT)溶液购自美国Fluka公司;IL-6、IL-1β、TNF-α 酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒,均购自南京凯基公司;一氧化氮(nitric oxide,NO)、前列腺素E2(prostaglandin E2,PGE2)检测试剂盒,购自碧云天生物技术研究所;BCA蛋白测定试剂盒购自美国Thermo公司。
1.3实验仪器XS-402型生物显微镜(江南光电集团股份有限公司);FC全波长酶标仪、Heracell VIOS二氧化碳培养箱(美国Thermo 公司);DYCP-31-34琼脂糖水平电泳槽(北京六一仪器厂);半干式转膜槽(美国 Bio-Rad 公司);Odyssey 近红外荧光扫描成像系统(美国 LI-COR 公司)。
2 实验方法
2.1药品制备按2015版《中国药典》进行药品提取浓缩,即三味中药按照鹿茸草、白花蛇舌草和鸭跖草2 ∶1 ∶1的比例(共200.0 g),加水回流煎煮两次,第1次煎煮1.5 h,第2次煎煮1 h,合并煎液,滤过,滤液浓缩至相对密度为1.10,加乙醇使含醇量达到60%,搅匀,静置12 h,滤过,减压挥干成粉(16.0 g,出膏率8.0%)。另取鹿茸草、白花蛇舌草、鸭跖草药材各200 g,按上述方法制备,分别得到干粉11.8 g(出膏率5.90%)、16.4 g(出膏率8.20%)和17.9 g(8.95%),用于后续实验。
2.2细胞培养在37℃、5% CO2培养条件下,使THP-1细胞悬浮生长于RPMI 1640培养基(培养基中含10%胎牛血清、100 kU·L-1青霉素、0.1 g·L-1链霉素和2 mmol·L-1L-谷氨酰胺)。根据细胞的生长状态,每2~3 d换液1次,采用半量换液或者离心重悬的方法,维持细胞生长浓度在1×108~1×109·L-1。
2.3MTT法检测细胞活力将分散均匀的细胞悬液加入96孔板中,浓度为每孔105个细胞。将接种好的细胞培养板放入培养箱中培养过夜。次日离心吸出培养液,加入6个浓度梯度的总提取物和3种单味药提取物(分别为0.2、1、5、25、125、625 mg·L-1),每孔100 μL,每个浓度设6个复孔。设置调零孔(0.1% DMSO的PBS液)、对照孔(MTT)和加药孔。继续培养24 h。次日培养板高速离心,取出上清液后,每孔加入10 μL MTT溶液(5 g·L-1),继续培养4 h。终止培养,以MTT试剂盒中的溶解液溶解结晶。培养箱中放置过夜,镜下观察,待结晶全部溶解后,于570 nm测吸光度。调零孔的吸光度值设置为100%。
2.4ELISA测定细胞因子取对数生长期的THP-1细胞,用培养基稀释成约1×109·L-1浓度,接种于6孔板中,每孔2 mL,置37℃、5% CO2培养箱培养4 h,空白对照组和模型给药组加入总提取物、鹿茸草和鸭跖草(25 mg·L-1)孵育12 h,随后,模型组和模型给药组分别加入LPS(1 mg·L-1),每个浓度设置6个复孔,连续孵育24 h。收集培养24 h后的THP-1细胞培养上清,按照TNF-α、IL-1β和IL-6 ELISA试剂盒的说明书操作,在450 nm波长(630 nm作为参考波长)检测吸光度(OD)值,检测总提取物、鹿茸草和鸭跖草对LPS诱导分化的THP-1细胞因子分泌的影响。
2.5Westernblot检测细胞处理同“2.4”,应用含蛋白酶抑制剂PMSF及磷酸酶抑制剂的细胞裂解液RIPA提取LPS及总提取物(25 mg·L-1)培养6 h后,THP-1细胞的总蛋白,100℃煮沸5 min,使蛋白充分变性。BCA试剂盒进行蛋白定量后,进行聚丙烯酰胺凝胶电泳。应用湿转法将蛋白转印PVDF膜上,含5%脱脂奶粉的TBST室温封闭2 h;TBST洗膜后,用TBST稀释的一抗(1 ∶200)4℃孵育过夜;TBST再次洗膜后,TBST稀释的HRP标记的二抗(1 ∶5 000)室温孵育1.5 h;最后应用ECL发光试剂盒进行化学发光检测,并根据目的条带亮度调整压片及曝光时间。
2.6小鼠耳肿胀实验取健康ICR小鼠,♀♂各半,按体质量随机分为5组,每组10只小鼠,即模型组、炎宁高剂量组(300.0 mg·kg-1,相当于炎宁生药6.0 g·kg-1)、炎宁中剂量组(150.0 mg·kg-1,相当于炎宁生药3.0 g·kg-1)、炎宁低剂量组(75.0 mg·kg-1,相当于炎宁生药1.5 g·kg-1)和阳性对照组(阿司匹林200.0 mg·kg-1)。各组均灌胃给药连续7 d,空白组给予同体积生理盐水,实验前小鼠禁食不禁水18 h,最后一次给药后30 min,在小鼠的右耳正反两面均匀涂二甲苯0.1 mL,2 h后脱颈椎处死,沿耳廓基线剪下两耳,用6 mm打孔器在左、右耳相同部位打孔称重,记录肿胀度,右耳重量减去左耳重量即为肿胀度。
耳肿胀抑制率/%=
2.7大鼠足肿胀测定取健康SD大鼠,♀♂各半,按体质量随机分为5组,每组10只大鼠,即模型组、炎宁高剂量组(180.0 mg·kg-1,相当于炎宁生药2.25 g·kg-1)、炎宁中剂量组(90.0 mg·kg-1,相当于炎宁生药1.125 g·kg-1)、炎宁低剂量组(45.0 mg·kg-1,相当于炎宁生药0.5625 g·kg-1)和阳性对照组(氢化可的松注射液0.25 mg·kg-1)。各组均灌胃给药,空白组给同体积生理盐水,连续7 d,致炎剂为10%的新鲜蛋清。d 7实验前大鼠禁食不禁水18 h,将大鼠右后肢固定,在其踝关节处用记号笔作一标记,没过标记为界,测右后肢正常足体积,连续测量3次,取平均值,然后灌胃给药(阳性组腹腔注射),给药1 h后,右后肢足趾中部皮下注射10%新鲜蛋清0.1 mL,分别在注入致炎剂后1、2、3、4 h测足体积。

3 结果
3.1不同浓度总提取物及3个单味药对免疫细胞活力的影响如Fig 1所示,分别将总提取物及3个单味药与免疫细胞THP-1预孵育24 h后,鹿茸草和鸭跖草分别在最大浓度(625 mg·L-1)下对正常免疫细胞的增殖均无明显的抑制作用(P>0.05),而总提取物在125 mg·L-1及白花蛇舌草在5 mg·L-1以上的浓度,表现出抑制细胞增殖现象,即细胞毒活性。

Fig 1 Cytotoxicity test in THP-1 n=6 )
*P<0.05,**P<0.01vscontrol group
3.2对LPS诱导的免疫细胞中NO、PGE2释放及iNOS、COX-2表达的抑制作用如Fig 2所示,在THP-1细胞中,总提取物、鹿茸草和鸭跖草单独孵育THP-1细胞时,PGE2均未有变化;但在NO含量的检测中,发现鹿茸草显示出抑制NO生成的作用。LPS刺激后,总提取物、鹿茸草和鸭跖草均可降低NO和PGE2的释放。Fig 3结果显示,LPS诱导THP-1细胞后,iNOS和COX-2的蛋白表达明显升高,而给药组蛋白表达则明显降低。这些结果说明,总提取物、鹿茸草和鸭跖草均可减少LPS诱导的NO和PGE2的分泌,其作用机制主要是通过减低iNOS和COX-2的蛋白表达来实现的。
3.3对LPS诱导的免疫细胞细胞因子分泌的抑制作用如Fig 4所示,在THP-1细胞中,空白对照组细胞因子水平处于较低的水平,单独给予总提取物(25 mg·L-1)时,THP-1细胞并未见细胞因子分泌量的明显改变,但单独给予鹿茸草和鸭跖草时,细胞因子TNF-α、IL-1β出现抑制现象,与之前的NO生成结果几乎一致。进一步研究证实鹿茸草和鸭跖草是否具有免疫抑制活性。经LPS孵育,THP-1细胞上清液中TNF-α、IL-1β和IL-6含量明显增加,与空白对照组相比有明显差异(P<0.01),而加入总提取物、鹿茸草和鸭跖草孵育后,细胞上清液中TNF-α、IL-1β和IL-6含量均明显降低(P<0.01)。
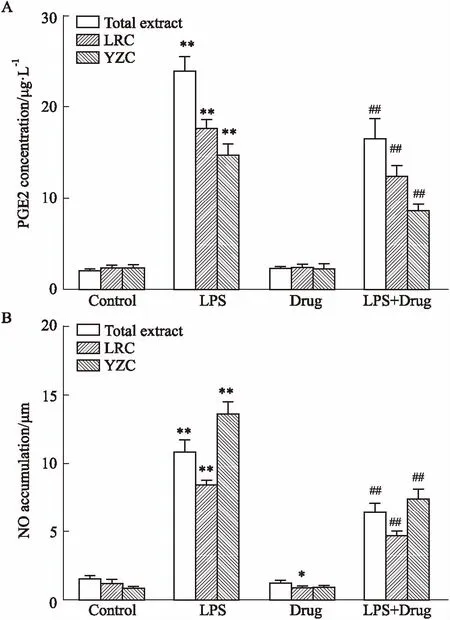
Fig 2 Inhibitory effects on PGE2(A) and NO(B) releases in LPS-stimulated THP-1 n=6 )
*P<0.05,**P<0.01vscontrol group;##P<0.01vsLPS group

Fig 3 Total cellular protein isolated and LPS-induced iNOS and COX-2 expression levels measured using Western blot analysis n=3)
**P<0.01vscontrol group;#P<0.05vsLPS group

Fig 4 Inhibitory effects on TNF-α(A), IL-1β (B) and IL-6(C) releases in LPS-stimulated THP-1 cells n=6 )
*P<0.05,**P<0.01vscontrol group;##P<0.01vsLPS group
3.4总提取物对LPS诱导的免疫细胞中NF-κB通路的影响如Fig 5所示,各组间IκBα总蛋白表达差异无显著性。LPS刺激后,THP-1细胞中p-IκBα蛋白表达较对照组明显升高;总提取物处理后,p-IκBα蛋白表达与LPS组比较明显降低。此结果说明,总提取物对LPS诱导的THP-1细胞中IκBα磷酸化蛋白的升高具有抑制作用。LPS诱导后,细胞核内NF-κB的表达出现差异。当总提取物处理时,其可明显降低LPS诱导的NF-κB的核转位。此结果说明,总提取物可能通过抑制NF-κB的核转位,进而抑制细胞因子的表达。

Fig 5 Inhibitory effects of total extract on NF-κB signaling in LPS-stimulated THP-1 n=3)
**P<0.01vscontrol group;##P<0.01vsLPS group
3.5对二甲苯致小鼠耳肿胀的影响Tab 1结果表明,与模型组比较,阿司匹林组和炎宁高剂量组对二甲苯引起小鼠耳肿胀有很强的抑制作用(P<0.01),炎宁中、低剂量组也可抑制小鼠耳肿胀(P<0.05),提示炎宁高、中、低剂量组均能减轻炎症早期导致的毛细血管扩张、渗出和水肿等作用。
3.6对蛋清引起的大鼠足肿胀的影响Tab 2结果表明,给予致炎剂前,各组之间的正常足体积差异无显著性(P>0.05)。给予致炎剂后,各给药组在不同时间段分别同模型组相比,氢化可的松组在2 h以内均有显著性差异(P<0.05,P<0.01),但随着时间的延长,消肿作用有所下降。同样,炎宁高、中剂量组在致炎后2 h之内也表现出差异有显著性(P<0.05),炎宁低剂量组在致炎后差异无显著性(P>0.05)。

Tab 1 Effects of Yanning syrup on ear swelling of mice induced by xylene n=10)
*P<0.05,**P<0.01vsmodel
4 讨论
炎宁糖浆因其组方独特、疗效确切、副作用小而被列为国家中药保护品种[2],3种单味药鹿茸草、鸭跖草和白花蛇舌草从古至今各家医书也均有记载,如《湖南药物志》记载:“鹿茸草四钱,水煎兑冰糖服治咳嗽”,《袖珍方》曰:“鸭跖草汁点之可治喉痹肿痛”,白花蛇舌草始载于《广西中药志》:“治小儿疳积,毒蛇咬伤,癌肿,外治白泡疮,蛇癞疮”。在本文中,通过观察二甲苯致小鼠耳肿胀和鸡蛋清致大鼠足肿胀两个经典实验,发现炎宁糖浆总提取物对急性或炎症早期的毛细血管扩张、通透性亢进、渗出和水肿具有明显的抑制作用。此外,体外实验中发现鹿茸草和鸭跖草对正常免疫细胞的增殖均无明显的抑制作用,说明鹿茸草和鸭跖草发挥抗炎作用并非源于免疫细胞的减少,而是出于对免疫通路的调控。本实验中,白花蛇舌草在5 mg·L-1以上表现出细胞毒现象,与文献记载白花蛇舌草(12.5 mg·L-1)作用48 h[8],出现明显的抑制肿瘤细胞的作用所得的结果相一致,推测白花蛇舌草可导致相应细胞的凋亡[9],抑制细胞增殖。因其具有细胞毒活性,未继续进行体外抗炎作用研究。总提取物在大浓度下也出现细胞毒现象,其原因可能为随着白花蛇舌草浓度的加大,从而出现细胞毒现象。
在正常的生理环境下,由免疫细胞所释放的与炎症相关的炎性介质,如NO、PGE2等,主要用于组织的保护与修复,而他们的过度表达则会造成免疫损伤,加重病情。当机体受到损伤或病原体入侵时,免疫系统激活并招募大量炎症细胞浸润,分泌多种细胞因子和炎症介质,导致炎症的产生[10]。炎症是机体对于伤害性刺激、组织损伤以及感染等多种诱导因素所做出的级联应激反馈。如LPS刺激后,免疫细胞能够分泌TNF-α、IL-1β、IL-6等多种细胞因子[11-12],这些细胞因子可造成机体炎症的过度表达。因此,NO和PGE2在免疫系统里作为典型的炎性介质,常用于检测免疫细胞是否被激活,而iNOS和COX-2的蛋白表达可对细胞中NO和PGE2的合成起到关键作用。本实验检测了总提取物、鹿茸草和鸭跖草对LPS诱导的免疫细胞活化后,细胞上清液中TNF-α、IL-1β和IL-6水平的变化,同时选定NO和PGE2作为考察指标,并通过Western blot技术检测iNOS和COX-2的蛋白表达进行进一步验证。实验结果表明,LPS诱导免疫细胞后,细胞上清液中NO、PGE2、TNF-α、IL-1β和IL-6的含量明显升高;通过总提取物、鹿茸草和鸭跖草处理则可降低其在上清液中的表达。总提取物、鹿茸草和鸭跖草可明显降低LPS诱导的iNOS和COX-2蛋白水平,而起到抑制NO和PGE2分泌作用。

Tab 2 Effects of Yanning syrup on swelling of mice hind paw induced by fresh egg white n=10)
*P<0.05,**P<0.01vsmodel
NF-κB广泛存在于真核细胞中,是一种具有多向转录调节作用的转录因子。已有的大量报道表明,NF-κB通路在LPS诱导免疫细胞活化过程中起着重要作用[12]。在哺乳动物细胞中,NF-κB蛋白家族主要包括NF-κB 1(p50)、NF-κB 2(p52)、RelA (p65)、RelB和c-Rel 5个成员[13]。在正常静息状态下,细胞内NF-κB通常以无活性的三聚体或有活性的二聚体存在。当细胞受到LPS、细胞因子、病毒等刺激时,IκBα发生磷酸化[14],随之又发生泛素化,其构象发生改变后,从而释放出NF-κB二聚体,使其得以转位入细胞核中,特异性地与DNA上相应靶基因调控元件的序列相结合,单独作用或与其他转录因子共同影响,上调这些靶基因的表达,从而发挥相应的生理及病理作用。本文实验结果发现,LPS刺激后,p-IκBα的蛋白水平明显升高,总提取物则可逆转此现象。此外,对于核内的NF-κB的检测也可看出,总提取物有抑制LPS激发的NF-κB核转录的作用。
综上所述,炎宁糖浆具有较好的抗炎作用,而其主要抗炎单味中药为鹿茸草和鸭跖草,在之后实验会进一步比较3种单味药的药效作用,分离及筛选三味药中的活性成分,同时白花蛇舌草是否具有抗炎作用,需要进一步体内实验验证。目前对于炎宁糖浆中主要活性单味药鹿茸草的药效物质基础及药理机制报导还相对较少,进一步对其深入研究,可对炎宁糖浆的临床应用和市场推广产生重要意义及实际价值。
