靛玉红缓解三硝基苯磺酸致大鼠溃疡性结肠炎及其机制研究
2018-12-18柳越冬王长洪崔世超张晓明
李 楠,柳越冬,王长洪,崔世超,张晓明
(1. 辽宁中医药大学研究生院,辽宁 沈阳 110032;2. 辽宁中医药大学第四临床学院,辽宁 沈阳 110101;3. 沈阳军区总医院中医科,辽宁 沈阳 110016)
溃疡性结肠炎(ulcerative colitis, UC)是一种特发于结肠和直肠黏膜或黏膜下层的一种边界清楚的炎性反应性疾病,其与克罗恩病(crohn disease, CD)共属炎性肠病(inflammatory bowel disease, IBD),其临床表现为腹痛、腹泻、里急后重、黏液脓血便等,发病机制尚未明了[1]。目前,临床中治疗UC主要以水杨酸制剂和糖皮质激素为主,代表药物有美沙拉嗪和柳氮磺吡啶等,但是毒副作用较大,无法长期用于治疗[2],中医药治疗本病有着一定优势。在课题组前期研究证实,含有中药青黛所组成的优化溃结方对治疗UC模型大鼠具有一定的疗效[3]。靛玉红为中药青黛的主要有效成分,已被证实对肿瘤细胞及耐药肿瘤细胞有杀伤作用[4]。本实验拟观察靛玉红对UC模型大鼠的治疗效果,通过其对UC模型大鼠疾病活动指数(disease activity index, DAI)评分、结肠组织病理学切片、转化生长因子β1(transforming growth factor β1,TGF-β1)水平,以及大鼠结肠组织中肠三叶因子(intestinal trefoil factor, ITF)mRNA表达的影响,验证靛玉红对UC模型大鼠的疗效,并对其作用机制进行初步探讨。
1 材料
1.1实验动物清洁级SD大鼠48只,♂,体质量(200±20)g,购自辽宁省实验动物资源中心,合格证号:SCXK(辽)2015-0001。
1.2药物与试剂靛玉红,每瓶20 mg,纯度≥98.0%,北京索莱宝科技有限公司,批号:NO.1221A022;柳氮磺吡啶肠溶片(sulfasalazine tablets, SASP),每片0.25 g,上海福达制药有限公司,批号:H31020840;大鼠TGF-β1 ELISA试剂盒,上海朗顿生物技术有限公司,批号:20170302JG;Easy Pure®RNA Kit(批号:#L10322)、Trans Script®One-Step gDNA Removal and cDNA Synthesis SuperMix(批号:#L10303),均购自北京全式金生物技术有限公司;PCR引物由英潍捷基贸易有限公司合成。
1.3仪器冷冻离心机(美国科峻仪器公司);DYY-6C电泳仪(北京六一仪器厂);二氧化碳培养箱(北京东联哈尔仪器制造有限公司);UV-1750紫外分光光度计(日本岛津公司);TP600 PCR仪(日本TaKaRa公司);凝胶成像系统(杭州朗基科学仪器有限公司);SUNRISE酶标仪(瑞士TECAN公司)。
2 方法
2.1实验分组将48只清洁级SD大鼠,采用随机数字表法,按体质量随机分为4组,分别为正常组、模型组、SASP组、靛玉红组,每组12只。
2.2UC模型的制备大鼠适应性喂养7 d,正常进食、进水,保持饲养环境适宜。禁食、不禁水24 h。除正常组大鼠外,其余大鼠均采用5%三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)的造模方法:异戊巴比妥麻醉大鼠后,将钝头导管从肛门插至距肛门8 cm处,按80 mg·kg-1TNBS(20 mg TNBS溶解于50%乙醇1 mL,4 mg·kg-1大鼠体质量)缓慢灌肠。15 d后,再次给予30 mg·kg-1TNBS溶液(20 mg TNBS溶解于500 mL·L-1乙醇1 mL,1.5 mL·kg-1)灌肠,制备大鼠UC模型[5-6]。
2.3给药药物干预于造模后d 5开始,各组小鼠灌胃给药7 d。参考《中药药理研究方法学》[7],根据人与大鼠的药物剂量折算系数,算出各组小鼠的给药剂量,灌胃时根据小鼠体质量给药(40 mL·kg-1)。正常组及模型组:按40 mL·kg-1给予0.5%羧甲基纤维素钠(sodium carboxymethylcellulose, CMC)灌胃;靛玉红组:给予靛玉红,剂量为9.64 mg·kg-1,溶于5% CMC溶液中;SASP组:剂量为每日292.86 mg·kg-1,片剂碾碎溶于5% CMC溶液中[8]。给药期间各组小鼠自由进食、饮水。
2.4标本采集与DAI评分自实验d 1开始,每日同一时间称取各组大鼠体质量,记录其大便性状,及大便隐血/肉眼血便状况。大便隐血检测运用便隐血检测试纸(联苯胺法):挑取少许粪便于滤纸上,加1%联苯胺冰醋酸溶液1~2滴,加3% H2O21~2滴。加试剂后2 min试纸反应区不显色为隐血试验阴性(-);加试剂10 s后,反应区显浅蓝色,渐变蓝色为隐血试验阳性(+);加入试剂后反应区初显浅蓝褐色,渐加深变明显褐色为隐血试验阳性();加入试剂后反应区立即显蓝褐色为隐血试验阳性()。根据文献方法,对各组大鼠进行DAI评分[9]。
自给药起d 7,各组大鼠用异戊巴比妥麻醉,开腹,在肛门1 cm以上取4~6 cm病变肠管组织,纵行剪开后,用4℃ 0.9%氯化钠溶液冲洗,留取部分结肠组织。以滤纸吸干水分后,用4%多聚甲醛固定,以供制作病理切片,观察各组大鼠肠黏膜的组织形态学变化。
2.5ELISA法检测结肠组织TGF-β1水平取各组结肠组织100 mg,匀浆后取上清液,按照TGF-β1试剂盒说明书进行操作检测。
2.6RT-PCR法检测ITFmRNA表达取50 mg结肠组织剪碎,按照RNA提取试剂盒操作提取组织总RNA。立即进行cDNA第一链合成,反应条件为25℃ 10 min,42℃ 30 min,85℃ 5 min,42℃ 1 min退火。产物cDNA于4℃保存,以待合成DNA。合成DNA反应体系为:2×PCR Super Mix 12.5 μL,RNase Free H2O 8.5 μL,上游引物1 μL,下游引物1 μL(各引物序列见Tab 2),反转录产物cDNA 2 μL。反应条件为:94℃ 30 s;58℃ 30 s,72℃退火30 s后,重复40个循环后,行电泳分析。以β-actin为内参照,引物序列如下:β-actin上游引物5′-CCTGTGG-CATCCATGAAACTAC-3′,下游引物5′-CCAGGGC-AGTAATCTCCTTCTG-3′;ITF上游引物5′-TGGGTCCTCCTGCAAAGC-3′,下游引物5′-CATTTGGGATGCTGGAGTCA-3′。
2.7统计学方法统计学方法采用Graph Pad 7软件,组间比较用单因素方差分析。
3 结果
3.1靛玉红对UC大鼠DAI评分的影响TNBS渗入大鼠肠腔后可引起结肠组织发生溃疡、坏死,大鼠出现食欲减退、精神萎靡、毛发枯松无光泽、体质量下降,并伴有腹泻、血便等症状。如Fig 1所示,与模型组比较,靛玉红组及SASP组DAI评分明显下降,差异具有统计学意义(P<0.01)。
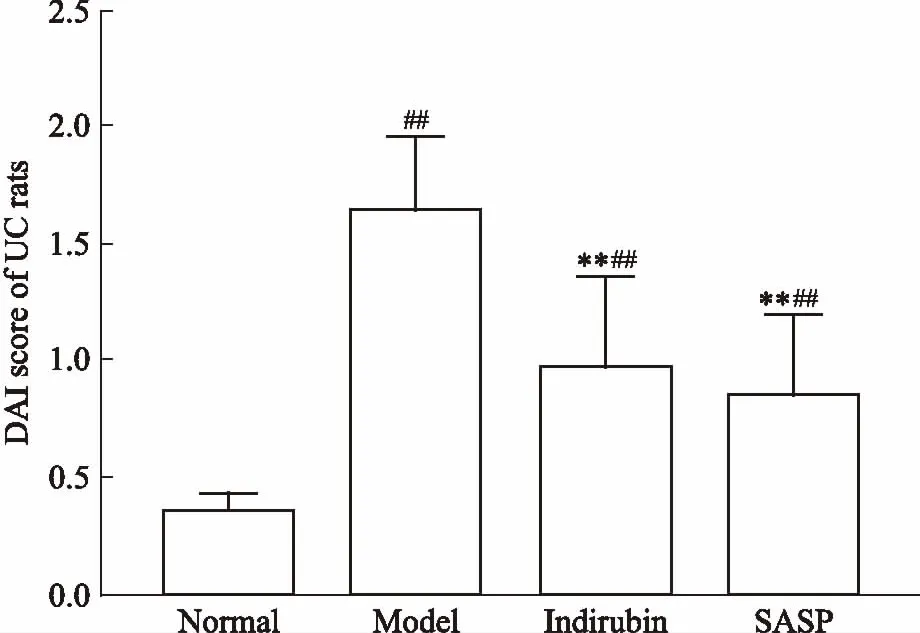
Fig 1 Effect of indirubin on DAI score of UC
##P<0.01vsnormal;**P<0.01vsmodel
3.2靛玉红对UC大鼠结肠组织病理学HE染色的影响对大鼠结肠组织进行HE染色,如Fig 2所示,正常组大鼠结肠黏膜上皮完整,结构清晰,腺体排列规则,固有层内杯状细胞丰富,未见炎症细胞浸润;模型组大鼠结肠隐窝细胞丢失,炎症细胞浸润深入黏膜肌层;经靛玉红及阳性药物SASP干预后,UC模型大鼠结肠中性粒细胞及淋巴细胞浸润较模型组少,可见少量腺管扭曲。
3.3靛玉红对UC模型大鼠TGF-β1水平的影响对各组大鼠结肠组织TGF-β1水平进行测定,如Fig 3所示,与模型组比较,靛玉红组及SASP组TGF-β1水平均明显下降,差异具有统计学意义(P<0.01)。
3.4靛玉红对UC模型大鼠ITFmRNA水平的影响如Fig 4所示,与模型组比较,ITF mRNA的相对表达量在靛玉红组及SASP组中均有明显升高(P<0.01)。
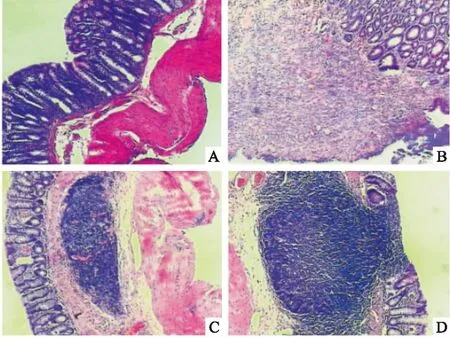
Fig 2 Representative HE-stained colon sections(×100)
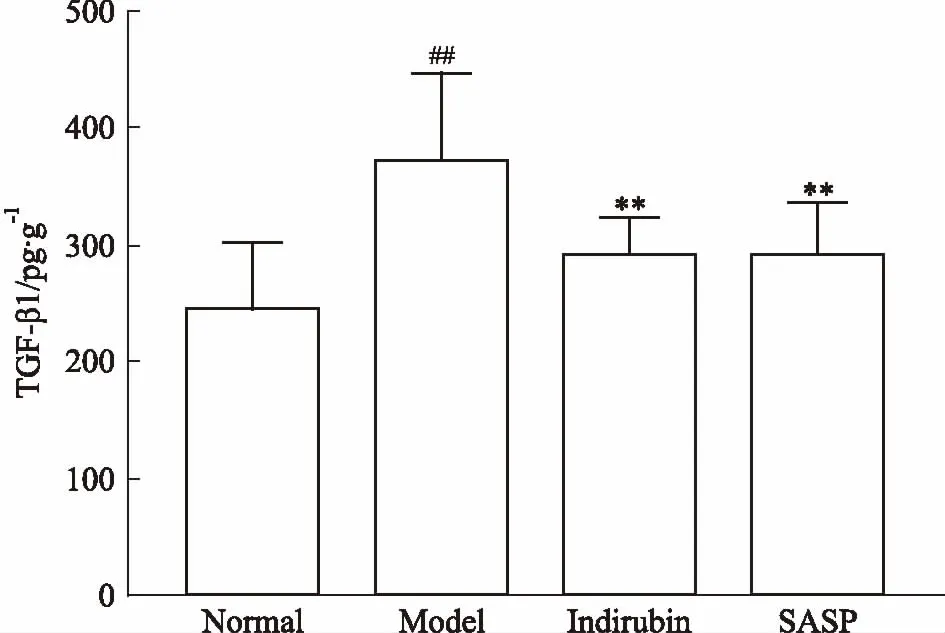
Fig 3 Changes of colonic tissue levels
##P<0.01vsnormal;**P<0.01vsmodel
4 讨论
UC属于中医学“泄泻”、“休息痢”、“肠澼”等范畴,其发病机制尚不十分明确,有报道称可能是由于促炎性因子增多和抗炎性因子减少所导致[10]。而目前对于本病的研究热点也集中在抑制炎症因子释放,从而达到减轻炎症的目的[11]。
UC发生时,常伴炎性因子水平的升高,研究显示,直肠黏膜TGF-β1水平与UC患者疾病活动性呈正相关[12]。TGF-βl是一种通过免疫和非免疫细胞产生的细胞因子,具有广泛的作用,其控制着免疫细胞的分化、增殖、激活、创伤修复、血管生成,而且与免疫异常有关,如肿瘤、自身免疫性疾病、IBD等[13]。因此,TGF-β1 常作为评价UC炎症程度的重要指标。ITF是三叶因子家族(trefoil factor family,TFF)成员之一,具有黏膜保护、修复、抑制炎症介质反应、调节细胞免疫和细胞凋亡等功能。它由肠黏膜上皮杯状细胞分泌,广泛存在于胃肠道,具有特征性的三叶结构,被认为是内源性具有抗凋亡特性的肽类物质[14-15],在肠道的自我保护和损伤后修复中占有重要地位。
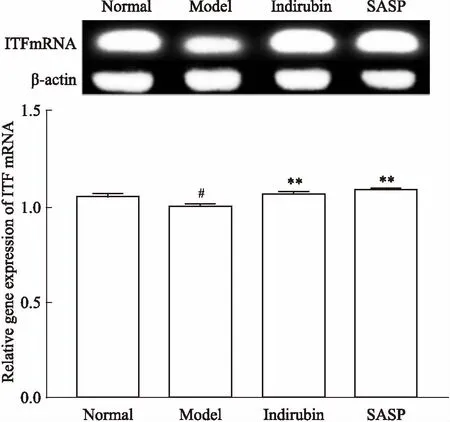
Fig 4 Changes of colonic tissue expressionof ITF mRNA in
#P<0.05vsnormal;**P<0.01vsmodel
本研究显示,靛玉红有明显的抑制炎症的作用,能够有效降低DAI评分,明显改善UC大鼠症状,减轻UC大鼠模型受损肠组织的炎性反应。在对结肠的HE染色病理观察中,靛玉红可明显减少炎症细胞,表明靛玉红对UC有治疗作用。与模型组比较,靛玉红可以降低TGF-β1水平,提高ITF mRNA表达,说明靛玉红可以降低UC大鼠炎症水平,其抑制UC大鼠炎症的可能原因是抗细胞凋亡,而其抗细胞凋亡的具体途径有待进一步研究。
(致谢:本实验主要在辽宁省现代中药研究工程实验室完成,感谢辽宁中医药大学孟宪生教授的悉心教诲。)
