替米沙坦通过降低Chemerin表达减轻2型糖尿病小鼠肾脏炎症反应
2018-12-18施子禄郑丹丹黄秋虹张素萍
施子禄, 郑丹丹, 黄秋虹, 张素萍, 黄 倩
(1. 福建医科大学附属泉州第一医院肾内科,福建 泉州 362000;2. 泉州医学高等专科学校基础医学部生理学教研室,福建 泉州 362100;3. 浙江大学基础医学院生理系,浙江 杭州 310058)
糖尿病肾病(diabetic nephropathy,DN)作为糖尿病患者最常见的微血管并发症之一,由于其后期并发的肾衰竭最终增加患者死亡率而备受关注。研究发现,DN形成过程复杂,涉及多种病理机制,如肾素-血管紧张素系统(renin-angiotensin system,RAS)过度激活、氧化应激损伤、慢性炎症、凋亡、肾脏纤维化等[1-3],其中慢性炎症是重要环节之一。DN患者体内炎症信号被激活,直接或间接引起肾脏组织损伤,加速DN的进展。
糖尿病状态下,循环RAS被抑制,肾脏RAS被激活,而肾脏RAS的激活是导致终末期肾衰竭的核心因素[4]。血管紧张素II(angiotensin II,Ang II)是RAS系统的重要成员,其在糖尿病诱导的脏器损伤中发挥重要作用。替米沙坦(telmisartan)为新型的Ang II受体1(AT1)拮抗剂,通过阻断Ang II与AT1受体的结合而广泛应用于心脑血管疾病的治疗[5]。Chemerin是2007年发现的一种由脂肪细胞分泌的细胞因子,具有促进炎症细胞聚集,参与慢性炎症反应,调节脂肪细胞分化,参与糖代谢,增强脂肪组织胰岛素敏感性等多种功能[6]。研究发现,同为沙坦类药物的厄贝沙坦,可能通过抑制RAS系统的活化、减少肾脏局部Ang II的生成,从而对糖尿病大鼠肾脏起确切的保护作用[6]。现已知,替米沙坦成功减轻了db/db小鼠心肌组织炎症反应[7],但能否减轻2型糖尿病(type 2 diabetes mellitus,T2DM)小鼠肾脏炎症损伤发挥肾脏保护作用,目前国内外尚无相关报道。本研究通过构建T2DM小鼠模型,探讨替米沙坦对T2DM小鼠肾脏炎症反应的影响,并从Chemerin角度探讨其肾脏保护机制。
1 材料与方法
1.1实验动物健康成年♂C57BL/6小鼠,8周龄,清洁级,购自上海斯莱克实验动物有限公司,实验动物许可证号:SCXK沪2007-0005。标准条件饲养,自由进食、饮水,适宜温度、湿度,黑暗和光照各12 h。
1.2试剂链脲佐菌素(streptozotocin,STZ)(美国Sigma公司,批号:S0130);替米沙坦(美国Sigma公司,批号:T8949);普通饲料与高脂饮食购自北京华埠康公司;小鼠Ang II酶联免疫(enzyme linked immunosorbent assay,ELISA)试剂盒(上海基免实业有限公司,批号:BIO-JM-1314);小鼠白细胞介素1β(interleukin-1β,IL-1β)、小鼠白细胞介素6(interleukin-6,IL-6)、小鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA试剂盒,均购自北京安迪华泰科技有限公司,批号分别为M0627、M0111、M0314;Chemerin蛋白抗体(批号:ab203040)、β-actin抗体(批号:ab8227)均购自Abcam公司;HRP标记的山羊抗兔IgG抗体(上海碧云天生物技术有限公司,批号:A0208)。
1.3仪器石蜡切片机(德国Leica公司);XR210全自动生化分析仪(广东中山新锐医疗设备科技有限公司);5810R高速冷冻式离心机(德国Eppendorf公司);UVmini-1240紫外可见分光光度计(日本岛津国际贸易上海有限公司);垂直电泳仪(美国Bio-Rad公司);Tanon 3500全自动数码凝胶成像分析系统(上海天能科技有限公司)。
1.4方法
1.4.1糖尿病小鼠模型的建立及分组 40只小鼠适应性喂养1周后,随机分成2组:正常对照组10只和T2DM模型组30只。正常对照组小鼠接受普通饲料(66.5%碳水化合物、4.5%脂肪、18.9%蛋白质)饲养4周,模型组小鼠接受高脂饮食(40.9%碳水化合物、24.2%脂肪、23.8%蛋白质)饲养4周。4周后,小鼠禁食不禁水12 h,单次腹腔注射STZ(40 mg·kg-1,溶于新鲜配制的0.1 mmol·L-1的无菌柠檬酸-柠檬酸钠缓冲液中,pH 4.5),继续高脂饮食饲养,正常对照组小鼠注射等体积柠檬酸-柠檬酸钠缓冲液,继续普通饲料饲养。注射STZ 1周后,断尾取血测空腹血糖(fasting blood-glucose,FBG),2次FBG均≥16.7 mmol·L-1为T2DM造模成功[8],T2DM模型小鼠再随机分为T2DM组、替米沙坦(1、3 mg·kg-1)组[9],每组10只,连续灌胃给药8周,正常对照组和T2DM组小鼠仅使用等体积生理盐水灌胃,8周末无小鼠死亡。
1.4.2FBG、24 h尿微量白蛋白、血清肌酐和尿素氮含量的测定 8周末实验结束时,每只小鼠置于独立代谢笼中,禁食6 h后剪尾取血,采用血糖仪检测FBG;收集24 h尿液,采用全自动生化分析仪测定24 h尿微量白蛋白(microalbuminuria,mAlb)含量;0.8%戊巴比妥钠(70 mg·kg-1)麻醉小鼠,下腔静脉取血,制备血清,采用全自动生化分析仪测定血清肌酐(serum creatinine,Scr)和尿素氮(blood urea nitrogen,BUN)含量。
1.4.3肾脏HE染色 取各组小鼠相同部位肾组织,4%多聚甲醛固定,石蜡包埋,切片(3 μm厚),进行HE染色,光镜下观察肾脏病理变化。
1.4.4ELISA法检测肾皮质IL-1β、IL-6、TNF-α的水平 取各组小鼠部分肾皮质进行匀浆,按照各因子ELISA试剂盒的步骤进行检测。
1.4.5ELISA法检测肾皮质Ang II的浓度 切取部分冰冻肾皮质进行匀浆,按小鼠Ang II ELISA试剂盒说明书,检测肾皮质匀浆Ang II的浓度。
1.4.6肾脏免疫组织化学染色 取各组小鼠部分肾皮质固定,脱水,石蜡包埋,脱蜡,按免疫组化试剂盒说明书进行肾皮质Chemerin(1 ∶500)染色,光镜下观察肾皮质中Chemerin的分布。
1.4.7Western blot检测肾皮质Chemerin蛋白的表达 取各组小鼠冰冻肾皮质,按照相应比例加入预冷的组织蛋白裂解液,玻璃匀浆器匀浆,充分裂解,14 000×g离心5 min,取上清,提取肾皮质总蛋白,采用BCA法测定蛋白浓度,SDS-PAGE电泳,电转移至PVDF膜,分别加入一抗(Chemerin 1 ∶500稀释,β-actin 1 ∶3 000稀释),二抗为HRP标记的羊抗兔抗体(1 ∶2 000稀释),ECL发光、显影,β-actin为内参对照,以与β-actin的比值作为Chemerin蛋白的相对表达水平。

2 结果
2.1替米沙坦对T2DM小鼠生化指标的影响如Tab 1所示,与正常对照组相比,T2DM组小鼠FBG明显升高(P<0.01),替米沙坦组与T2DM组相比差异无统计学意义(P>0.05)。mAlb、Scr和BUN能够反映小鼠的肾功能,与正常对照组相比,T2DM组小鼠在饲养8周后,mAlb、Scr和BUN含量均明显升高(P<0.05或P<0.01),2个剂量替米沙坦干预后均可以明显降低T2DM小鼠mAlb、Scr和BUN含量(P<0.05或P<0.01),且高剂量替米沙坦的作用优于低剂量替米沙坦(P<0.05)。以上结果提示糖尿病使小鼠肾功能异常,替米沙坦能够以血糖非依赖的方式改善T2DM小鼠肾功能。

Tab 1 Effect of telmisartan on biochemical characteristics in T2DM n=10)
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsT2DM group;△P<0.05vs1 mg·kg-1telmisartan group
2.2替米沙坦对T2DM小鼠肾脏结构的影响为了观察替米沙坦对T2DM小鼠肾脏结构的影响,对肾脏切片进行HE染色。如Fig 1所示,光镜下可见正常对照组小鼠肾组织结构完整,肾小管上皮细胞排列整齐。与正常对照组相比,T2DM组小鼠肾脏组织中肾小管上皮细胞大量变性坏死、脱落,肾小管管腔明显扩张,间质充血与炎症细胞浸润,表明T2DM小鼠肾组织炎症损伤明显。替米沙坦干预8周后肾脏病理损伤逐渐改善,主要表现为肾小管上皮细胞肿胀、坏死、脱落程度、炎症细胞浸润程度逐渐减轻,且高剂量替米沙坦组效果更明显。以上结果表明,替米沙坦能够减轻T2DM小鼠肾脏组织病理损伤。

Fig 1 Effect of telmisartan on morphological pathology of renal tissues in T2DM mice(×200)
2.3替米沙坦对T2DM小鼠肾皮质IL-1β、IL-6、TNF-α水平的影响糖尿病使肾脏内炎性细胞迅速活化,大量表达炎性细胞因子如IL-1β、IL-6、TNF-α等,这些炎性细胞因子加重肾组织损伤,加快糖尿病进程,因此,我们采用ELISA法检测各组小鼠肾皮质IL-1β、IL-6、TNF-α的水平。如Fig 2所示,与正常对照组相比,T2DM组小鼠肾皮质IL-1β、IL-6、TNF-α水平明显升高(P<0.05或P<0.01),给予2个剂量替米沙坦干预8周后,肾皮质中IL-1β、IL-6、TNF-α水平明显降低(P<0.05),2个剂量替米沙坦组间比较无差异。以上结果表明,替米沙坦可以减少T2DM小鼠肾脏炎性因子表达,减轻T2DM小鼠肾脏炎症损伤。

Fig 2 Effect of telmisartan on IL-1β, IL-6 and TNF-α levels in renal cortex of T2DM n=10)
2.4替米沙坦对T2DM小鼠肾皮质AngII浓度的影响Ang II是RAS系统最重要的组成部分,因此我们检测了肾皮质中Ang II的浓度。如Fig 3所示,T2DM组小鼠肾皮质中Ang II浓度较对照组升高(P<0.01),2个剂量替米沙坦干预后均可以明显降低Ang II浓度(P<0.01),且2个剂量替米沙坦组间比较无差异。提示替米沙坦能够抑制肾脏局部RAS系统。

Fig 3 Effect of telmisartan on Ang II concentration in renal cortex of T2DM n=10)
2.5替米沙坦对T2DM小鼠肾皮质Chemerin蛋白分布的影响为了观察替米沙坦对T2DM小鼠肾脏炎症反应的作用,我们对肾脏切片进行Chemerin免疫组化染色。如Fig 4所示,对照组肾小管上皮细胞中Chemerin蛋白少量、散在分布,T2DM组小鼠肾小管上皮细胞中阳性分布明显增多,以胞质中最明显,替米沙坦干预后Chemerin蛋白分布逐渐减少。

Fig 4 Telmisartan protein distribution of renal cortex in T2DM mice(×200)
2.6替米沙坦对T2DM小鼠肾皮质Chemerin蛋白表达的影响如Fig 5所示,T2DM小鼠肾皮质Chemerin蛋白表达水平较对照组明显增加(P<0.05),2个剂量替米沙坦干预后,肾皮质Chemerin表达较T2DM组降低(P<0.05),且2个剂量替米沙坦组间比较无差异。提示替米沙坦能够改善T2DM引起的小鼠肾皮质Chemerin蛋白的表达增加。
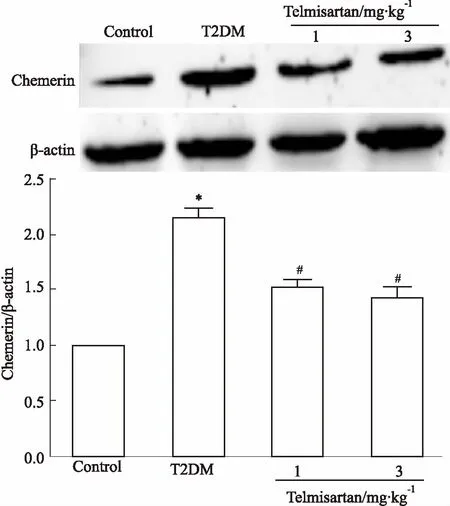
Fig 5 Effect of telmisartan on Chemerin expression in renal cortex of T2DM n=10)
3 讨论
DN是T2DM患者常见的慢性并发症之一,也是终末期肾衰竭的主要病因,其病理机制复杂,涉及多种因素,炎症反应可能在其中起关键作用[3]。研究证实,高糖诱导的肾组织炎症反应对肾脏损害尤为重要,因此,减轻肾组织炎症反应有利于改善糖尿病肾脏功能,减缓糖尿病病程进展[10]。
在糖尿病db/db小鼠模型中,替米沙坦同类药厄贝沙坦的慢性治疗能够抑制心脏RAS系统以及NF-κB的表达,减轻心肌组织炎症反应[11]。替米沙坦短期治疗也可通过抑制眼组织局部的RAS系统,缓解糖尿病诱导的视网膜炎性损伤[12],但对糖尿病引起的肾组织炎症反应的影响,目前国内外尚未见相关报道。本研究采用高脂饮食联合STZ构建T2DM,结果显示,替米沙坦能够明显降低T2DM小鼠mAlb、Scr及BUN水平,但FBG水平未下降,提示替米沙坦以血糖非依赖的方式改善T2DM小鼠肾功能。同时,替米沙坦还可改善肾脏病理学变化,减少炎症细胞浸润。
糖尿病时,肾组织局部RAS活性明显上升,而Ang II是RAS系统的重要成员,研究发现Ang II可间接介导一系列炎症反应,也可直接通过刺激炎性细胞释放炎症因子、细胞因子等,引起肾组织慢性炎症反应而影响DN进展[4]。Mezzano等[13]对10例DN患者进行肾活检,并采用免疫组化技术检测Ang II的分布表达,结果在肾小管上皮细胞和间质细胞发现了高表达的Ang II,这些高表达的Ang II通过刺激肾小管上皮细胞,诱导单核细胞趋化蛋白-1等前炎症介质的产生,从而启动肾脏炎症过程。本研究中,小鼠肾皮质ELISA结果证实,T2DM中Ang II浓度明显升高,不同剂量替米沙坦干预均可使Ang II浓度明显降低,肾皮质炎性细胞因子IL-1β、IL-6、TNF-α水平降低,进一步证实了肾脏局部RAS系统在T2DM小鼠肾脏炎症反应中的作用。
Chemerin是近年来发现的具有参与脂肪细胞脂质代谢调控的新型脂肪因子,其可通过旁分泌途径作用于巨噬细胞等炎性细胞,参与炎症反应。文献报道,在T2DM模型大鼠肾组织中Chemerin表达明显升高,而且其水平的高低与肾脏炎症因子紧密相关[14]。同样,在T2DM伴患者血清中也检测出高水平Chemerin[15]。本研究同样发现,T2DM小鼠肾皮质中Chemerin蛋白的分布增多、表达明显升高,进一步提示Chemerin与T2DM的发生、发展密切相关。给予替米沙坦干预后,小鼠肾皮质中Chemerin蛋白的分布减少、表达下降,表明替米沙坦可能是通过抑制Chemerin蛋白的分布、表达改善T2DM小鼠肾脏炎症反应。
综上所述,替米沙坦能够以血糖非依赖的方式改善T2DM小鼠肾功能,减少肾皮质中炎性细胞因子IL-1β、IL-6、TNF-α水平,这种作用可能是通过抑制肾皮质Ang II的生成,进而抑制肾脏局部RAS,以及抑制Chemerin蛋白的分布、表达,减轻T2DM小鼠肾脏炎症反应,最终改善肾组织的病理性损伤,为临床干预DN的发生和发展提供一定的实验依据和理论基础。
(致谢:本文所有实验均在泉州医学高等专科学校微血管生理调控实验中心完成,特别感谢对课题给予指导及帮助的老师。)
