蛋白磷酸酶(PP1、PP2A)抑制剂Calyculin A对大鼠心脏血流动力学的影响
2018-12-18黄惠丽张文慧陈可塑刘福明
黄惠丽,谢 铭,高 丽,张文慧,陈可塑,刘福明,陈 龙,4
(1. 南京中医药大学药学院,国家科技部规范化中药药理实验室,江苏 南京 210023;2. 南京军区总医院干部病房呼吸科,江苏 南京 210002;3. 南京中医药大学附属医院,江苏省中医院心脏内科,江苏 南京 210029;4. 泰州中国医药城中医药研究院,江苏 泰州 225300)
目前临床使用的正性肌力药物有β受体激动剂、磷酸二酯酶Ⅲ型抑制剂、Na+-K+-ATP酶抑制剂及钙增敏剂[1]。但目前的正性肌力药物并没有针对心衰准确的病理基础的靶点,其临床使用特点为:用于治疗急性期心衰、治疗安全窗口窄以及长期使用疗效不确定或有害[2]。蛋白磷酸酶(protein phosphatase, PP)是一种与蛋白激酶A ( protein kinase A, PKA)相对应存在的酶分子,能够催化被PKA磷酸化的蛋白质发生去磷酸化反应,与PKA构成了控制体内蛋白质磷酸化的开关系统。心肌细胞内存在2种亚型的蛋白磷酸酶,分别为蛋白磷酸酶1和2A(PP1、PP2A),抑制其活性能够产生正性肌力作用。过度抑制磷酸酶并没有使心肌肥厚的小鼠心功能改善,反而加速其心功能恶化[3]。也有实验表明,PKA过度上调极易引起兰尼碱受体2 (ryanodine receptor 2, RyR2)的过度磷酸化,导致心肌细胞舒张期出现Ca2+渗漏现象,诱发心律失常,不利于心力衰竭的治疗[4]。花萼海绵诱癌素 (Calyculin A,CA)是一种从海绵中提取出来的细胞毒素,为PP1和PP2A特异性的抑制剂[5-6]。Calyculin A明显增加心肌细胞L型钙电流[7]及大鼠心室肌的收缩力[8]。然而,Calyculin A对大鼠心脏血流动力学及其心肌细胞钙释放的作用尚未见报道,本文通过对Calyculin A的研究,初步判断PP1、PP2A能否作为靶点,开发正性肌力药物。
1 材料与方法
1.1药物与试剂Calyculin A(批号:101932-71-2,规格:25 μg,Genne Operation公司);钙荧光指示剂Fluo-3购于东仁化学科技(上海)有限公司;实验溶液配制的试剂购于Sigma公司。
1.2仪器PowerLab 8/35多导生理记录仪(AD Instruments);35-2083 Rev.F Millar放大器、SPR-901(大鼠) Millar心室内压和压力容积导管(美国MILLAR公司);Olympus IX53倒置显微镜(日本Olympus公司);ZYLA-5.5-CL3科研级高灵敏致冷CCD(英国ANDOR公司);Lambda DG-4超高速波长切换装置(美国Sutter);VC3-8灌流给药系统(美国ALA公司)。
1.3实验动物普通SD大鼠,♂,体质量250~300 g,购于南京中医药大学实验动物中心,实验动物生产许可证:SCXK(苏) 2012-0008,实验动物使用许可证:SYXK(苏) 2011-0053。在恒温、各12 h明暗周期的饲养室自由进食和饮水。
1.4在体大鼠心脏及血管血流动力学参数记录Calyculin A对PP1半数抑制量(IC50)为2 nmol·L-1,对PP2A的IC50为0.5~1.0 nmol·L-1[9]。本实验采用4 nmol·L-1,按外液占重量的20%计算,Calyculin A的用量即0.8 μg·kg-1。健康清洁级♂SD大鼠,使用20%乌拉坦(5 mL·kg-1)进行腹腔注射麻醉,将大鼠仰卧位固定,分离右侧颈总动脉及左侧颈静脉,再定标Millar压力容积导管自右颈总动脉插入左心室(过程中根据生理记录仪压力波形变化判断导管位置),然后药物经左侧颈静脉缓慢推注,并记录左心室压力-容积环(P-V loop)及主动脉压。实验数据采用AD Instruments的Labchart 8软件分析。实验结束后,自颈静脉推注30%高渗盐水20~50 μL,并取大鼠自身血液进行容积定标。血流动力学指标包括:心输出量(cardiac output,CO)、心率(heart rate,HR)、射血分数(ejection fraction,EF)、每搏输出量(stroke volume,SV)、左心室搏出功(stroke work,SW)、收缩末期容积(end-systolic volume,Ves)、舒张末期容积(end-diastolic volume,Ved)、收缩末期压力(end-systolic pressure,Pes)、舒张末期压力(end-diastolic pressure,Ped)、左心室收缩弹性(end-systolic elastance, Ees)或左心室收缩末期压力-容积关系曲线斜率(the slope of the left ventricular end-systolic P-V relationship)、左心室舒张末期弹性(end-diastolic elastance, Eed)或左心室舒张末期压力-容积关系曲线斜率(the slope of the left ventricular end-diastolic P-V relationship)、舒张压(diastolic blood pressure, DBP)、收缩压(systolic blood pressure, SBP)、脉压差(pulse pressure, PP)。
1.5大鼠心肌细胞分离动物及麻醉同在体实验。大鼠开胸迅速取出心脏,置于(0~4)℃无钙灌流液中使其停搏。修剪组织分离主动脉,将心脏挂在改良Langendorff逆行性灌流系统装置上,在温度为(37.5 ± 0.5)℃,充氧(95% O2+ 5% CO2),灌流压90 cm H2O (1 cm H2O=0.098 kPa)条件下,经主动脉逆行灌流无钙台氏液。等心脏变软松弛后,用含酶(胰蛋白酶0.1 g·L-1+胶原酶Ⅱ型2 g·L-1)无钙灌流液20 mL反复灌流30 min至心脏膨大、松弛后,换KB液冲洗5 min终止消化。取下心脏放置在盛有KB液的玻璃表面皿中,将其充分剪碎,经直径200 μm的尼龙网过滤得到细胞悬液,静置放室温备用。无钙台氏液组成(mmol·L-1): NaCl 117、KCl 5.7、NaHCO34.4、MgCl21.7、HEPES 20、NaH2PO41.5、葡萄糖11,pH用NaOH调至7.40。KB液组成(mmol·L-1): KCl 25、NaH2PO410、葡萄糖11、KOH 85、L-谷氨酸70、牛磺酸10、EGTA 0.5、HEPES 5,pH用KOH调至7.40。
1.6离子影像测定大鼠左心室心肌细胞钙瞬变左心室心肌细胞用KB液冲洗3次后,加入钙荧光指示剂Fluo-3 (5 μmol·L-1),恒温37℃避光孵育30 min。将孵育好的心肌细胞放在灌流槽中,用细胞外液持续灌流冲洗。局部场刺激由刺激器通过一对刺激电极(末端为裸露的白金丝)以0.2 Hz 、10 V强度的脉冲电刺激加于心肌细胞两侧,刺激细胞收缩。单色激发光源发出激发光,通过耦合系统引入荧光显微镜,聚焦到细胞平面,激发细胞中的荧光探针发出荧光,用空气冷却CCD相机采集并记录荧光信号。吸收波长510 nm,激发波长488 nm。

2 结果
2.1CalyculinA对大鼠左心室收缩动力学的作用与正常对照组相比,Calyculin A (0.8 μg·kg-1)能够增加SW、CO、SV、Ves、Pes、EF。结果见Tab 1、Fig 1。
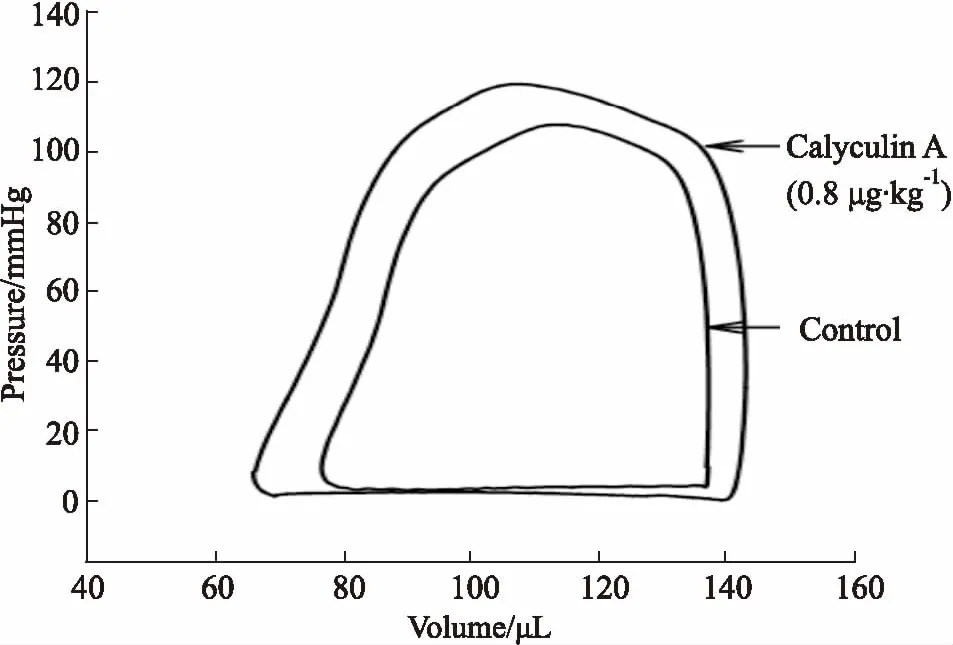
Fig 1 Representative effective curves of Calyculin A (0.8 μg·kg-1) on P-V loop from normal rat left ventricle
2.2CalyculinA对大鼠左心室内在收缩性能的影响左心室收缩末期压力-容积(ESPVR)曲线斜率(end-systolic elastance, Ees)和舒张末期压力-容积(EDPVR)曲线斜率(end-diastolic elastance, Eed)反映了心室收缩特性与舒张特性。Fig 2A、2B为阻断下腔静脉后,Calyculin A (0.8 μg·kg-1)加药前后对ESPVR及EDPVR关系曲线变化影响的代表性曲线;Fig 2C、2D为Calyculin A (0.8 μg·kg-1)对ESPVR及EDPVR关系曲线的斜率统计直方图。实验结果表明,Calyculin A (0.8 μg·kg-1)能够同时提高大鼠心室收缩(Ees值增加)与舒张性功能(Eed值下降),这种作用与回心血量(心肌初长度)无关。

Tab 1 Effects of Calyculin A on normal rat heart hemodynamic parameters in vivo n=4)
bpm: beats per minute.*P<0.05,**P<0.01vscontrol
2.3CalyculinA对大鼠动脉压及心室-血管耦合性的影响外周阻抗可以归纳成1个单一的变量-动脉阻抗Ea (arterial elastance),即单位容量变化带来的压力变化,数值上Ea=Pes/SV。Ea/Ees比值即反映了心室收缩和动脉系统阻抗作用相互匹配的程度,称为心室-血管耦联(ventricular-arterial coupling)。Calyculin A (0.8 μg·kg-1)明显增加收缩压(与之对应的左室内压)、舒张压及脉压差(P<0.01),降低动脉阻抗Ea(P<0.05),提高心室-血管耦联程度(P<0.01)。结果见Fig 3、Tab 2。

Tab 2 Effects of Calyculin A (0.8 μg·kg-1) on rat arterial blood pressure, pulse pressure, arterial elastance and ventricular-arterial n=4)
*P<0.05,**P<0.01vscontrol
2.4CalyculinA对大鼠左心室心肌细胞钙释放的影响Calyculin A(100 nmol·L-1)明显降低标准化的舒张期胞质钙浓度(diastolic Ca2+concentration) (P<0.01),明显增加标准化的钙释放幅值(amplitude of Ca2+release) (P<0.01),明显缩短标准化的钙回吸收时间常数值(time constant,τ) (P<0.05)。结果见Fig 4、Tab 3。

Fig 3 Representative effective curves of Calyculin A on rat left ventricular pressure (A), systolic blood pressure and diastolic blood pressure (B)
3 讨论
虽然能够发挥正性肌力作用的化合物数量众多,作用于心脏的靶点各异,但真正用于临床治疗心力衰竭的正性肌力药物很少。其原因是药物在发挥正性肌力作用的同时,会不成比例地增加心肌耗氧量。蛋白磷酸酶(PP1、PP2A)是参与肌浆网钙释放及再吸收的重要环节,通过去磷酸化作用,使得肌浆网受磷蛋白(PLB-16、PLB-17)去磷酸化。而去磷酸化的PLB对肌浆网钙泵(SERCA2a)产生抑制作用,引起胞质内的钙回吸收的能力下降。而蛋白磷酸酶(PP1、PP2A)抑制剂Calyculin A抑制蛋白磷酸酶(PP1、PP2A)的活性,增加受磷蛋白(PLB-16、PLB-17)的磷酸化,解除受磷蛋白对SERCA2a的抑制作用,实现其正性肌力作用。受磷蛋白的磷酸化受PKA及钙/钙调蛋白依赖性蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinaseⅡ, CaMKⅡ)的调控[10]。有关Calyculin A的亚细胞水平的研究报道很多,分子机制已非常明确,但在整体动物水平,Calyculin A对心脏的血流动力学研究鲜有报道。本研究较为清楚地阐明了基于蛋白磷酸酶(PP1、PP2A)靶点的Calyculin A发挥良好的血流动力学作用,且无增加心率的作用,增加心肌钙释放,也进一步佐证了Calyculin A是通过增强肌浆网钙泵活性,发挥其正性肌力作用。

Fig 4 Representative curves of before (A) and after (B) Calyculin A on Ca2+ transients from normal rat left ventricular myocytes with one exponential (three parameters) fitting used to analyze time constant (τ)

Tab 3 Effects of Calyculin A (100 nmol·L-1) on Ca2+ transient from rat left ventricular n=4)
*P<0.05,**P<0.01vscontrol
本研究采用双压力P-V loop技术,同时测定左心室的压力-容积的关系,以及主动脉的压力变化。该技术是分析药物对心血管血流动力学作用的重要手段。实验表明,Calyculin A不仅增加心肌收缩力,还能增加心肌内在收缩性能(增加心室收缩末期压力-容积ESPVR曲线斜率,Ees)以及增加心室的弹性(降低心室舒张末期压力-容积曲线斜率,Eed);提高心室射血的动力与动脉的阻力相互匹配程度。Ees反映心室的收缩性能,Ea反映动脉系统的阻抗,Ea与Ees的合理匹配才能够发挥心血管之间的最大效能。因此,Ea/Ees比值反映了动脉系统阻抗和心室收缩作用相互匹配的程度,称为心室-血管耦联(ventriculo-arterial coupling) 。研究表明,只有当Ea接近Ees时(其比值介于0.8~1.1),心室做功才能达到最佳状态,耗能最低[11-12]。
心肌细胞钙释放兴奋-收缩耦联的中心环节,其上游是心肌动作电位触发Ca2+诱导的Ca2+释放,其下游是肌浆网释放的Ca2+触发肌小节收缩。作为中心环节的Ca2+释放是通过肌浆网RyR2受体,将肌浆网中高浓度的钙释放到胞质。而舒张期Ca2+回吸收主要通过肌浆网的Ca2+泵(SERCA2a)回吸收到肌浆网(约占90%),其余约10%主要通过细胞膜上钠-钙交换体(Na+-Ca2+exchanger, NCX)及细胞膜上钙泵(plasma membrane Ca2+-ATPase, PMCA) 经细胞膜外排到胞外,实现在兴奋期经Ca2+通道进入胞内等量的Ca2+再次排出细胞[13-14]。Calyculin A不仅增加Ca2+释放的幅值,还能降低舒张期胞质内的Ca2+浓度。通过对回吸收下降曲线的单指数拟合,发现Calyculin A能明显降低回吸收曲线的时间常数(τ)。时间常数(τ)是反映曲线下降的速率,而该速率主要是肌浆网钙泵构成的。由此可以推论:Calyculin A通过增强Ca2+泵活性增加舒张期Ca2+的回吸收,实现降低胞质钙浓度的作用;Ca2+泵活性增加后提升肌浆网内的Ca2+浓度,进一步提高肌浆网与胞质内的Ca2+浓度差,而差值导致进一步增加Ca2+释放的幅值。
综上所述,Calyculin A基于靶点蛋白磷酸酶(PP1、PP2A),通过增加肌浆网Ca2+泵活性,实现其正性肌力作用,该正性肌力作用是基于Ca2+泵活性增强的基础上。蛋白磷酸酶(PP1、PP2A)可作为靶点开发正性肌力药物,用于治疗心力衰竭。
