Glu-mGluR2/3-ERK信号通路在糖尿病并发抑郁症大鼠前额叶皮质神经元凋亡中的作用
2018-12-18赵洪庆王宇红
柳 卓,赵洪庆,孟 盼,杨 蕙,向 韵,王宇红,
(1. 湖南中医药大学中药粉体与创新药物国家重点实验室培育基地,湖南 长沙 410208;2. 湖南中医药大学第一附属医院中心实验室,湖南 长沙 410007)
糖尿病并发抑郁症(diabetic depression, DD)继发于糖尿病,具有高发病率和高危害性的特点,其发病率占糖尿病患者的30%-50%,自杀风险是普通人群的8倍[1]。因而,开展DD的发病机制研究具有重要意义。前额叶皮质是大脑边缘系统的关键区域,主要负责感觉认知、执行功能、情绪调节等,研究表明,抑郁症的发生发展与大脑前额叶皮质损伤关系密切[2]。目前,对DD发生机制的研究几乎都集中于海马区,尚未涉及同样负责调控认知及情绪的前额叶皮质区。越来越多的证据表明,谷氨酸(glutamate, Glu)在抑郁症的发生过程中扮演了重要角色,其通过与代谢型谷氨酸受体2/3(metabotropic glutamate receptor 2/3, mGluR2/3)结合,激活下游细胞外信号调节激酶(extracellular signal-regulated kinase, ERK),进而通过下调神经营养因子合成、诱导神经元凋亡等方式,导致抑郁行为的产生[3-5]。然而,谷氨酸能否通过该途径介导DD前额叶皮质的损伤,尚未见相关研究。因此,本研究以Glu-mGluR2/3-ERK通路为切入点,探讨其在前额叶皮质神经元凋亡中的作用,对深入阐明DD的发病机制具有重要研究价值。
1 材料与方法
1.1实验动物SPF级SD大鼠,♂,体质量(180~220) g,购自湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘)2013-0004。动物购入后,饲养于温度(25±2)℃、相对湿度(50±5)%、光/暗周期12 h/12 h的SPF级环境中,适应性喂养5 d。
1.2试剂与仪器Glu对照品(中国食品药品检定研究院);LY341495(美国Sigma);mGlu2/3、ERK、GFAP单克隆抗体(英国Abcam);二抗试剂盒、DAB试剂盒、进口羊血清工作液(北京中杉金桥)。Morris水迷宫、开野视频跟踪系统(西班牙Panlab);倒置显微镜(日本Olympus);高效液相色谱仪(美国安捷伦);组织切片机(美国Themo)。
1.3动物分组与造模50只SD大鼠分为2部分,其中20只随机分为正常对照组和抑郁模型组,另外30只用于制备糖尿病模型。糖尿病模型建立方法为:高脂灌胃14 d后,大鼠一次性尾静脉注射链脲佐菌素(streptozocin,STZ)38 mg·kg-1,并于STZ注射72 h后测定大鼠空腹血糖值。去除造模过程中的死亡大鼠,选取空腹血糖≥16.70 mmol·L-1的大鼠,并依据血糖值随机分为糖尿病模型组和DD模型组,每组11只。此后,正常对照组和糖尿病模型组大鼠正常饲养,抑郁模型组和DD模型组大鼠则继续给予21 d慢性不可预见性温和应激,应激方法包括4℃冰水浴、45℃热水浴、电击、夹尾、昼夜颠倒、倾笼等,每天随机给予1次应激,同种应激不连续出现,造模期间大鼠均孤笼饲养。造模结束后,所有大鼠进行行为学测试,测试完成后,麻醉大鼠,每组一半大鼠剥离前额叶皮质于液氮中速冻,另一半经多聚甲醛灌注后取脑组织保存于甲醛溶液中固定。
在上述实验中发现,DD模型组大鼠前额叶皮质区caspase-3表达明显下降,神经元凋亡明显,同时mGluR2/3、ERK表达也有异常。为确定该作用是否与调控Glu-mGluR2/3-ERK信号通路有关,重新选取35只SD大鼠,分为正常对照组、DD模型组,LY341495干预组(mGluR2/3阻断剂组),其中DD模型组和LY341495干预组造模方法同上,同时,LY341495干预组从应激造模d 1起连续腹腔注射LY341495(1 mg·kg-1) 21 d。
1.4行为学检测
1.4.1旷场实验 将大鼠放入底面划分为25个小格的黑色敞箱中,每次从同一角落放入,大鼠适应1 min后,记录4 min内的水平运动次数(四爪均在格内)和垂直站立次数(两前爪抬起)。
1.4.2Morris水迷宫实验 Morris水迷宫实验包括定位航行实验和空间探索实验,分别考察动物的学习和记忆能力,① 定位航行实验:于应激d 17开始进行训练,将大鼠面向池壁放入水中,自由寻找平台(高出水面2 cm),若60 s内未找到,则牵引其至平台停留10 s,持续训练4 d。训练完成后,将大鼠从背对平台方向放入水中,记录大鼠爬上平台所用时间,即为大鼠的逃避潜伏期时间(latency time);② 空间探索实验:于应激d 21撤去平台,记录大鼠60 s内在原平台所在象限停留时间,即为大鼠的目标象限记忆时间(memory time)。
1.5HE染色取固定于甲醛溶液中的脑组织,常规脱水、透明、浸蜡、石蜡包埋, 以5 μm厚连续切片。浸泡在0.01 mol·L-1PBS缓冲液中12 h,经苏木精-伊红染色后脱水,并用中性树胶封片,于光学显微镜下观察、拍照,分析各组大鼠前额叶皮质区损伤情况。
1.6HPLC法检测谷氨酸含量取冷冻保存的前额叶皮质,称重,加入一定量甲醇后匀浆,离心后取上清液,0.22 μm滤膜过滤后待测。HPLC检测条件为:色谱柱:氨基酸分析柱(250 mm×4 mm,5 μm);流动相:含5%甲醇乙酸钠-乙腈(80 ∶ 20);流速:0.2 mL·min-1;进样量:20 μL;柱温:40℃。标准曲线的制备方法为:配成1 g·L-1的谷氨酸储备液,依次稀释成3.13、0.781、0.195、0.048 8、0.012 2 mg·L-1,根据各峰面积计算标准曲线为y=75.09x+34.63,相关系数为0.997 8,相关性良好。
1.7免疫组化法检测相关蛋白表达取固定于甲醛溶液中的脑组织,常规石蜡包埋后切片,分别用75%、95%、100%梯度乙醇脱水,浸蜡,水化,冲洗,滴加山羊血清封闭液,37℃孵育30 min,去除血清,加caspase-3、mGluR2/3、ERK一抗4℃孵育过夜;PBS洗3次,滴加二抗试剂盒,反应增强液孵10 min,二抗孵10 min;冲洗,DAB显色,苏木精复染,梯度乙醇脱水,封片。将免疫组化切片在高倍镜下(×400)进行拍摄,并采用Image-Pro Plus软件分析积分光密度值(integral optical density, IOD)。

2 结果
2.1行为学检测
2.1.1Morris水迷宫测试结果 Tab 1结果显示,与对照组比较,各模型组大鼠潜伏期时间均有不同程度的延长,目标象限记忆时间缩短(P<0.05或P<0.01),学习记忆功能均受到损害;与糖尿病组比较,抑郁症和DD组大鼠学习记忆能力也有明显的下降(P<0.05或P<0.01)。

Tab 1 Comparison of learning and
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsdiabetes model
2.1.2旷场实验结果 Tab 2结果显示,与对照组比较,各模型组大鼠水平和垂直运动次数均明显下降(P<0.05或P<0.01);与糖尿病组比较,抑郁组和DD组大鼠自主活动次数明显下降(P<0.05或P<0.01);与抑郁组比较,DD模型组大鼠自主活动能力也明显下降(P<0.05)。

Fig 1 Results of HE staining in rat prefrontal cortex(×400)

Tab 2 Comparison of autonomous
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsdiabetes model;△P<0.05vsdepression model
2.2HE染色结果如Fig 1所示,正常大鼠前额叶皮质神经元形态规则,排列整齐,染色质均匀,神经元间隙正常;各模型组大鼠前额叶皮层神经元有不同程度的胞体肿胀,核固缩,胞质浓缩深染,排列紊乱,间隙增宽等病理现象,以DD组最为严重。
2.3大鼠前额叶皮层谷氨酸含量如Fig 2所示,与对照组比较,糖尿病组大鼠前额叶皮质谷氨酸含量无明显变化,抑郁症组和DD组有明显升高(P<0.01或P<0.05);与糖尿病模型组比较,抑郁症组和DD组大鼠谷氨酸含量明显升高(P<0.05);与抑郁症组比较,DD组大鼠谷氨酸含量明显升高(P<0.05)。

Fig 2 Glutamate content in rat prefrontal
*P<0.05,**P<0.01vscontrol;#P<0.05vsdiabetes model;#P<0.05vsdepression model
2.4Caspase-3免疫组化结果如Fig 3所示,与对照组比较,各模型组大鼠前额叶皮质区caspase-3免疫阳性均明显增强(P<0.01或P<0.05),其中以DD组阳性表达最为明显,且与糖尿病组和抑郁症组比较差异均有统计学意义(P<0.01或P<0.05)。
2.5mGluR2/3和ERK的免疫组化结果如Fig 4所示,与对照组比较,各模型组大鼠前额叶皮质区mGluR2/3表达明显上升,ERK明显下降,以DD组趋势最为明显;与糖尿病组或抑郁症组比较,DD组大鼠前额叶皮质区mGluR2/3和ERK表达差异也有显著性(P<0.01或P<0.05)。
2.6mGluR2/3阻断剂对前额叶皮质神经元凋亡的影响如Fig 5所示,给予mGluR2/3阻断剂LY341495后,DD大鼠前额叶皮质神经元排列基本整齐、间隙正常,病理损伤情况得到一定缓解,caspase-3免疫阳性表达明显下降(P<0.01),但较正常对照组表达仍有一定增加(P<0.05);谷氨酸含量较DD组有一定程度的上升(P<0.05),可能是由于谷氨酸受体表达受抑制而致使谷氨酸堆积,mGluR2/3表达明显下降(P<0.01),ERK表达上升(P<0.05)。说明mGluR2/3-ERK信号在前额叶皮质神经元凋亡过程中确实起到调控作用。
3 讨论
抑郁症是糖尿病常见的并发症之一,我国约有51%的糖尿病患者存在不同程度的抑郁症。糖尿病可与抑郁症相互加重,增加患者的病死率和致残率,DD患者自杀率高达10%[5]。前额叶皮质与感觉认知、情绪调节密切相关[6],糖尿病患者容易出现认知功能下降,主要表现为前额叶皮质功能受损[7]。前额叶皮质神经元功能的缺失及神经胶质性增生则会导致抑郁症的发生[8]。
Morris水迷宫被广泛用于研究与空间学习记忆相关的脑区功能评价,旷场实验是通过观察大鼠的自发性探索活性评价大鼠的活动能力,两者均是动物抑郁样行为评价的重要方法。本实验发现,DD大鼠学习记忆功能明显下降,自主活动能力降低,较糖尿病组和抑郁组均更为严重。Caspase-3是细胞凋亡执行阶段的关键蛋白,负责对部分或全部关键蛋白进行酶切,使DNA片段化,进而导致细胞凋亡[9]。本研究中,DD大鼠前额叶皮质区神经元缺失明显,并伴有胞体肿胀、核固缩、空泡变性等病理现象,同时caspase-3阳性表达明显增多,表明DD大鼠前额叶皮质神经元病理改变与凋亡有关。

Fig3Caspase-3immunohistochemicalstaining
inprefrontalcortexofrats(×400)
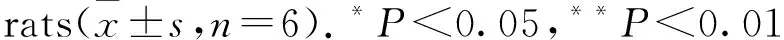

Fig4mGluR2/3andERKimmunohistochemicalstaininginprefrontalcortexofrats(×400)
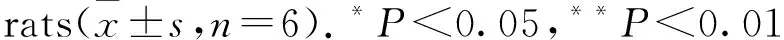

Fig 5 Effects of mGluR2/3 blocker (LY341495) on apoptosis of prefrontal cortical neurons(×400)
谷氨酸是一种兴奋性神经递质,对中枢神经系统正常功能活动与神经调节发挥着重要作用,但高浓度谷氨酸具有神经毒性作用,能损害神经元而诱发神经精神性疾病[10]。糖尿病状态下,谷氨酸含量异常升高,与胞内mGluR2/3过度结合,继而激活下游ERK信号,活化的ERK进入细胞核内,一方面磷酸化转录因子,从而调控基因的表达,影响细胞周期,进而介导细胞凋亡的过程[11];另一方面,通过调控相关信号,促使神经营养因子合成及分泌下降,神经元营养缺失而逐渐凋亡[12]。本实验结果表明,DD大鼠前额叶皮质区谷氨酸含量明显升高,mGluR2/3免疫阳性增强,ERK免疫阳性明显减弱,说明Glu-mGluR2/3-ERK通路可能在介导前额叶皮质神经元凋亡过程中发挥了重要作用。
LY341495是mGluR2/3的特异性拮抗剂[13]。本实验通过使用LY341495进一步证实Glu-mGluR2/3-ERK通路在DD前额叶皮质神经元凋亡中的关键作用,结果表明,给予LY341495后,DD大鼠谷氨酸含量升高,mGluR2/3阳性表达下降,说明阻断剂发挥作用,mGluR2/3表达受阻,而谷氨酸由于其受体表达抑制而致其在脑区堆积,ERK阳性表达较模型组有明显变化,说明其受到上游mGluR2/3表达的影响。同时,DD大鼠前额叶皮质损伤情况得到一定程度的缓解,凋亡执行蛋白caspase-3免疫阳性表达明显下降,说明LY341495能使DD大鼠前额叶皮质神经元凋亡减少,并改善其病理损伤。上述结果说明,DD疾病下,Glu-mGluR2/3-ERK信号通路调控caspase-3表达,介导前额叶皮质区神经元凋亡,而mGluR2/3阻断剂能逆转这一过程。
综上,我们认为前额叶皮质谷氨酸含量异常增加,Glu-mGluR2/3-ERK信号障碍,导致caspase-3表达上升,神经元发生凋亡,是导致DD发生的重要原因。本研究对于以前额叶皮质为靶区的DD发病机制研究具有重要意义,下一步将继续研究DD下大脑前额叶皮质Glu-mGluR2/3-ERK通路与神经血管单元损伤间的关系。
(致谢: 本实验主要在湖南中医药大学中药粉体与创新药物国家重点实验室培育基地完成,在此对实验室各位老师及同学的帮助表示衷心的感谢!)
