人BMSCs自噬水平和成骨分化能力比较
2018-12-18徐丽丽胥方元万永鲜
徐丽丽 胥方元 万永鲜
西南医科大学附属医院,四川 泸州 646000
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)主要存在于骨骼系统松质骨中,是一种具有多向分化能力的早期前体细胞,在适当条件刺激下可以分化为骨细胞[1]。基于间充质干细胞的成骨分化能力,因此来源于各种组织的间充质干细胞被视为骨组织工程的重要种子细胞来源。由于BMSCs取材简单,组织来源较为丰富,逐渐成为了骨缺损、骨软化病、骨质疏松症(osteoporosis,OP)等疾病干细胞治疗的重要种子细胞[2]。自噬是生物体内一种保守的生命现象,基本的生理学意义在于清除受损的细胞器或蛋白,将其代谢产物重新供能,从而维持细胞内环境的稳态[3]。近年来,自噬在细胞和器官分化和发育过程中的作用备受关注,例如自噬缺乏导致小脑和大脑皮质广泛的神经细胞凋亡和退行性改变[4];而对于心肌细胞,自噬缺乏容易导致心肌肥厚、心功能不全等[5];自噬同样在造血细胞分化成熟过程中扮演着重要角色,抑制自噬可能导致造血干细胞分化成熟障碍,表现为贫血和白细胞减少[6]。在自噬对成骨分化影响方面,国内李军等[7]利用自噬激动剂雷帕霉素促进BMSCs自噬活性后,其向成骨分化的潜力减弱。但国外研究报道葡萄膜球菌脂磷壁酸可以通过激活自噬来促进小鼠间充质干细胞的成骨分化[8]。
综上所述,自噬对于间充质干细胞成骨分化的影响并不明确,本实验研究拟通过比较实验组骨质疏松与正常对照组BMSCs的成骨分化能力和自噬水平,初步探讨自噬对人BMSCs成骨分化的影响,为下一步选择成骨分化靶点,促进骨形成提供新的理论依据。
1 材料和方法
1.1 实验仪器
超净工作台(苏州净化设备厂,中国),细胞培养箱(Thermo,美国),离心机(Beckman-Coulter,美国),倒置显微镜(Nikon,日本),超声细胞破碎仪(Philips,荷兰),凝胶成像仪(Bio-Rad,美国),激光共聚焦荧光显微镜(Hitachi,日本),核酸蛋白测定仪(Thermo Fisher,美国),荧光定量PCR仪(Bio-Rad,美国)。
1.2 实验试剂
α-MEM培养基(Gibco,美国),胎牛血清(Gibco,美国),PBS缓冲液(Hyclon,美国),0.25%胰蛋白酶(索莱宝,中国),成骨诱导培养基(赛业生物,中国),RIPA细胞裂解液(碧云天,中国),BCA蛋白浓度测定试剂盒(碧云天,中国),蛋白Marker(碧云天,中国),SDS-PAGE配胶试剂盒(碧云天,中国),TBST缓冲液(索莱宝,中国),PVDF膜(Millipore,美国),ECL发光显影液(Millipore,美国),LC3小鼠抗人单克隆抗体(Sigma,美国),P62小鼠抗人单克隆抗体(Abcam,英国),β-actin兔抗人单克隆抗体(碧云天,中国),山羊抗小鼠IgG二抗(碧云天,中国),山羊抗兔Ig二抗(碧云天,中国),4%多聚甲醛固定液(碧云天,中国),茜素红染色试剂盒(Thermo Fisher,美国),碱性磷酸酶染色试剂盒(碧云天,中国),LC3-GFP慢病毒(汉恒,中国)。
1.3 实验方法
1.3.1BMSCs分离培养:10例椎体松质骨来源于2015年6月至2016年6月在我院接收椎体次全切减压植骨内固定术的患者。所有患者在术前均签署了知情同意书,该研究经过了我院伦理委员会的批准。根据年龄分为两组,A组为老年骨质疏松组:共5例,年龄60~75岁,平均(69.4±7.2)岁,术前骨密度检测T值<-2.5,诊断为骨质疏松症,未有过抗骨质疏松治疗史;B组为年轻对照组,共5例,年龄26~35岁,平均(30.2±5.4)岁,既往体健,非病理性骨折。
小心分离术中摘取的椎体中央松质骨,用含1%双抗的PBS反复冲洗、离心3次;用眼科剪将松质骨剪成泥样,移植入10 cm培养皿中,每一份松质骨的体积约为10 mm×10 mm×10 mm,每块组织间的距离不超过5 mm,37 ℃细胞培养箱中孵育2 h;沿培养皿壁小心加入5 mL含10%FBS的α-MEM培养基,避免松质骨团块漂浮,继续置于37 ℃细胞培养箱中培养;3~4 d再添加5 mL完全培养基,继续培养观察;7 d左右通过倒置显微镜可以观察到纺锤样的单层贴壁细胞,即为人BMSCs,细胞集落边缘细胞间最先相互融合,当细胞融合至80%以上后行胰酶消化传代培养;取第1~3代细胞进行后续实验。
1.3.2Western blot检测:取A组和B组的原代细胞,常规提取细胞总蛋白,行Western blot检测自噬相关蛋白LC3和P62,实验步骤简述如下:(1)取A组和B组原代细胞加入RIPA裂解液,冰上常规反应30 min后,超声细胞震碎仪处理1 min,4 ℃,12 000 g高速离心5 min后取上清即为提取的总蛋白;(2)采用BCA法常规检测蛋白浓度,短期内使用的蛋白以1∶4混合5×SDS蛋白上样缓冲液,煮沸5 min后放置于-20 ℃保存;(3)采用SDS-PAGE配胶试剂盒,根据目标蛋白分子量大小,配置相应的凝胶浓度;(4)上样,每孔以相同蛋白量50 μg恒压(100 V)跑胶1~2 h,待溴酚蓝进入分离胶底部后电泳结束;(5)采用湿转法将胶上的蛋白转移至PVDF膜上,转膜条件250 mA恒流转30 min~1 h;(6)5%脱脂奶粉37 ℃封闭1 h,加入对应合适浓度的一抗,4 ℃孵育过夜;(7)复温半小时后,TBST缓冲液洗涤 5 min/次×3次,加入对应合适浓度二抗,37 ℃孵育1 h;(8)TBST缓冲液洗涤 5 min/次×3次,加入ECL显影液曝光,拍照。(9)条带灰度值采用Quantity one软件分析。
1.3.3LC3-GPF腺病毒转染:自噬检测的金标准为电镜观察,但由于电镜观察耗时较久,且只能捕捉一个时间横断面的细胞状态,不利于监测细胞自噬状态。因此,本实验采用携带LC3-GFP绿色荧光基团的腺病毒转染BMSCs,观察自噬的动态过程,实验原理如下:自噬没有被激活时,LC3-GFP融合蛋白弥散在胞浆中;自噬形成时,其转位聚集至自噬体膜上,在激光共聚焦荧光显微镜下即可观察到一个个明亮的绿色荧光蛋白,理论上一个绿色荧光斑点即代表一个自噬体,可以通过计数斑点的数量来评价自噬活性的高低。腺病毒转染步骤简述如下:(1)以1×105/孔细胞密度将原代BMSCs种植于共聚焦培养皿中,加入完全培养基,细胞培养箱孵育过夜;(2)加入1/2体积含有病毒的培养基,以感染复数30转染目的细胞,每孔加入病毒悬液2 h后换液;(3)转染24 h后,现在普通荧光显微镜下初步观察转染效率,是否可以看到绿色荧光。一般在转染后36~48 h可以观察到明显的荧光颗粒,这时用Dapi染核后在激光共聚焦显微镜下观察、计数绿色荧光斑点;(4)随机选取3个不同视野,计数绿色斑点,然后行统计学分析。
1.3.4成骨诱导培养:(1)成骨诱导分化培养基配置。①使用前将血清置于2 ℃~8℃环境中解冻过夜至血清完全溶解,轻晃试剂瓶以确保血清充分混均;②配置前30 min,室温静置溶解抗坏血酸、β-甘油磷酸钠、双抗和谷氨酰胺,轻轻上下颠倒充分混匀;③使用前10 min,室温静置溶剂地塞米松;④用70%乙醇擦拭各个试剂瓶开口外壁消毒,静置待酒精充分挥发。将抗坏血酸、β-甘油磷酸钠、成人BMSC专用胎牛血清、双抗和谷氨酰胺全部加入成人BMSC成骨诱导分化培养基中,最后加入地塞米松;⑤轻晃配置好的完全培养基,充分混匀。(2)成骨诱导培养实验步骤。①取1~3代BMSCs按照5×104/孔细胞密度种植于事先包被0.1%明胶的六孔板,每孔加入2 mL完全培养基;②将细胞置于37 ℃,5% CO2的培养箱中进行培养;③当细胞融合度达到60%~70%时,小心将孔内的完全培养基移弃,向六孔板中加入2 mL OriCellTM成人BMSC成骨诱导分化完全培养基;④每隔3 d换液一次,诱导3周后进行后续检测。
1.3.5茜素红染色:(1)成骨诱导分化3周后,摒弃成骨诱导培养基,用PBS缓冲液漂洗2次后,每孔加入1 mL 4%多聚甲醛固定液,室温静置30 min;(2)摒弃多聚甲醛溶液,用PBS漂洗3 min/次×3次后,每孔加入茜素红染色液,室温静置3~5 min;(3)摒弃茜素红染液,用PBS漂洗3 min/次×3次后,置于倒置光学显微镜下观察。
1.3.6碱性磷酸酯酶染色:(1)配置碱性磷酸酶染色工作液:参照试剂盒说明,将sodium nitrite soulution、frv-alkaline solution按照1∶1混合,轻轻颠倒混匀,静置2 min。加入45份比例的双蒸水,再加入1份比例的naphthol as-bi alkaline solution,充分混匀;(2)成骨诱导分化3周后,摒弃成骨诱导培养基,用PBS缓冲液漂洗2次后,每孔加入1 ml 4%多聚甲醛固定液,室温静置30 min;⑶摒弃多聚甲醛溶液,用PBS漂洗3 min/次×3次后,每孔加入碱性磷酸染色液,室温静置3~5 min;⑷摒弃碱性磷酸酶染液,用PBS漂洗3 min/次×3次后,置于倒置光学显微镜下观察。
1.3.7荧光定量PCR检测:成骨诱导分化3周后,提取细胞总RNA,采用荧光定量PCR检测主要的成骨指标I型胶原(collagen type I,Col I)、骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)、发育不全相关转录因子2(runt related transcription factor 2,RUNX2)的mRNA表达差异。实验步骤简述如下:(1)预冷PBS缓冲液于冰上30 min,弃去培养基,PBS漂洗5 min/次×3次,每孔加入1 mLRNA提取裂解液(Trizol),冰上静置15 min后反复吹打细胞,使其充分裂解;(2)将细胞裂解液移入1.5 mL EP管中,加入200 μL氯仿,剧烈振荡,冰上静置5 min后高速离心,12 000 g,4℃,离心5 min;(3)取200~400 μL上层水相,移到另一个EP管中,以1∶1加入相同体积异丙醇,轻柔混匀,冰上静置15 min后高速离心,12 000 g,4℃,离心15 min;(4)移弃上清,可以看到小块羽絮状沉淀,即所提取的RNA,用500 μL75%乙醇洗涤RNA沉淀;(5)高速离心12 000 g,4℃,离心5 min,自然风干RNA后加入20 μL DEPC水溶解;(6)用核酸蛋白测定仪测定RNA的浓度和纯度,可放置于-20 ℃短期保存;(7)采用逆转录试剂盒合成cDNA;反应液配置完成后,加入200 μL PCR反应管汇总,置于PCR仪中进行逆转录反应,条件如下:37 ℃ 逆转录 15 min;85 ℃ 终止灭活逆转录酶 5 s;4 ℃ 终止逆转录反应;得到的cDNA样本可以置于-20 ℃短期保存。(8)SYBR Green荧光定量PCR检测目的基因表达。(9)荧光定量PCR结果采用2- ΔΔCT法统计分析。
1.4 统计学分析
实验数据均以平均数±标准差表示,采用SPSS 20.0软件进行分析处理。两两比较采用t检验,两组以上比较采用单因素方差分析,其中两两比较采用post hoc检测。P<0.05表示差异具有统计学意义。
2 结果
2.1 老年骨质疏松BMSCs自噬水平降低
为了比较来源于老年骨质疏松患者和正常年轻患者BMSCs的基础自噬水平,分别取A组和B组的原代细胞,首先通过Western blot检测比较自噬相关蛋白LC3和P62的表达。自噬形成时,胞浆型LC3(即LC3-I)会酶解一小段多肽,转变为自噬体膜型(即LC3-II),因此可以通过LC3-II/I比值来判断自噬的激活程度。而P62是自噬的降解底物,在自噬形成时与自噬体膜上的LC3相结合,继而被自噬体所降解,因此P62表达高低与自噬活跃程度呈反比。结果表明,A组BMSCs的LC3-II/I表达比率比B组明显降低,差异具有统计学意义(P<0.05);而P62的蛋白表达在A组BMSCs中却明显升高,与B组相比差异同样具有统计学意义(P<0.05),见图1。

图1 Western blot检测自噬相关蛋白LC3和P62Fig.1 Western blot detection of autophagy related proteins LC3 and P62
由于LC3抗体对LC3-II有更高的亲和力,容易造成假阳性,因此为了更加客观地评判自噬水平的高低,本实验采用LC3-GFP融合蛋白转染来示踪自噬体形成。激光共聚焦显微镜下显示A组平均每个细胞中绿色荧光斑点数目明显小于B组,差异具有统计学意义(P<0.05),见图2。
综上,初步判断老年骨质疏松BMSCs中的基础自噬水平较年轻正常BMSCs中明显降低。
2.2 老年骨质疏松BMSCs成骨分化能力减弱
为了探究BMSCs的自噬水平是否与成骨能力相关,探讨比较老年骨质疏松患者和正常年轻患者BMSCs的成骨分化能力。图3显示在成骨诱导分化3周后,A、B两组茜素红染色均显示红染钙结节,但钙化结节数A组明显少于B组;碱性磷酸酶染色结果相似,两组均有碱性磷酸酶染色阳性细胞,但A组阳性细胞数及染色阳性程度均弱于B组。
为了更加定量比较两者成骨分化差异,采用荧光定量PCR检测主要成骨相关蛋白的mRNA表达。结果显示I型胶原、骨钙素、骨桥蛋白、RUNX2等4个主要指标的mRNA在A组均明显少于B组,差异具有统计学意义(P<0.05),见图4。
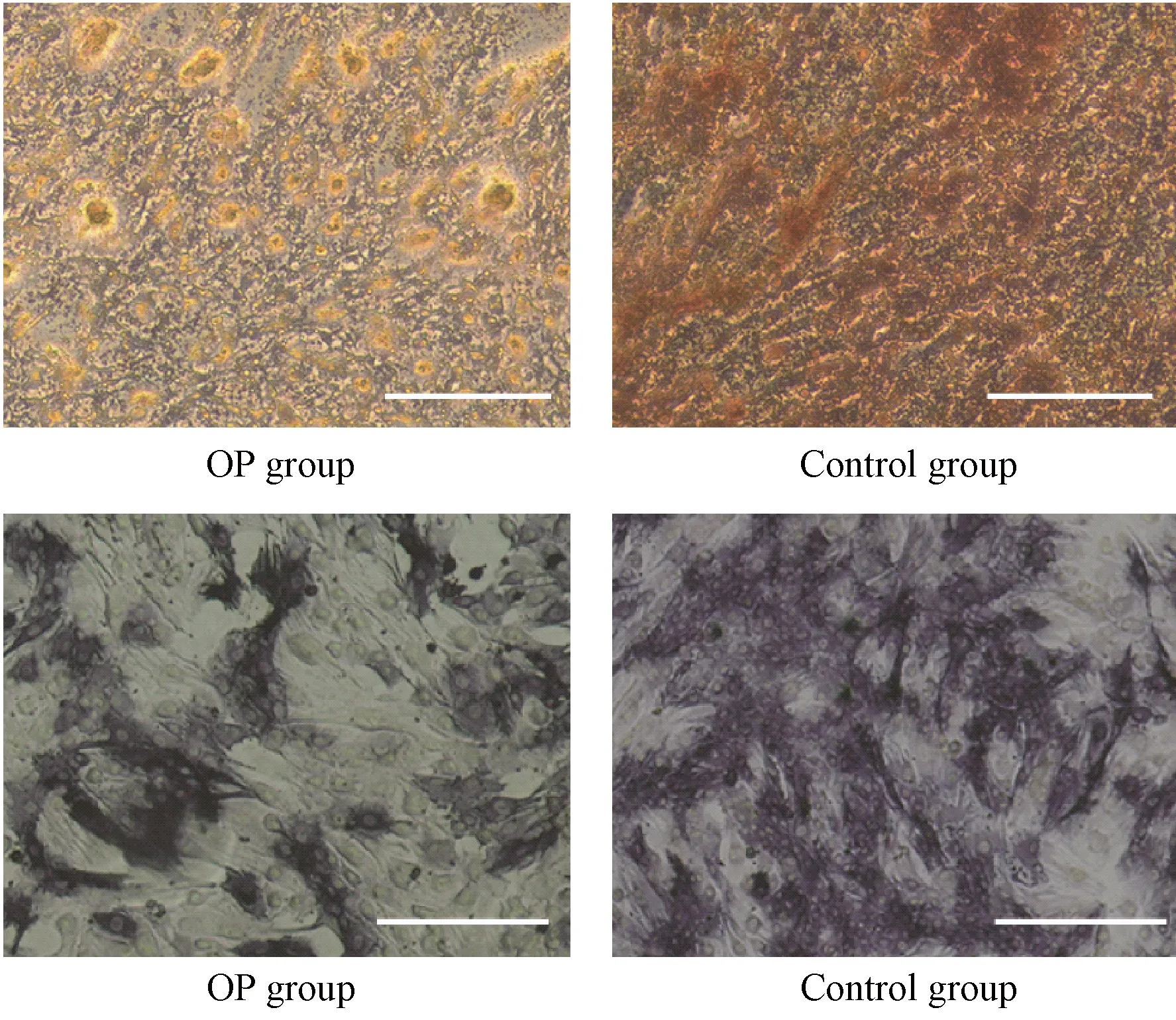
图3 不同组别成骨诱导培养基刺激3周后的染色结果。A:茜素红染色,B:碱性磷酸酶染色Fig.3 Results of staining after 3 weeks of osteogenic induction medium stimulation in different groups. A: Alizarin red staining, B: Alkaline phosphatase staining.

图4 荧光定量PCR检测成骨相关基因I型胶原、骨钙素、骨桥蛋白、RUNX2等Mrna表达Fig.4 Detection of Mrna expression of osteogenic related genes including collagen type I, osteocalcin, osteopontin and RUNX2 by fluorescence quantitative PCR
上述研究结果表明老年骨质疏松BMSCs成骨诱导分化能力较弱,显示了在BMSCs中较低的自噬水平表现出较弱的成骨分化能力。
3 讨论
成骨能力降低是导致老年性OP的主要病因,但如何提高老年患者的成骨分化能力目前仍是一个研究热点[9]。BMSCs作为一种具有多向分化潜能的前体细胞,相对其他组织干细胞而言,具有取材丰富,提取简便的优势。
自噬是细胞适应外界应激的主动生理调控机制,近年来自噬在骨形成中的作用才逐渐被发现[10]。Nuschke等[11]研究表明在成骨分化的早期,人间充质干细胞内的自噬水平会明显提高,而当分化为成熟骨细胞后自噬又会明显下降,提示自噬在成骨分中扮演了重要作用。更进一步的研究表明,自噬可以通过调控NF-κB[12]和TNFSF11/RANKL[13]两条信号通路,促进成骨分化、提高矿化能力,从而有利于骨形成。而在体内研究中同样发现桡骨远端的骨密度与自噬水平密切相关[14]。但国内有研究表明当上调BMSCs自噬活性后,其向成骨分化的潜力减弱[7]。由此可见,当前自噬与成骨分化的关系并不明确,分析其原因可能与所选用种子细胞的差异,以及成骨分化的同阶段有关,所以本实验的目的是通过比较骨质疏松和正常对照的原代BMSCs自噬和成骨分化能力,初步判断在BMSCs中自噬与成骨能力间的关系。
本实验结果无论是Western blot还是激光共聚焦观察均显示OP组中的BMSCs自噬水平显著低于正常对照组,而通过组织学染色比较以及荧光定量PCR结果则提示OP组的成骨分化能力同样较弱。这些结果均提示在BMSCs自噬水平似乎与成骨分化能力呈正相关。
本实验研究同样存在一些局限性,首先该研究只是一个观察性研究,自噬对成骨分化的影响需要进一步验证;其次在所检测的几个成骨指标中,I型胶原属于早期成骨指标,骨钙素属于中期成骨指标,而骨桥蛋白属于晚期成骨指标[15],在以后的实验中可以通过不同时间的成骨诱导,比较不同的成骨指标,使实验结果更为客观、可靠。
