含两种溶质的混合溶液中物料守恒式的简单书写
2018-12-17
(湖南大学附属中学 湖南长沙 410083)
盐类水解的三个守恒式分别是电荷守恒、物料守恒和质子守恒[1]。电荷守恒式相对来说是比较容易书写的,不管是单一溶质的溶液还是混合溶质的溶液,只需找出溶液中可能存在的离子,然后结合溶液的电中性原则,将阳离子和阴离子在“=”两边分别书写,且离子所带电荷数就是该离子浓度符号前的系数。比如单一溶质的氯化铵溶液和混合溶质的盐酸与氯化铵溶液或者氨水与氯化铵溶液中的电荷守恒式的表达式均为:[1]
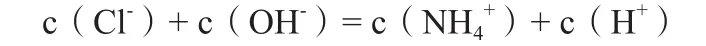
又如Na2CO3溶液和NaHCO3溶液,由于两溶液中离子种类是相同的,分别为Na+、OH-这五种离子,故两溶液的电荷守恒式的表达式是相同的,均为:

当然单一溶质溶液的物料守恒式的正确书写的关键在于找准溶质化学式中非氢离子和非氢氧根离子的其他元素的数学关系,体现在物料守恒式中的关系就是相应的倍数关系。[2]
如Na2CO3中的n(Na)∶n(C)=2:1,即c(Na+)为所有含C粒子浓度之和的2倍,故Na2CO3溶液的物料守恒式的正确书写应为:

而NaHCO3中的n(Na)∶n(C)=1:1,即c(Na+)为所有含C粒子浓度之和的1倍,故NaHCO3溶液的物料守恒式的正确书写应为:
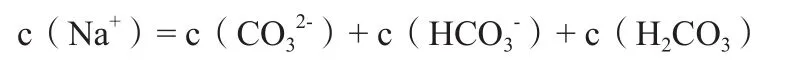
由于质子守恒式体现的是水电离出的c水(H+)= c水(OH-),考虑到强酸的阳离子(或强碱的阴离子)不会结合水电离出的OH-(或H+)。则盐类水解中的质子守恒式为电荷守恒式与物料守恒式的四则运算关系抵消掉强酸的阳离子(或强碱的阴离子)即可。
综上所述,我们不难发现,要解决好盐类水解的三个守恒式的正确书写,其成败的关键在于正确书写盐类水解的物料守恒式。然而,如果碰到同时含两种溶质的混合溶液时,该反应的物料守恒式又该如何正确书写呢?比如如何书写等体积、等浓度的Na2CO3溶液和NaHCO3溶液混合后的溶液中物料守恒式?
要想解决上述的问题,让我们先来看看下面这道题;
往10 mL 0.2 mol/L 的氨水中逐滴滴加等浓度的盐酸,求当加入盐酸的体积分别为5 mL和20 mL时,所得溶液的三个守恒式的书写。
我们不难发现,当将盐酸加入到氨水中时,在溶液中必定会发生盐酸和氨水的酸碱中和反应。当所加盐酸体积为5 mL时,我们可以发现,此时溶液中氨水是过量的。
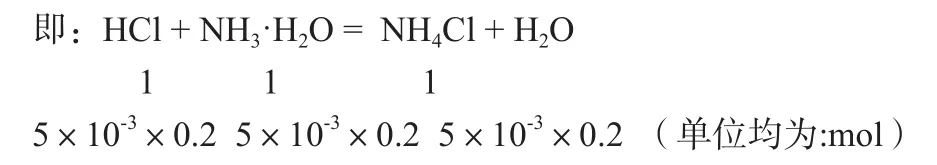
此时溶液中剩余n(NH3·H2O) = 10×10-3×0.2-5×10-3×0.2=5×10-3×0.2(mol)
反应生成的n(NH4Cl) =5×10-3×0.2(mol)
即此溶液为含等浓度等体积的NH3·H2O和NH4Cl的混合溶液,按照常规思维的方式来书写三个守恒式中的物料守恒非常的繁琐,其过程中既要考虑NH3·H2O的电离反应,又要考虑NH4Cl中的水解反应,在判断电离反应和水解反应谁为主要,然后才能书写出这混合溶液的物料守恒式。
同理有:当所加盐酸体积为20 mL时,我们可以发现,此时溶液中盐酸过量。
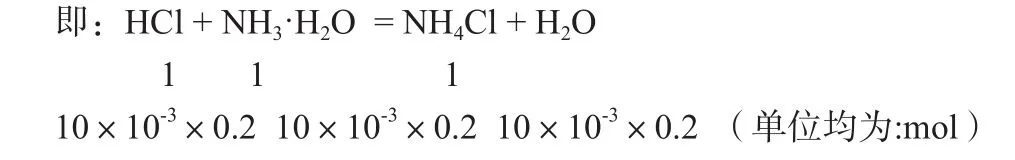
此时溶液中剩余n(HCl) = 20×10-3×0.2-10×10-3×0.2=10×10-3×0.2(mol)
反应生成的n(NH4Cl) =10×10-3×0.2(mol)
即此溶液为含等浓度等体积的HCl和NH4Cl的混合溶液,同样的将上述HCl和NH4Cl的混合溶液再运用化繁为简的思想,看成是由HCl和NH4Cl的单一溶质溶液[2]。由此我们同样可以快速、高效的写出该混合溶液中的物料守恒式。

也许有人会问了,笔者这里所例举的都是混合溶质物质的量之比为1:1的实例,如果碰到不是1:1的情况又该怎么解决呢?这个问题很好回答,那就按比例来组合,比如2 mol Na2CO3与1mol NaHCO3的组合,则视为溶质为Na5H(CO3)3的单一溶液;1 mol Na2CO3与2mol NaHCO3的组合,则视为溶质为Na4H2(CO3)3的单一溶液,如果是其他比例,就依葫芦画瓢,照此类推……。
