VEGF-B与低氧诱导大鼠视网膜新生血管的相关性※
2018-12-17赵高宇马金兰张瑞霞
赵高宇,马金兰,张瑞霞
(1.青海大学研究生院;2.青海大学附属医院眼科;3.青海大学附属医院内分泌科)
视网膜血管性疾病的发病基础为新生血管发生导致的视网膜缺血、血管内皮细胞渗漏等病理改变[1],新生血管的发生对眼部结构和功能造成的损害是引起视力障碍的重要原因。视网膜新生血管的发展必须依赖缺氧诱导的血管内皮生长因子(vascular endothelial growth factor,VEGF),这是视网膜新生血管形成的一个主要因素。VEGF家族属于血小板源性生长因子(The platelet-derived growth factor,PDGF)超家族,目前由六个不同的成员组成,即VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E 和胎盘生长因子(placental growth factor,PLGF),VEGF-A在 VEGF家族中所占比例最高[2]。现已明确VEGF-A在视网膜新生血管的形成中的作用机制,但是VEGF-B对血管生成的影响研究一直有争论。本研究应用一种新的视网膜新生血管成模方法,即在模拟低氧环境下观察大鼠视网膜新生血管形成与否,同时观察视网膜VEGF-B的表达情况,综合探讨VEGF-B与低氧诱导大鼠视网膜新生血管的相关性。
1 材料与方法
1.1 实验动物及主要试剂
雄性SD大鼠体重190~250 g,购自南京青龙山动物繁殖场。兔抗VEGF-B多克隆抗体购自英国abcam公司;异硫氰酸荧光素标记的葡聚糖(Fluorescein-dextran,FITC-dextran)购自美国 Thermo公司;大鼠VEGF-B酶联免疫吸附测定法(ELISA)试剂盒购自中国DLDEVELOP公司;离心柱式组织RNA提取试剂盒、反转试剂盒及实时荧光定量PCR(Quantitative Real-time PCR,RT-PCR)相关试剂盒购自中国天根生化科技有限公司。
1.2 分组和模型
所有动物遵循视觉和眼科学研究学会(Association for Research in Vision and Ophthalmology,ARVO)关于眼科动物的处理规定,购回后在青海大学高原医学研究中心饲养,大鼠分为四组:低氧空白组、低氧药物组、低氧药物对照组和常氧对照组,每组12只。低氧处理大鼠置于青海大学医学院低压氧舱(中航工业风雷公司,模拟海拔高度5 000 m,大气压力50±2kPa,氧气含量21±1%)。低氧药物组大鼠在进舱前一天在玻璃体腔注射兔抗VEGF-B多克隆抗体[0.2%(W/V),50μg/kg];低氧药物对照组大鼠玻璃体腔注射同等体积的溶媒(50%PBS+50%甘油)。早晚各一次进舱添加饲料、水,常氧对照组大鼠在常氧恒温条件下饲养。大鼠进入低压氧舱时间为7 d,7 d后取出与常氧组一起麻醉(10%水合氯醛,0.3g/kg)后处死取材。
1.3 实验方法和检测指标
(1)视网膜 FITC-dextran铺片:将 FITC-dextran(2000KD,50g/L)溶于无菌生理盐水,离心(10000r/min,3min)后取上清备用,大鼠常规麻醉后固定,触及心尖对应体表位置,在此处垂直进针,感受到针尖搏动感再进针少许,回抽见血后将1 mL FITC-dextran注入左心室,观察0.5~1 h,发现大鼠口周、四肢末端及耳鼻等外表粘膜处变黄后处死大鼠,取右眼置于4%(W/V)多聚甲醛中固定1 h,沿角膜缘环形切开,剥离晶状体和玻璃体,分离视网膜感觉层和色素上皮层,将视网膜感觉层于PBS缓冲液中轻轻漂洗后取出置于载玻片上,穿刺刀沿视网膜中心向外缘放射状切开,甘油封片,置于荧光显微镜下观察,并标记无血管区及新生血管区;
(2)ELISA法测大鼠玻璃体VEGF-B蛋白含量:大鼠常规麻醉后处死,取双侧眼球沿角膜缘环形切开,剥离晶状体,缓慢收集玻璃体于EP管中,离心(2500r/min,10min)后取上清冻存于-80℃冰箱备用,用ELISA法测玻璃体VEGF-B蛋白含量;
(3)RT-qPCR法测视网膜VEGF-B mRNA的表达水平:分离视网膜感觉层和色素上皮层,将双侧视网膜感觉层放入无菌PBS缓冲液中漂洗后取出,视网膜放入含500μL裂解液的EP管中,剧烈震荡直至完全溶解,离心(12000r/min,5min)后取上清进行视网膜组织总RNA提取,反转录合成第一链cDNA;检索Genbank获得vegf-b和β-actin的核酸序列,在线设计vegf-b特异引物以及内参β-actin的特异引物(http://www.idtdna.com/scitools/Applications/Real-TimePCR/),vegf-b 上游引物序列:GCAACACCAAGTCCGAATG,下游引物序列:CTTCACAG-CACTCTCCTTTCT,扩增产物片段长 124 bp;β-actin上游引物序列:CACTTTCTACAATGAGCTGCG,下游引物序列:CTGGATGGCTACGTACATGG,扩增产物片段长148 bp,引物均由中国华大基因研究院合成。将引物与cDNA加入反应体系中进行实时荧光定量PCR,测得目的基因以及内参基因的Ct值,采用比较Ct法进行相对定量结果分析。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件进行,统计结果以均数±标准差(珋x±s)表示,四组数据的统计分析采用单因素方差分析法;P<0.05为差异有统计学意义。
2 结果
2.1 低氧诱导视网膜新生血管大鼠模型的建立
为探讨VEGF-B在视网膜新生血管形成中的作用,设计了模拟低压低氧条件下7 d诱导视网膜新生血管大鼠模型,在模型中检测了视网膜VEGF-B mRNA的表达和玻璃体VEGF-B蛋白水平的变化。在这个模型中,视网膜新生血管在7 d低氧空白组和低氧药物对照组最明显。常氧对照组(图1A)显示了FITC-dextran灌注的正常视网膜血管形态,低氧空白组(图1B)和低氧药物对照组(图1C)显示了低氧不给药以及药物对照情况下视网膜血管形态,低氧给药组(图1D)则显示了低氧下给予抗VEGF-B抗体后视网膜血管形态。图1B和图1C中视网膜中央血管的部分丢失并出现新生血管丛,可见血管周围荧光素渗漏,而图1D上述情况有所减轻。

A为常氧对照组;B为单纯低氧条件下7d后视网膜铺片结果;C为低氧同时给予溶媒作为低氧药物对照组的视网膜铺片结果;D为低氧条件下同时给予玻璃体注射抗VEGF-B抗体干预处理后的视网膜铺片结果.A显示了正常视网膜血管形态,B和C显示了视网膜中央血管的部分丢失(白线圈的不规则区域)和新生血管丛(箭头所指),并可见血管周围荧光素渗漏,而D显示上述情况较B、C有所减轻.Figure 1 Observation of FITC-dextran perfusion of the retina under the fluorescence microscope
2.2 抗VEGF-B抗体影响视网膜VEGF-B mRNA的表达
VEGF蛋白家族属于分泌型蛋白,视网膜感觉层细胞表达VEGF-B并可通过旁分泌至玻璃体中,检测玻璃体VEGF-B的含量,可间接反映视网膜VEGF-B mRNA的表达情况。各组大鼠眼球提取玻璃体使用ELISA检测VEGF-B蛋白含量。表1显示,低氧空白组和低氧药物对照组玻璃体VEGF-B蛋白浓度分别为 24.84±4.26 pg/mL 和 24.83±5.54 pg/mL,均高于常氧组(17.80±3.58pg/mL)和低氧药物组(19.78±2.82pg/mL)(P<0.05);RT-qPCR 检测视网膜感觉层VEGF-B的mRNA水平显示,玻璃体注射抗VEGF-B抗体处理可抑制VEGF-B mRNA的表达。这些结果表明,抗VEGF-B抗体处理后可降低视网膜VEGF-B mRNA的表达。
Table 1 Determination of VEGF-B protein content in the vitreous cavity and expression of VEGF-B mRNA in the retina of four groups of rats(±s)
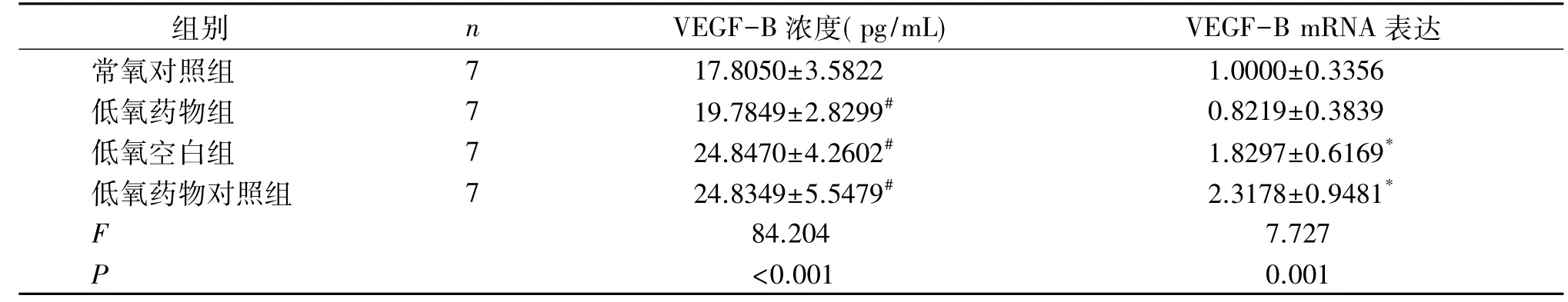
Table 1 Determination of VEGF-B protein content in the vitreous cavity and expression of VEGF-B mRNA in the retina of four groups of rats(±s)
*:P<0.05;#:P<0.01 V.S.常氧对照组.
组别 n VEGF-B浓度(pg/mL) VEGF-B mRNA表达常氧对照组 7 17.8050±3.5822 1.0000±0.3356低氧药物组 7 19.7849±2.8299# 0.8219±0.3839低氧空白组 7 24.8470±4.2602# 1.8297±0.6169*低氧药物对照组 7 24.8349±5.5479# 2.3178±0.9481*F 84.204 7.727 P<0.001 0.001
3 讨论
视网膜血管性疾病,包括年龄相关黄斑变性(age-related macular degeneration,AMD)、糖尿病视网膜病变(diabetic retinopathy,DR)、早产儿视网膜病变(retinopathy of prematurity,ROP)和缺血性视网膜静脉阻塞(retinal vein occlusion,RVO),视网膜新生血管发生发展的过程非常复杂,包括有巨噬细胞、血管内皮细胞、色素上皮细胞等炎性细胞的多种细胞和血管生成因子、血管生成抑制因子等多种细胞因子参与,构成一个复杂的互相作用网络,最终对视力造成严重损害。
以往在考察视网膜新生血管的形成以及研发抗血管生成药物时,将不同的动物视网膜新生血管造模方法用于研究临床不同类型的视网膜血管性疾病,如高氧诱导视网膜新生血管病变的动物模型主要用于研究临床ROP的发病机制及治疗[3]。高氧诱导动物视网膜病变常用于研究视网膜新生血管[4],但是观察早产小鼠氧诱导视网膜病变可能不足以代表临床眼科所有类型的视网膜新生血管,尤其是在青少年以及成年患者。因此,探寻非早产动物且与临床眼科各类型视网膜新生血管疾病特征符合的视网膜新生血管造模方法,对于研究此类疾病发病机制及其他领域有着重要作用。
视网膜新生血管形成依赖于缺氧诱导的血管内皮生长因子[5]。缺氧在视网膜新生血管性疾病发病机制中起了关键的作用,临床上视网膜新生血管的形成多数是在血管阻塞性疾病引起的视网膜缺血缺氧后发生,而在动物视网膜血管阻塞造模过程中,有成功率低、操作较复杂等缺点。高原环境较平原有其独特的特点,低压、低氧是许多高原特有疾病发病机理的病理生理学基础。大脑和视网膜等结构富含神经元组织,其对缺氧极其敏感,急进高原后由于急性缺氧可导致高海拔视网膜病变(high altitude retinopathy,HAR),其特征为视网膜血管迂曲、视网膜出血、渗出及水肿,严重影响视觉功能[6]。有研究[7]发现,处在急性低压低氧环境下6 h的动物心肌和大脑组织有着明显的缺氧后病理改变,表现为心肌细胞和神经元细胞的肿胀、空泡化,以及组织血管扩张等。黄海香[8]等研究发现,模拟高海拔低氧环境,大鼠在较短时间(6h)内即可出现视网膜组织水肿、层次结构紊乱以及神经节细胞肿胀变形,部分细胞出现核固缩、溶解等病理形态改变,视网膜血管出现扩张、浅层血管出血等征象,且海拔越高视网膜组织损伤越严重,可能与上调HIF-1α和p53的表达有关。既往研究报道[9],在我国高海拔地区(西宁),糖尿病视网膜病变发生率高于平原地区。基于上述研究结果,在高海拔低氧低气压条件下,视网膜组织可出现典型的缺氧后病理改变。本研究为探究低压低氧环境下动物视网膜新生血管生成与否,且为了观察视网膜血管更明显的缺氧后改变,设计将模拟超高海拔(5000m)环境的时间延长为7 d,缺氧诱导6~7 w大鼠视网膜新生血管形成,使用FITC-dextran灌注视网膜血管造影观察视网膜新生血管情况。本研究结果显示,低压低氧条件下,大鼠视网膜中央血管部分丢失和出现新生血管丛,并可见荧光素的渗漏,这与以往报道的研究结果类似。但此方法造模的大鼠视网膜新生血管的数量,以及血管的丢失不如高氧诱导新生大鼠视网膜病变明显,考虑与大鼠视网膜血管系统已成型有关。在低压低氧的诱导因素下,其形成的视网膜病变特征与临床上部分成人视网膜血管性疾病的病变特征更加接近。
VEGF最主要的作用是促进动脉、静脉以及淋巴内皮细胞有丝分裂。除此以外,VEGF还有增加内皮细胞渗透性、迁移性的作用[10]。现已明确VEGF-A在视网膜新生血管的形成中的作用机制,但是对于VEGF-B的研究一直有争论。VEGF-B主要在心脏、中枢神经系统(central nervous system,CNS)和棕色脂肪组织(brown adipose tissue,BAT)表达[11]。VEGF-B的作用似乎是多方面的,一些研究表明 VEGF-B 能够抑制新生血管形成[12-15]。在退行性条件下,对不同类型的血管细胞抑制其凋亡(内皮细胞、周细胞及平滑肌细胞),缓解血管变性,而在高水平的促血管生成生长因子环境中VEGF-B作为抑制因子存在,确保均衡的血管密度和组织生长[14,15]。Huang D 等研究发现,VEGF-B 可以抑制高血糖和哌加他尼诱导的视网膜细胞的凋亡[16]。然而也有一些研究有着相反的结论,认为VEGF-B会促进视网膜血管生成以及增加VEGF-A的生物利用度[17,18]。我们的研究结果是低氧组大鼠视网膜VEGF-B mRNA的表达高于常氧对照组,且玻璃体VEGF-B的含量在各组中的变化趋势与其相似。而在低氧环境下玻璃体腔注射抗VEGF-B抗体组大鼠视网膜VEGF-B mRNA的表达低于其他低氧组,与正常对照组相近,其视网膜铺片结果显示新生血管以及中央血管的丢失情况也较其他低氧组减轻。故我们推测在低压低氧条件下,视网膜组织上调缺氧诱导因子等缺氧相关因子,通过缺氧相关通路上调视网膜VEGF-B的表达,进而促进新生血管的形成。通过给予抗VEGF-B抗体干预处理后,大鼠视网膜新生血管情况较低氧组减轻,且视网膜VEGF-B mRNA的表达也较其他低氧组降低,说明VEGF-B在低氧诱导大鼠新生血管的生成以及调控视网膜VEGF-B mRNA的表达水平起了很重要的作用。
综上所述,VEGF-B在低氧诱导视网膜新生血管形成过程中发挥了促进作用,而经抗VEGF-B抗体干预后可有效抑制这一作用。
