持续性低氧大鼠肝脏HIF-2α信号通路变化及对血糖的影响※
2018-12-14龚俊艳赵成玉
龚俊艳,赵成玉
(1.青海大学研究生院,西宁 810016;2.青海大学附属医院老年病科,西宁 810001)
大量的研究认为,高海拔居民的血糖水平及2型糖尿病的患病率低于海平面居民[1-2]。本研究拟通过对比常氧和低氧条件下大鼠血糖的变化,探讨其可能的作用机制,为高原糖代谢异常患者的治疗提供思路。
1 材料与方法
1.1 实验材料
50%葡萄糖注射液购于湖南科伦制药有限公司,HIF-2α(ab199)购于Abcam公司,Akt(#9272)、P-Akt(#4060,Ser473)、Gsk-3β(#9315)、P-Gsk-3β(#9322,Ser9)购于Cell Signaling Technology公司,beta Actin(20536-1-AP)和抗兔辣根过氧化物酶抗体(SA00001-2)购于proteintech公司。BCA蛋白浓度测定试剂盒和高效RIPA裂解液、Cocktail蛋白酶抑制剂、磷酸酶抑制剂、2x蛋白上样缓冲液购于北京索莱宝公司。RNA提取试剂盒、RNA反转录试剂盒及RNA定量试剂盒均购于TAKARA公司。血糖试纸条及血糖仪购于强生公司。
32只6~8 w雄性Wistar大鼠(200~220g)购于湖北省疾病预防控制中心[许可证号:SCXK(鄂)2015-0018]。饲养条件:普食,自由饮水,温度22 ℃,湿度45%~75%。
1.2 研究方法
1.2.1 实验分组:32只雄性Wistar大鼠随机分为常氧组(n=16)和低氧组(n=16),常氧组在海拔200 m左右的常氧环境下饲养,低氧组在模拟海拔5 000 m的低压氧舱中饲养。在实验的第1 w和4 w各取8只,禁食12 h后(不禁水)行经腹腔注射葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT),评估大鼠糖耐量状态。于次日晨,麻醉处死大鼠,留取肝脏进行Western Blot检测,分析HIF-2α、Akt、P-Akt、Gsk-3β、P-Gsk-3β变化,同时进行qRT-PCR检测,分析PEPCK、G6PC mRNA的变化。
1.2.2 大鼠空腹血糖及糖耐量评估:在实验的第1 w和4 w各取8只,禁食12 h后(不禁水),断尾取血测空腹血糖(A),继而经腹腔注射50%葡萄糖(2g葡萄糖/kg体重)[3],于注射葡萄糖后15 min、30 min(B)、60 min(C)、120 min(D)经大鼠尾静脉采用强生稳豪型血糖仪测血糖,用于评估大鼠糖耐量状态。计算IPGTT血糖曲线下面积(Areas under the curve of glucose,AUCG),AUCG(mmol/h·L)=1/4A+1/2B+3/4C+1/2D[3]。

1.2.4 qRT-PCR法检测肝脏中糖异生相关酶的表达:按照试剂盒所示方法从肝脏组织中提取总RNA,并以此为模板反转录为cDNA,应用Primer5.0软件设计各基因特异引物。引物序列:
G6PC 上游引物5′-AACGTCTGTCTGTCCCGGATCTA -3 ′,
下游引物5′-CCTCTGGAGGCTGGCATTGTA-3′;
PEPCK上游引物5′-CAGCCAATGTCCCATTATTGACC-3′,
下游引物5′-TGCCAGCTGAGAGCTTCGTAGA-3′;
β-actin上游引物5′- GGAGATTACTGCCCTGGCTCCTA-3′,
下游引物5′-GACTCATCGTACTCCTGCTTGCTG -3′。
以上引物均由TAKARA公司合成。按照实时荧光定量PCR试剂盒所示说明书,检测各组G6PC mRNA、PEPCK mRNA的表达情况。PCR反应体系为25 μL,反应条件:SYBR Premix Ex Taq II(Tli RNaseH Plus)(2×)12.5 μL,Primer F 1 μL,Primer R 1 μL,cDNA 2 μL,dH2O 8.5 μL。
95 ℃ 30 sec,95 ℃ 5 sec、60 ℃ 30 sec(40个循环)。每个样本做3个重复孔。各组检测结果采用2-△△Ct法分析。
1.3 统计学方法
2 结果
2.1 大鼠体重、空腹血糖及糖耐量评估
常氧组和低氧组大鼠随着饲养时间的延长,大鼠体重增加,但是低氧组大鼠体重增加明显少于常氧组(P<0.001,表1)。常氧组大鼠随着饲养时间的延长血糖逐渐升高,但没有统计学差异(P>0.05,表1);而低氧组大鼠随着低氧时间的延长空腹血糖明显降低(P<0.001,表2)和IPGTT血糖曲线下面积明显减少(P<0.001,表1和表2)。与常氧组相比,低氧1 w和4 w大鼠IPGTT血糖曲线下面积明显小于同期常氧组(P<0.001,表1)。

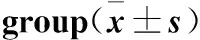
Table 1 Comparison of Weight and AUCG between the normoxia and hypoxia
※:样本量=8

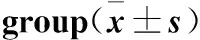
Table 2 Comparison of Fasting Blood Glucose between the normoxia and hypoxia
2.2 Western Blot法检测肝脏相关蛋白的表达
与常氧组相比,低氧组大鼠HIF-2α蛋白表达量明显升高(P<0.05,图1和表3),且随着低氧时间的延长逐渐升高(P<0.05,图1和表3) 。与常氧组相比,Akt、Gsk-3β、P-Akt和P-Gsk-3β蛋白表达量无明显差异(P>0.05,图2和表4)。


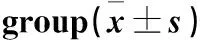

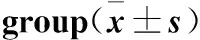
Table 3 Comparison of HIF-2α protein expression between the normoxia and hypoxia






组别例数P-Akt/Akt1 w4 wP-Gsk-3β/Gsk-3β1 w4 w常氧30.576±0.0230.564±0.0260.740±0.0290.705±0.040低氧30.601±0.0320.524±0.0230.738±0.0150.680±0.060t -1.106 1.932 0.117 0.590P 0.331 0.126 0.912 0.587
2.3 qRT-PCR法检测大鼠PEPCK mRNA和G6PC mRNA表达
与常氧1 w比较,常氧4 w大鼠PEPCK mRNA和G6PC mRNA表达量明显增加(P<0.05,表5);与低氧1 w比较,低氧4 w PEPCK mRNA、G6PC mRNA表达量明显降低(P<0.05,表5)。与常氧1 w比较,低氧组1 w PEPCK mRNA无差异(P>0.05,表5)、G6PC mRNA表达减少(P<0.05,表5);与常氧4 w比较,低氧4 w PEPCK mRNA、G6PC mRNA表达量明显减少(P<0.05,表5)。

Table 5 Comparison of G6PC mRNA and PEPCK mRNA between the normoxia and hypoxia
3 讨论
本研究结果显示,相比于常氧组大鼠,低氧组大鼠空腹血糖及IPGTT血糖曲线下面积明显减少,与文献报道的研究结果一致[1-2]。研究发现,低氧可增强细胞内葡萄糖摄取、糖酵解,同时增加与HIF-1表达相关的糖原合成[4],减少与HIF-2的表达增加有关的肝脏糖异生[5]。
人类对于高原低氧环境的适应有一定的遗传基础,其中HIFs是多细胞动物对低氧应激的主要转录调节因子[6]。HIFs包括HIF-1与HIF-2,均由一个不同的α亚单位和相同的β亚单位构成的异源二聚体,其中α亚单位是功能亚单位,β亚单位是结构亚单位,但是它们的功能并不完全相同。HIF-1α主要参与急性低氧反应的应答,而HIF-2α主要在慢性低氧中发挥作用[7]。HIF-1α在能量调节和葡萄糖稳态中的作用已得到深入的研究,然而,对于HIF-2α对血糖的影响研究较少,目前研究发现HIF-2α在内皮细胞、肝细胞、胰腺间质细胞、肾成纤维细胞及心肌细胞中都有表达[8]。研究发现通过基因沉默的方法抑制脯氨酸羟化酶的活性,使HIF-2α的表达增加,使大鼠血糖下降[9-10]。肝脏HIF-2α的激活,通过直接和间接作用诱导IRS-2表达,增强胰岛素的信号[11],促进糖原合成,抑制糖异生,降低血糖。
我们的研究结果显示,与常氧组比较,低氧组大鼠HIF-2α蛋白表达量明显升高,这与Taniguchi等的研究结果一致[9-10],说明低氧促进HIF-2α蛋白的表达。HIF-2α参与机体葡萄糖代谢的机制,目前认为是低氧触发肝脏HIF-2α/IRS-2轴,通过直接和间接作用诱导IRS-2,依次激活Akt、FOXO1、Gsk-3β和mTOR[9],放大肝脏胰岛素信号通路[12]。但是我们的研究发现,P-Akt/Akt比值在两组之间无统计学差异,这与Gamboa研究结果一致[1],但与Wei 等研究结果相反[9-10,13],这可能与基础情况下Akt并未被激活有关。Gamboa的研究提示在胰岛素刺激条件下,低氧组P-Akt比值显著高于常氧组[1]。Akt是一种丝氨酸/酪氨酸激酶,需要胰岛素刺激胰岛素受体底物蛋白在胰岛素受体部位聚集才能被激活[11]。我们主要是在基础水平研究了Akt的活化状态,而没有在胰岛素刺激条件下进行研究,这可能是P-Akt/Akt比值在两组之间无统计学差异的原因。Akt重要的底物有Gsk-3β和FOXO1[14]。Gsk-3β通过使糖原合成酶磷酸化而抑制其活性,导致糖原合成减少。因此,Akt能通过磷酸化抑制Gsk-3β的活性,增加糖原合成酶的活性,促进细胞摄取葡萄糖并合成糖原,降低血糖[14]。P-Gsk-3β/Gsk-3β比值在两组之间无明显统计学差异,可能在低氧环境下大鼠肝脏对血糖的调节过程中糖原合成途径不占据主导地位。FOXO1 作为胰岛素信号通路的一个靶分子,被Akt磷酸化后出核失活,从而解除其对糖异生基因G6PC及PEPCK的转录调控作用,抑制肝脏的葡萄糖异生,从而降低血糖。我们对肝脏糖异生关键酶的表达进行了测定,与常氧组相比,低氧组大鼠G6PC mRNA表达量1 w和4 w都是明显降低的(P<0.05),PEPCK mRNA表达量于4 w时明显降低,这与Dera的研究结果一致[13],PEPCK和G6PC都是糖异生的限速酶,二者表达量降低,说明糖异生过程受到抑制,血糖生成减少。
我们的研究尚存在不足,首先我们只研究了基础条件下Akt、Gsk-3β的活化状态,而没有研究胰岛素刺激条件下的变化;其次我们没有检测糖原合成酶及糖原含量的变化,故无法说明低氧条件下,HIF-2α到底是主要通过抑制糖异生还是通过抑制糖原合成途径而使机体血糖降低。
综上所述,我们的研究最主要的发现是,低氧条件下大鼠血糖是降低的,HIF-2α蛋白表达量是升高的,并与低氧时间相关,在低氧第4 w时糖异生关键酶G6PC和PEPCK mRNA明显降低,可能是通过抑制糖异生途径使机体血糖降低。
