常氧及缺氧培养对成骨细胞hFOB1.19增殖的影响
2018-12-13陈巧凤施建辉
陈巧凤,施建辉 ,闻 博
福建医科大学附属泉州第一医院骨科,福建 泉州 362000
骨折引起的急性血液供应中断会导致骨组织中的氧张力(pO2)降低[1],机体就会产生大量的氧自由基(ROS),对机体造成伤害。氧化应激会导致细胞功能紊乱甚至死亡,与机体衰老、肿瘤、代谢异常都有密切关系;骨折或肢体血运受阻后,成骨细胞会出现大量的ROS,其代谢、增殖受到明显影响,骨基质、成骨蛋白生长受到抑制,骨折修复减少[2-3],骨折的延迟愈合和不愈合率明显增高[4]。缺氧除了对骨折愈合产生影响,还减少成骨细胞生长,导致骨质疏松[5]。
在缺氧对成骨细胞影响的大量实验研究中,可以看出缺氧主要对成骨细胞增殖、分化及成骨特异性基因及蛋白的表达产生了负面影响[6-8]。研究提示持续12 h低氧会抑制了Runx2下游靶基因的表达,不利于成骨细胞的生长。此外,当氧浓度过低时(<1%O2)也不利于成骨细胞的生成,成骨细胞在低氧条件下(1% O2)培养36 h后,成骨细胞增殖细胞核抗原(PCNA)的表达明显下降[9]。已知缺氧时间的长短与机体破坏程度有密切关系,持续的缺氧可能造成机体不可逆转的损伤。但,目前少有实验对成骨细胞急性持续缺氧条件下增殖,凋亡的观察研究。
韩桂秋等[10]发现缺氧严重影响成骨细胞的成长周期,但其仅检测36 h这1个时间点,无从知道成骨细胞在缺氧的不同时间点的变化情况。有研究[11]描述成骨细胞在缺氧环境(1%O2)培养48 h,TNF-α明显升高,但并没有在持续缺氧环境下成骨细胞成长情况或凋亡情况的记录。还有实验将MC3T3-E1细胞置于37 ℃,厌氧瓶中与氧吸收包一起温育,O2在0.5 h内降低至小于0.1%[12]。但这样处理可能会造成细胞生长氧环境的不稳定,因此本实验将成骨细胞置于厌氧培养箱的垣定环境培养,以期能比较客观地观察成骨细胞在急性持续缺氧条件下变化情况。本研究分别把hfob1.19放置于含1%O2厌氧培养箱及20%O2常氧箱内培养24、48、72、96、120 h,研究在持续缺氧条件下的细胞内ROS产生以及细胞增殖、凋亡情况,并对比各个时间节点的变化,以便发现成骨细胞在急性缺氧条件下代谢变化规律。
1 材料与方法
1.1 细胞来源
成骨细胞hfob1.19购于吉妮欧生物有限公司。
1.2 主要试剂及耗材
RPMI-1640:SH30809.01 B/500 mL(Hyclone,美国);胎牛血清:SV30087.03/500 mL(Hyclone,美国);双抗:SV30010/100 mL(Hyclone,美国);胰酶:SH30042.01/100 mL(Hyclone,美国);PBS:SN331(南京生兴生物技术有限公司,中国);DMSO:C6295-50ML(Sigma,美国);MTT:5 g(Bisharp,中国);PIAnnexinV-FITC细胞凋亡检测试剂盒:EMS500FI/300T(eBioscience,中国);活性氧检测试剂盒(DCFHDA):S0033(上海碧云天生物技术有限公司)。
1.3 主要仪器和设备
CO2细胞孵育箱(Thermo,美国);厌氧培养箱(Thermo,美国);美国多功能酶标仪(SpectraMax M5,MD,美国);流式细胞仪:FACSCaliburBD (Biosciences,美国);高速离心机(Thermo,美国);荧光分光光度计(上海棱光,中国)。
1.4 细胞培养
(1)hfob1.19细胞是贴壁细胞,培养在1640培养基中,含15%胎牛血清,100 U/mL的青霉素,100 μg/mL的链霉素。培养在34 ℃,含5%CO2的细胞培养箱中。(2)当hfob1.19细胞长至80%~90%时,去除培养基,加入PBS洗1~2次,去除PBS后,加入1 mL胰酶消化1~3 min后,加入3 mL完全培养基中和胰酶终止消化,将消化的细胞转移至15 mL离心管中,1000 r/min离心5 min。倒掉上清后,加入3 mL培养基重悬细胞,1:3传代至培养皿中培养。(3)细胞的常氧与缺氧培养:将细胞用胰酶消化下之后,加入培养基重悬细胞,用血球计数板对细胞进行计数,六孔板每孔种2×106个细胞,将细胞摇晃均匀,放入培养箱中培养。培养过夜后,根据实验分组分别放入34 ℃,含5%CO2的细胞培养箱中培养。常氧条件:培养箱内含20%O2,缺氧条件:培养箱内含1%O2。
1.5 MTT检测细胞增殖
1.5.1 实验原理 活细胞的线粒体中存在NADPH相关的脱氢酶类,可将黄色的MTT还原为水不溶性的蓝紫色甲臜,死亡的细胞该酶活性丧失,MTT不被还原。用DMSO溶解甲臜后用酶标仪检测光密度值A570nm。
1.5.2 实验步骤 (1)用血球计数板计5000个细胞分别加入96孔板中;(2)依据实验分组条件分别常氧和缺氧条件下培养24、48、72、96、120 h后,去掉培养基,每孔加入50 μL MTT,在细胞培养箱中继续培养3 h;(3)每孔加入150 μL DMSO,摇晃均匀,测定A570nm。实验至少独立重复3次。
1.6 流式检测细胞凋亡
(1)在六孔板中分别种2×106个细胞,按照实验分组分别常养、缺氧培养24、48、72、96、120,用胰酶消化收集细胞;(2)用预冷的PBS洗3次细胞,4 ℃,1000 r/min离心5 min,弃上清;(3)加入1 mL binding buffer洗细胞,4 ℃,1000 r/min离心5 min,弃上清;(4)加入100 μL binding buffer重悬细胞,加入5 μL PI和5 μL FITC-Annexin V,混合均匀,常温避光孵育15 min,加入400 μL binding buffer混匀,立刻用流式细胞仪检测。
1.7 检测细胞内ROS形成
1.7.1 装载探针 细胞先分别常养,缺氧培养24、48、72、96、120 h,后装载探针。按照1:1000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。细胞收集后悬浮于稀释好的DCFH-DA中,细胞浓度为1 000 000~20 000 000/mL,37 ℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。
1.7.2 检测 使用488 nm激发波长,525 nm发射波长,在荧光分光光度计检测荧光强度。
1.8 统计方法
采用SPSS17.0软件进行统计分析,数据以均数±标准差表示,使用t检验应比较两者差异,P<0.05为差异有统计学意义。
2 结果
2.1 MTT检测细胞增殖
将成骨细胞分为常氧组与缺氧组进行培养,发现常氧培养条件下24、48、72、96、120 h的A值分别为0.65±0.04、0.78±0.04、0.92±0.03、0.97±0.02、0.97±0.09,常氧培养72 h之前细胞活性遂渐增加,增殖明显,72 h之后细胞增长趋于平缓(图1A)。而缺氧培养条件下24、48、72、96、120 h的A值分别为0.62±0.02、0.58±0.02、0.53±0.01、0.35±0.03、0.23±0.04,培养初期细胞活性有所降低,但降低趋势较平缓,72 h之后细胞活性急剧下降(图1B)。
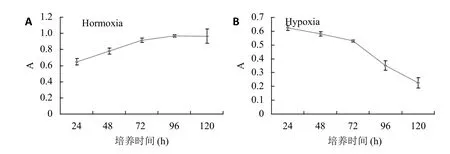
图1 常氧和缺氧培养条件下hfob1.19细胞的A值
2.2 流式检测细胞凋亡
流式细胞仪检测细胞凋亡发现在常氧培养条件下24、48、72、96、120 h的细胞凋亡率分别为(2.96±0.098)%、(3.363±0.055)%、(3.333±0.05)%、(3.263±0.047)%、(3.61±0.04)%,结果表明:常氧培养下,细胞凋亡少,各组间差别少。与常氧24 h组对比,各组间差异有统计学意义(P<0.05,图2)。缺氧培养条件下24、48、72、96、120 h的细胞凋亡率分别为(3.417±0.065)%、(4.647±0.059)%、(5.57±0.06)%、(9.66±0.056)%、(14.87±0.35)%。在缺氧条件下成骨细胞随着时间的延长,凋亡细胞增多,凋亡比例快速增加。与缺氧24 h组对比,各组间差异有统计学意义(P<0.05,图3)。
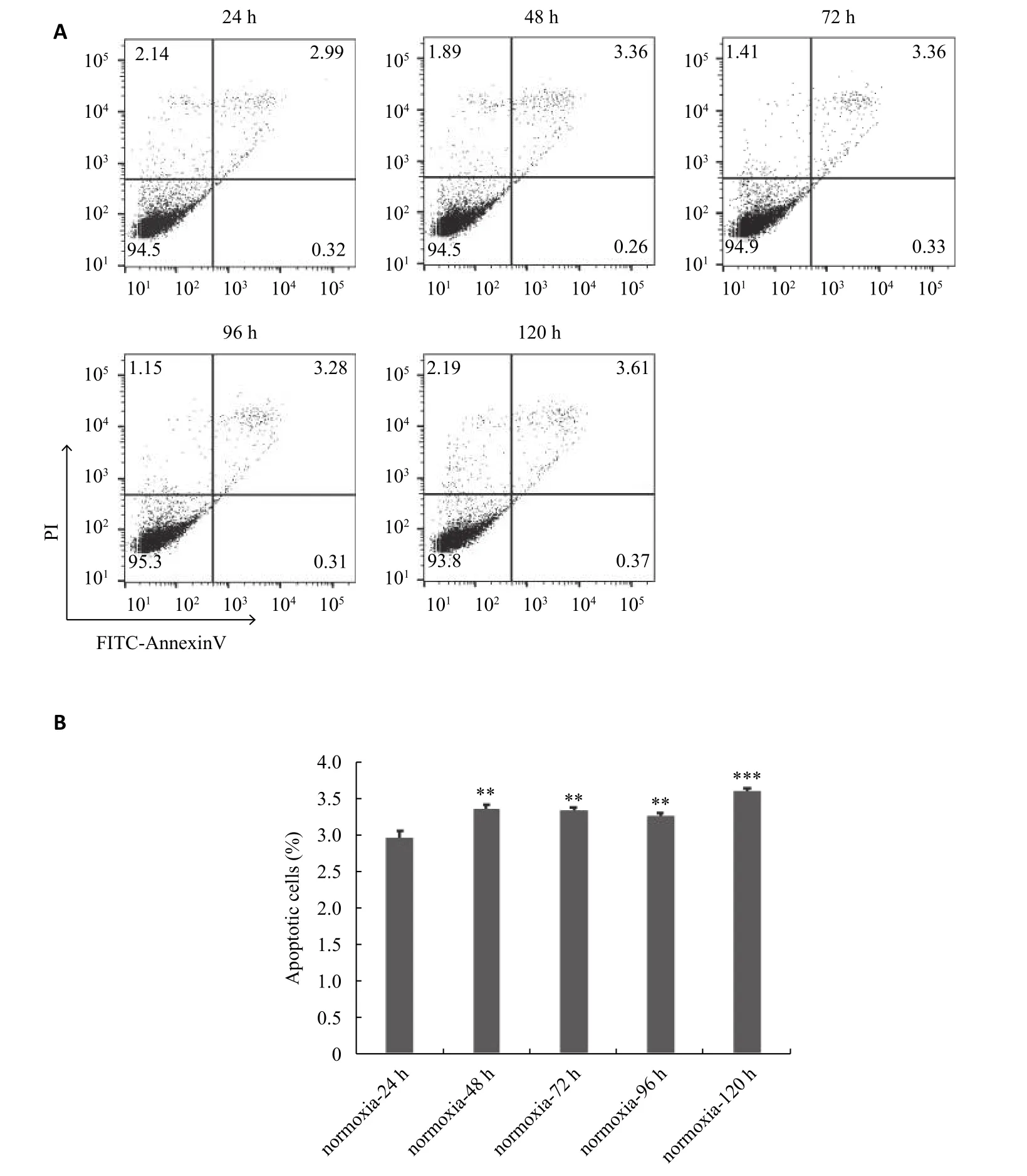
图2 流式细胞仪检测常氧培养24~120 h hfob1.19细胞凋亡情况
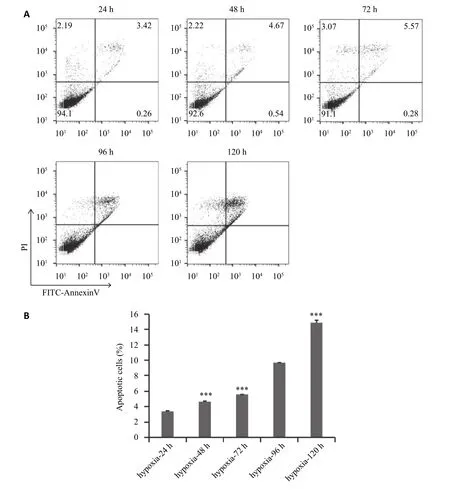
图3 流式细胞仪检测缺氧培养24~120 h hfob1.19细胞凋亡情况
2.3 检测细胞内ROS形成
将成骨细胞分为常氧组与缺氧组进行培养,常氧培养条件下24、48、72、96、120 h的ROS值分别为2552±61.02、2577.33±34.02、2556±34.70、2604±18.33、2628.67±38.18,可见常氧条件下细胞内活性氧水平较低,各个时间段活性氧水平差异不大,与常氧培养24 h组比较,各组之间差异无统计学意义(P>0.05)。而缺氧培养条件下24、48、72、96、120 h的ROS值分别为 3074.67±126.70、3624±132.52、4395.33±215.53、4930±86.61、5741±167.14。缺氧条件下细胞内活性氧水平高,随着缺氧时间增长,活性氧水平快速升高。与常氧培养24 h组比较,各组之间差异有统计学意义(P<0.05,图4)。
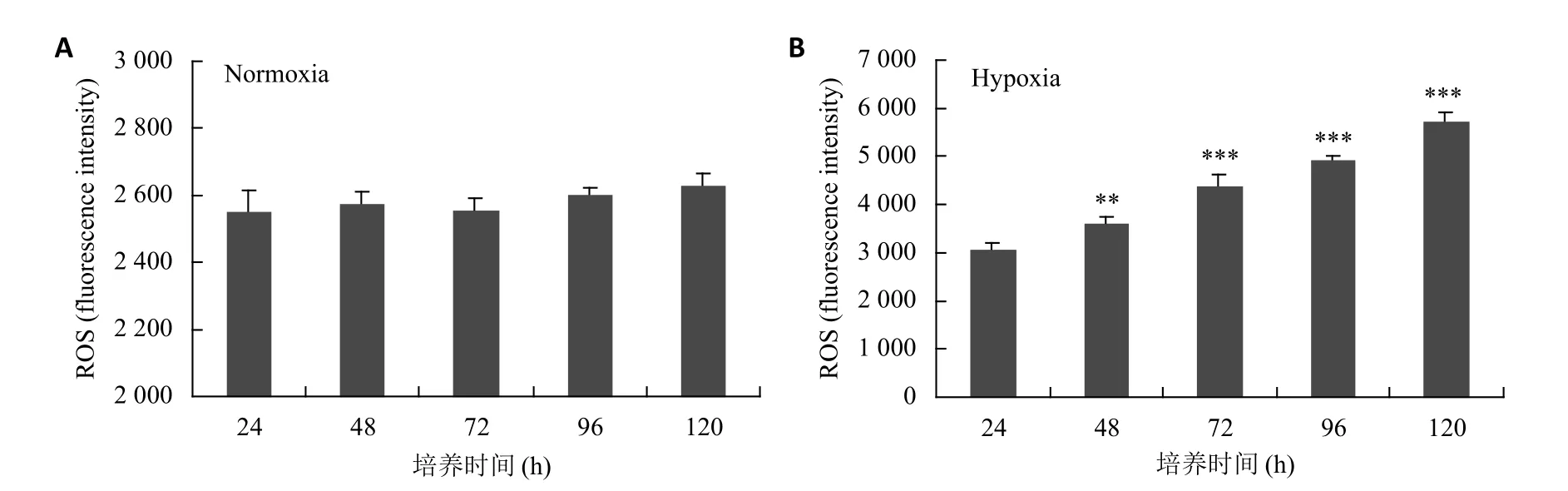
图4 常氧和缺氧条件下检测hfob1.19细胞内活性氧水平
3 讨论
严重的血液供应中断和血运重建不足显著导致骨折愈合延迟或骨不连[13],骨折部位在血流破坏后造成的缺氧环境可能导致成骨细胞死亡[14],抑制骨折愈合。对于成骨细胞来说,它的生长是需氧性的,严重的低氧影响了成骨细胞的代谢。细胞内的氧约有80%~90%在线粒体内用于氧化磷酸化生成ATP,仅10%~20%在线粒体外用于生物合成、降解及生物转化(解毒)作用等。严重缺氧首先影响线粒体外氧的作用,使神经介质的生成和生物转化过程等降低,随着缺氧的持续,影响线粒体的呼吸功能,ATP生成减少,产生大量ROS。当活性氧大量生成而超过抗氧化系统的清除能力,机体就会形成氧化应激状态[15],引起DNA氧化损伤和蛋白质的表达异常,产生细胞毒效应并最终对机体造成不可逆损害。正常人体细胞内也会产生一定的ROS,但机体内存在着抗氧化还原系统,氧化及抗氧化处于一个动态平衡。当细胞持续处于缺氧状态,ROS就不断升高,Hou[16]将成骨细胞2%低氧环境下持续48 h培养,检测细胞ROS持续升高,细胞内乳酸不断升高,考虑在缺氧条件下,大多数细胞改变代谢方式,糖酵解变为ATP生成的主要途径,糖酵解途径产生大量乳酸,且糖酵解和ROS形成之间存在正反馈。但也有细胞在缺氧环境下产生ROS量的减少情况,比如人的 SV-HFO细胞是成骨细胞的前体,它在持续的2%O2培养的细胞中ROS产生减少,随后保护性抗氧化酶SOD1和SOD2和CAT的基因表达降低。这表明在低氧张力下培养的细胞中ROS和H2O2自由基清除减少,这是成骨细胞从高保护状态的能量切换到低保护状态。在低氧条件下这种转换降低ROS保护的缺点是,这使得细胞容易受到氧化应激和ROS的刺激,最终导致细胞凋亡增加,细胞增殖、矿化受影响[17]。SV-HFO细胞对低氧的反应仍然是负面的,虽然产生的ROS少,与hfob1.19反应不同可能与细胞性质不同及氧浓度不同有关。本实验结果提示常氧培养下的成骨细胞内的存在一定量的ROS,但各组间ROS处于一个相对稳定状态。然而,当细胞处于长时间急性缺氧状态,细胞内ROS明显升高,与同时间段常氧组相比,细胞内ROS均升高,而且ROS的升高呈时间相关性,持续的缺氧造成成骨细胞内ROS急剧升高。
据文献[19]描述,大量ROS可造成细胞损伤,ROS损伤的机制包括直接损害细胞外基质,促进其降解;损伤成骨细胞蛋白质、脂质和DNA大分子;促进Ca2+从细胞内Ca2+库的释放,扰乱成骨细胞内Ca2+的内稳定,抑制成骨细胞分化;直接损伤成骨细胞蛋白质、脂质和DNA等生物大分子,最终严重影响细胞的存活,导致细胞的凋亡等,ROS 致成骨细胞凋亡的机制可能是综合性的。郭宝磊等[18]通过过氧化氢诱导MC3T3-E1细胞凋亡实验中检测线粒体膜电位下降,发现ROS导致线粒体Bax蛋白增加,线粒体通透性增加,激发线粒体凋亡途径。在本实验中,可见正常氧培养情况下,体外培养的成骨细胞凋亡率较低,而缺氧各组的成骨细胞凋亡率显著增高,说明缺氧能够加速成骨细胞的凋亡。成骨细胞的凋亡率与缺氧的时间长短相关,随缺氧时间的逐渐延长,凋亡率逐渐升高,各组之间差异显著,在缺氧72 h后,细胞凋亡率急剧上升。如果不予及时的纠正,有可能造成成骨细胞凋亡的不可逆变化。这些可能是由于培养环境的持续缺氧造成能量代谢的降低与细胞增殖所需代谢的增加造成能量代谢不平衡,产生大量ROS,ROS对细胞进破坏产生细胞凋亡增加造成。
缺氧同时还抑制了成骨细胞的增殖,并且这种抑制作用具有明显的时间依赖性,随着缺氧时间的延长,这种抑制作用越明显。研究发现缺成骨细胞周期的调控,包括细胞在有丝分裂原作用下复制和细胞分裂的调控机制,抑制与细胞周期调节相关的基因会导致增殖的停止[19-20]。实验同样发现在成骨细胞缺氧72 h时出现细胞增殖能力拐点,增殖能力明显下调。成骨细胞在急性缺氧时出现凋亡增加,增殖能力下降,并在72 h后出现拐点,考虑这种现象出现的主要原因是在急性缺氧早期,首先影响线粒体外氧的作用,使神经介质的生成和生物转化过程等活动降低。所以细胞出现轻度的凋亡以及轻度的增殖能力下调,当缺氧持续作用时线粒体呼吸功能和F0F1-ATP酶活性受到抑制,电子传递受阻,发生氧化磷酸化解偶联,线粒体ATP含量降低,从而出现细胞的大量凋亡及增殖能力急剧下降。与急性缺氧不同,当细胞出现慢性缺氧时,线粒体氧化磷酸化能力可以部分恢复,缺氧适应至少部分可以通过降低细胞基础氧耗量,F0F1-A1P酶活性的损伤是部分可逆的,所以在慢性缺氧环境下,细胞有个慢性适应过程,不致于出现剧烈的变化[21]。成骨细胞对急性持续缺氧与间断缺氧反应也不同,有实验对成骨细胞进行分组,缺氧组在低氧培养基培养4 h后常氧培养基中培养,低氧预适应组给予在10 min低氧培养基后转为10 min常氧培养基中培养3次,然后在4 h低氧培养基培养后转为4 h常氧培养基中培养1次。发现测试细胞增殖能力常氧>间断缺氧>持续缺氧[22],间断缺氧提高细胞缺氧的氧耐受,持续缺氧造成细胞增殖能力下降,影响细胞矿化功能。Wang[23]将人骨细胞置于用于产生厌氧条件的塑料袋中,发现在缺氧条件下培养72 h的骨细胞降低其代谢活性,缺氧抑制骨细胞对血小板释放的上清液的促有丝分裂反应以及与BMP-6孵育后成骨分化标志物碱性磷酸酶和骨钙蛋白的表达。
研究发现,氧气对成骨细胞增殖矿化的重要性,缺氧造成细胞凋亡,活性降低,成骨细胞的数量及活性对维持骨的代谢平衡非常重要,一旦这种平衡被破坏,就会引起骨代谢障碍。成骨细胞的数量取决于细胞凋亡与细胞增殖的平衡,这种平衡的丧失,也会导致各种代谢性骨病的发生。本实验结果发现严重急性缺氧对成骨的生长产生不利的作用,而且在缺氧72 h 时会出现成骨细胞凋亡率急剧增加,增殖率急剧下降,可见缺氧时间对成骨细胞代谢也起了很重要的作用。因此,在骨科创伤及手术中要注意缺血缺氧时间的控制,及时的复氧,包括减少止血带使用时间,控制出血,骨折及时复位及修复损伤血管等,减少组织缺氧时间,避免成骨细胞发生不可逆转的凋亡。当然,缺氧后肢体缺氧后再复氧,可能产生再灌注损伤,加重细胞的氧化应应损伤[24],抗氧化药物的应用可能会减少应激反应带来的损伤,这是实验及临床工作需要注意的地方。
