小鼠肝星状细胞(HSC)中ATF5促进TRAIL基因的表达及其对同种异体胰岛移植物的保护作用
2018-12-13黄文海陈宗祐项建斌李震洋顾晓冬
黄文海 陈宗祐 项建斌 李震洋 顾晓冬
(复旦大学附属华山医院普外科 上海 200040)
肝星状细胞(hepatic stellate cells,HSCs)位于肝窦内皮与肝细胞之间的Disse间隙内,主要参与维生素A代谢,HSCs可在多种细胞因子的作用下激活并转化为肌成纤维样细胞,促进肝纤维化的发生和发展。既往研究主要关注HSCs 非免疫学功能,近年来研究发现活化的HSCs 还具有各种免疫细胞的特征,可表达多种免疫相关分子并分泌具有不同免疫调节功能的细胞因子。有研究证明活化的HSCs有抑制T淋巴细胞的功能,主要通过促进T细胞的凋亡来实现[1]。Chen等[2]利用胰岛细胞移植模型来研究 HSCs在移植免疫耐受中的作用,发现 HSCs 与胰岛细胞联合移植能够有效地保护同种异体胰岛移植物不被排斥,而胰岛细胞单独移植后很快就发生严重的排斥反应,这说明HSCs 能够诱导同种异体胰岛移植免疫耐受。Yang等[3]的研究进一步发现,在胰岛细胞移植模型中,HSCs表达的肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)在诱导移植免疫耐受过程中发挥重要作用,并且发现γ-干扰素(interferon-γ,IFN-γ)能促进TRAIL基因的表达。我们发现IFN-γ也能促进HSCs中转录激活因子5(activating transcription factor 5,ATF5)基因的表达。ATF5是ATF/CREB(cAMP response element-binding)家族的转录因子,含有282个氨基酸序列,在细胞发育、分化、增殖和凋亡中扮演着多样化的角色[4-5]。我们的研究发现HSCs中的ATF5可以促进TRAIL基因的表达,此HSCs与胰岛细胞联合移植,明显延长小鼠同种异体胰岛移植物的存活时间。
材 料 和 方 法
实验动物和试剂7~9周龄健康C57BL/6小鼠(H-2b)和BALB/c小鼠(H-2d),体重约25 g,雌雄不限,购自中国科学院上海实验动物中心;IFN-γ 和脂多糖(lipopolysaccharide,LPS)购自美国Sigma-Aldrich公司;胎牛血清购自美国Hyclone 公司;Trizol试剂购自美国Invitrogen 公司;RT-PCR试剂盒购自美国Thermo公司;PE标记抗小鼠TRAIL的抗体购自美国eBioscience公司;RPMI 1640干粉购自美国GIBCO公司;RPMI 1640完全培养液(内含RPMI1640干粉10.4 g/L,10%胎牛血清、2 mmol/L谷氨酰胺、0.05 mmol/L 2-巯基乙醇、160 U/mL庆大霉素、20 mmol/L二羟乙基呱嗪乙烷磺酸、1 mmol/L丙酮酸钠);RPMI不完全培养液(不加胎牛血清,其他成分与RPMI 1640完全培养液同)。重组小鼠粒细胞-巨噬细胞集落刺激因子(recombinant mouse granulocyte-macrophage colony stimulating factor,rmGM-CSF)购自美国R & D公司;3H-TdR由上海市免疫学研究所提供;慢病毒(LV-ATF5-RNAi)由上海吉凯基因化学技术有限公司提供,此慢病毒是利用慢病毒介导的RNA干扰技术,针对ATF-5基因进行RNA干扰,经PCR和测序证实,pGCL-ATF5 shRNA慢病毒载体构建正确。
HSCs的分离和培养小鼠麻醉后,通过肝下下腔静脉向肝脏内灌注20 mL不含Ca2+和Mg2+的Hank’s平衡盐溶液(美国Mediatech公司),然后灌注1mL Ⅳ型胶原酶(1 mg/mL,美国Sigma-Aldrich公司)。快速切下肝脏、剪碎肝组织,加入Ⅳ型胶原酶(1 mg/mL),37 ℃恒温水浴振荡40 min。细胞悬液经滤网过滤至离心管内,经Percoll密度梯度离心法使HSCs浓聚,吸取HSCs层至离心管内,加入富含20%胎牛血清的RPMI 1640不完全培养液,在5% CO2、37 ℃培养箱内培养7~14天。采用Desmin免疫染色法和脂滴的典型光镜表现来鉴定HSCs的纯度达到90%~95%。
小鼠骨髓来源树突状细胞的分离和培养无菌切取小鼠胫骨和股骨,用含有不完全RPMI 1640培养液的2 mL注射器反复冲洗骨髓腔,制成单细胞悬液,加红细胞裂解液溶解红细胞,377×g离心5 min去除溶解的红细胞膜,重悬细胞,用RPMI 1640完全培养液调整细胞浓度至1×106/mL;将上述所得的骨髓单细胞悬液接种至24孔板(2 mL/孔),rmGM-CSF加入培养体系中,浓度为10 ng/mL,倒置显微镜观察后,置于37 ℃、5%CO2培养箱中培养48 h后,轻弹培养板,以使粒细胞集落充分悬浮。半量换液,每孔另加含rmGM-CSF的新鲜培养液1 mL,终浓度保持10 ng/mL,如此隔天换液,培养至第6天,加入1 μg/mL LPS,继续在37 ℃、5%CO2培养箱中培养18 h。用吸管反复冲洗培养孔后收集悬浮细胞,移入离心管,377×g离心5 min,丢弃上清液,轻弹管壁重悬细胞。加入RPMI 1640不完全培养液,再次离心重复上述步骤后,以RPMI 1640完全培养液调整细胞浓度至1×106/mL备用。
尼龙毛柱法分离小鼠脾脏T细胞将内径5 mm、长约15 cm的聚乙烯塑料管一端斜形封闭后,用75%酒精消毒后晾干备用;称取尼龙毛100 mg,高温消毒后烘干,将尼龙毛均匀充填于塑料管内,用RPMI 1640完全培养液浸湿;将制备的小鼠脾脏淋巴细胞悬液重悬为2 mL,慢慢垂直加入尼龙毛柱中(注意不要留气泡),使淋巴细胞悬液位于尼龙毛柱中央,平放柱体,置于37 ℃环境中温育1 h;在塑料管的封闭尖端剪一小孔,保证液体通过小孔速度控制在1滴/1~2 s,用预温的RPMI 1640完全培养液从上冲洗尼龙毛柱,在下段小孔处收集过柱液体,即为收集的T细胞悬液;移入离心管,377×g离心5 min,用RPMI 1640完全培养液重悬,4 ℃冰箱保存备用。
单向混合淋巴细胞反应BALB/c小鼠骨髓来源树突状细胞经20Gy γ射线灭活。将灭活的BALB/c小鼠骨髓来源树突状细胞和C57BL/6小鼠脾脏T细胞(2×105/孔) 于96孔圆底培养板中作单向混合淋巴细胞反应(mixed lymphocyte reaction,MLR),设3个复孔,树突状细胞与T细胞按∶10比例在37 ℃、5%CO2下混合培养72 h。培养结束前18 h加入3H-TdR (0.5 μCi/孔),培养结束后用多头细胞收集仪收集细胞于玻璃纤维滤纸上,经1450型液体闪烁计数仪(美国Wallac公司)测定3H-TdR掺入量,结果用平均每分钟闪烁数(count per minute,cpm)±s表示。为了检测HSCs对T细胞增殖反应的影响,我们在MLR前加入经40 Gy γ射线灭活的HSCs(1×104/孔)。
流式细胞术检测以RPMI 1640完全培养液调整HSCs细胞浓度至1×106/mL,取100 μL置于荧光激活细胞分选(fluorescence activated cell sorting,FACS)管,加入PE标记抗小鼠TRAIL的抗体(美国eBioscience公司),室温下避光温育20 min,FACS洗涤液洗涤,FACS固定液固定,美国BD Biosciences公司流式细胞术检测,数据分析采用FlowJo软件进行。PE标记大鼠IgG2a为阴性对照。
同种异体胰岛移植向C57BL/6小鼠腹腔内注射链脲霉素(streptozocin,STZ)(180 mg/kg,美国Sigma-Aldrich公司)建立糖尿病小鼠模型,血糖超过350 mg/dL的C57BL/6糖尿病小鼠作为胰岛移植的受体。BALB/c小鼠作为供体提供胰岛。BALB/c小鼠采用异氟醚麻醉,固定于手术台,腹部备皮消毒后,横切口打开腹腔,在外科显微镜下仔细解剖胰腺,经胆管用3 mL Ⅳ型胶原酶(1 mg/mL)灌注。切下胰腺,通过Ficoll密度梯度离心法分离胰岛细胞,将300个胰岛细胞吸入聚乙烯管,300×g离心5 min制成颗粒状,用显微外科技术将其置入受体C57BL/6糖尿病小鼠的肾包膜下。当受体小鼠的血糖恢复并维持正常(≤150 mg/dL) 4天,则认为移植成功。当出现连续2次血糖测量均≥350 mg/dL,则认为移植失败,胰岛被排斥。整个实验过程均未给予免疫抑制剂。为了研究HSCs对小鼠胰岛移植的影响。我们将300个胰岛细胞联合3×105个C57BL/6小鼠的HSCs共同置入受体C57BL/6糖尿病小鼠的肾包膜下。
半定量RT-PCR使用Trizol试剂提取HSCs的总RNA,紫外分光光度计检测RNA的浓度及纯度。按RT-PCR试剂盒说明书以逆转录酶合成cDNA第一链,以cDNA为模板加入上游引物、下游引物和Taq酶进行PCR扩增。反应条件为,RT:42 ℃ 55 min,PCR:94 ℃ 3 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循环30次,延伸温度72 ℃,10 min。1.0%琼脂糖凝胶电泳检测扩增产物,凝胶成像系统拍照。采用18S作为内参基因,引物由上海生工生物工程股份有限公司合成(表1)。

表1 引物序列Tab 1 Sequences of primers

结 果
IFN-γ上调HSCs中ATF5mRNA水平在小鼠HSCs培养过程中加入IFN-γ (10 U/mL),半定量 RT-PCR分别检测IFN-γ作用30 min、1 h、3 h、6 h、24 h后HSCs中ATF5 mRNA水平。结果显示IFN-γ可快速上调HSCs中ATF5 mRNA水平,IFN-γ作用30 min即达到高峰(P<0.01),随着作用时间的延长,ATF5 mRNA水平逐渐降低(图1)。
IFN-γ上调HSCs中TRAILmRNA和蛋白质水平半定量 RT-PCR用于检测HSCs中TRAIL mRNA水平,如图2所示,小鼠HSCs培养过程中分别加入不同浓度的IFN-γ(0.1、0.5、1、10、100 U/mL)培养24 h后,半定量RT-PCR检测发现IFN-γ可上调HSCs中TRAIL mRNA水平,随着IFN-γ浓度的递增,HSCs 中TRAIL mRNA水平也在逐渐增加。当IFN-γ浓度为10 U/mL时,TRAIL mRNA水平达最高。在小鼠HSCs培养过程中加入IFN-γ (10 U/mL),流式细胞术检测HSCs表面TRAIL蛋白质达水平,结果表明IFN-γ作用24 h和48 h后,HSCs表面TRAIL蛋白质水平明显上调(图3)。
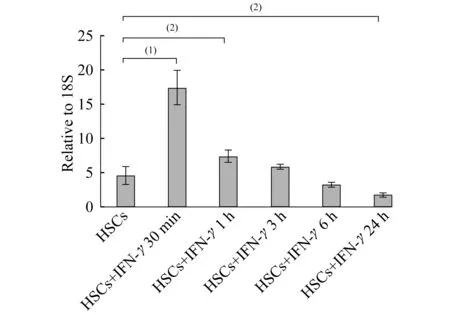
The level of ATF5 mRNA.(1)P<0.01,(2)P<0.05.
图1不同时间IFN-γ作用后HSCs中ATF5mRNA水平
Fig1ThelevelofATF5mRNAinHSCsexposed
toIFN-γatdifferenttimepoints

A:HSCs;B:HSCs+IFN-γ 0.1 U/mL,24 h;C:HSCs+IFN-γ 0.5 U/mL,24 h;D:HSCs+IFN-γ 1 U/mL,24 h;E:HSCs+IFN-γ 10 U/mL,24 h;F:HSCs+IFN-γ 100 U/mL,24 h.
图2不同浓度IFN-γ作用后HSCs中TRAILmRNA水平
Fig2ThelevelofTRAILmRNAinHSCsexposed
toIFN-γatdifferentconcentrations
慢病毒(LV-ATF5-RNAi)感染HSCs后ATF-5mRNA和TRAILmRNA表达水平变化在小鼠HSCs培养过程中加入慢病毒(LV-ATF5-RNAi),感染复数(multiplicity of infection,MOI)为20,感染72 h后,半定量 RT-PCR检测HSCs中ATF-5 mRNA 和TRAIL mRNA水平。如图4所示,慢病毒感染HSCs后,HSCs中ATF5 mRNA水平明显下降(P<0.01),TRAIL mRNA表达亦下降(P<0.05);IFN-γ作用于感染慢病毒的HSCs后,HSCs中ATF5 mRNA和TRAIL mRNA水平亦上调(P<0.01),但明显低于未被慢病毒感染的HSCs (P<0.01)。
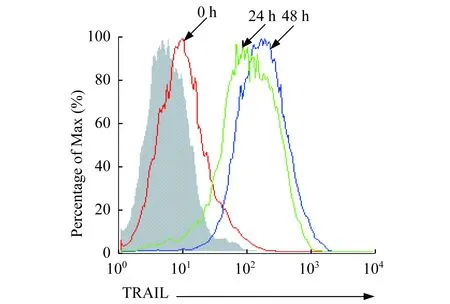
图3 不同时间IFN-γ作用后HSCs表面TRAIL蛋白质水平Fig 3 The level of TRAIL protein on HSCs exposed to IFN-γ at different time points

A:HSCs;B:HSCs+IFN-γ 10 U/mL,24 h;C:HSCs+LV-ATF5-RNAi;D:HSCs+LV-ATF5-RNAi+IFN-γ 10 U/mL,24 h.(1)P<0.01,(2)P<0.05.
图4慢病毒(LV-ATF5-RNAi)感染HSCs后ATF5mRNA和TRAILmRNA水平
Fig4ThelevelofATF5mRNAandTRAILmRNAinHSCsinfectedwithLV-ATF5-RNAi
慢病毒(LV-ATF5-RNAi)感染HSCs对MLR的影响已有文献发现,HSCs能够明显地抑制T细胞的增殖[1]。我们在BALB/c小鼠骨髓来源树突状细胞与C57BL/6小鼠T细胞进行MLR时,加入C57BL/6小鼠HSCs,观察HSCs对T细胞增殖反应的影响(T细胞∶树突状细胞∶HSCs=20∶2∶1)。发现HSCs可明显抑制T细胞增殖反应(P<0.01),而慢病毒(LV-ATF5-RNAi)感染的HSCs亦能抑制T细胞增殖反应(P<0.05),但抑制作用明显低于未被慢病毒感染的HSCs (P<0.01)(图5)。此外,HSCs对T细胞增殖反应的抑制作用随着HSCs比例的增加而增强(图6)。
慢病毒(LV-ATF5-RNAi)感染HSCs对小鼠胰岛移植的影响单纯胰岛移植组(A组)移植胰岛中位存活时间为11天;胰岛联合HSCs(B组)共同移植到小鼠的肾包膜下,移植胰岛中位存活时间为88天,明显长于A组(P<0.01);胰岛联合慢病毒(LV-ATF5-RNAi)感染的HSCs(C组)共同移植到小鼠的肾包膜下,移植胰岛中位存活时间为18天,亦能延长胰岛移植物的存活时间,与A组相比,差异有统计学意义(P<0.01)。但慢病毒(LV-ATF5-RNAi)感染的HSCs对胰岛移植物保护作用明显不及未被慢病毒感染的HSCs,与B组相比,差异有统计学意义(P<0.01)(图7)。
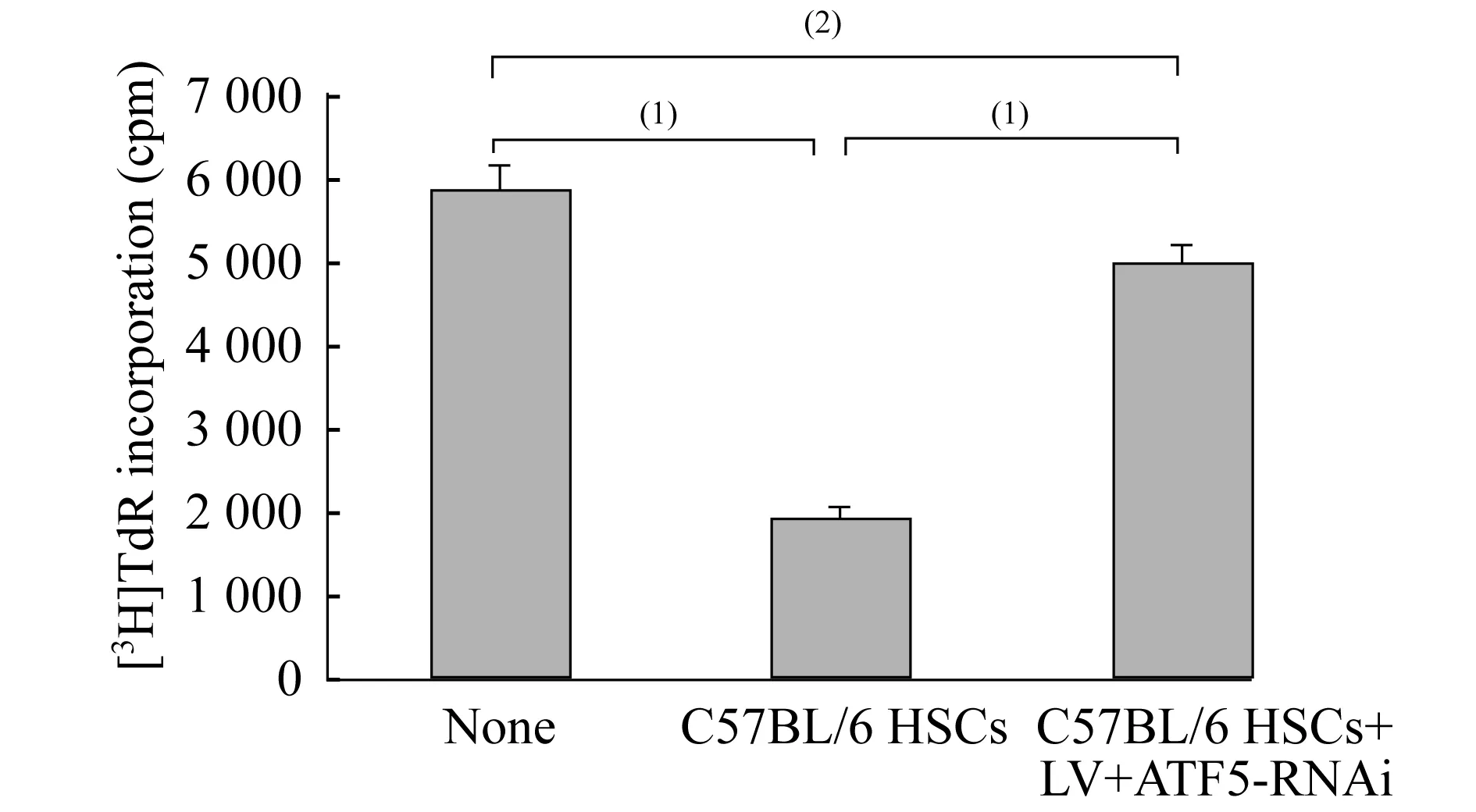
T Cell Proliferation.(1)P<0.01,(2)P<0.05.
图5慢病毒(LV-ATF5-RNAi)感染HSCs对MLR的影响
Fig5EffectofHSCsinfectedwithLV-ATF5-RNAionMLR
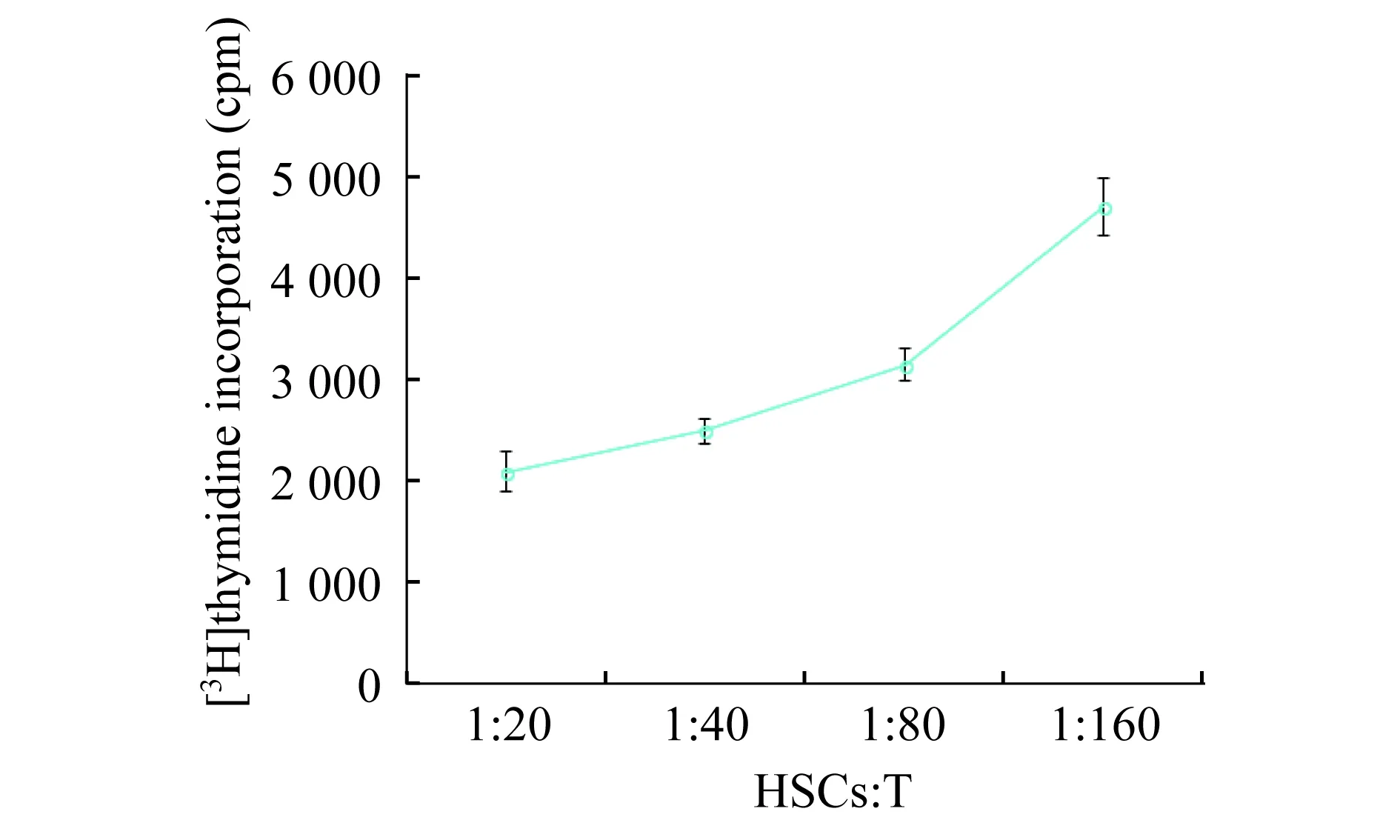
图6 不同比例的HSCs对T细胞增殖反应的影响Fig 6 Effect of different proportions of HSCs on T cell proliferation
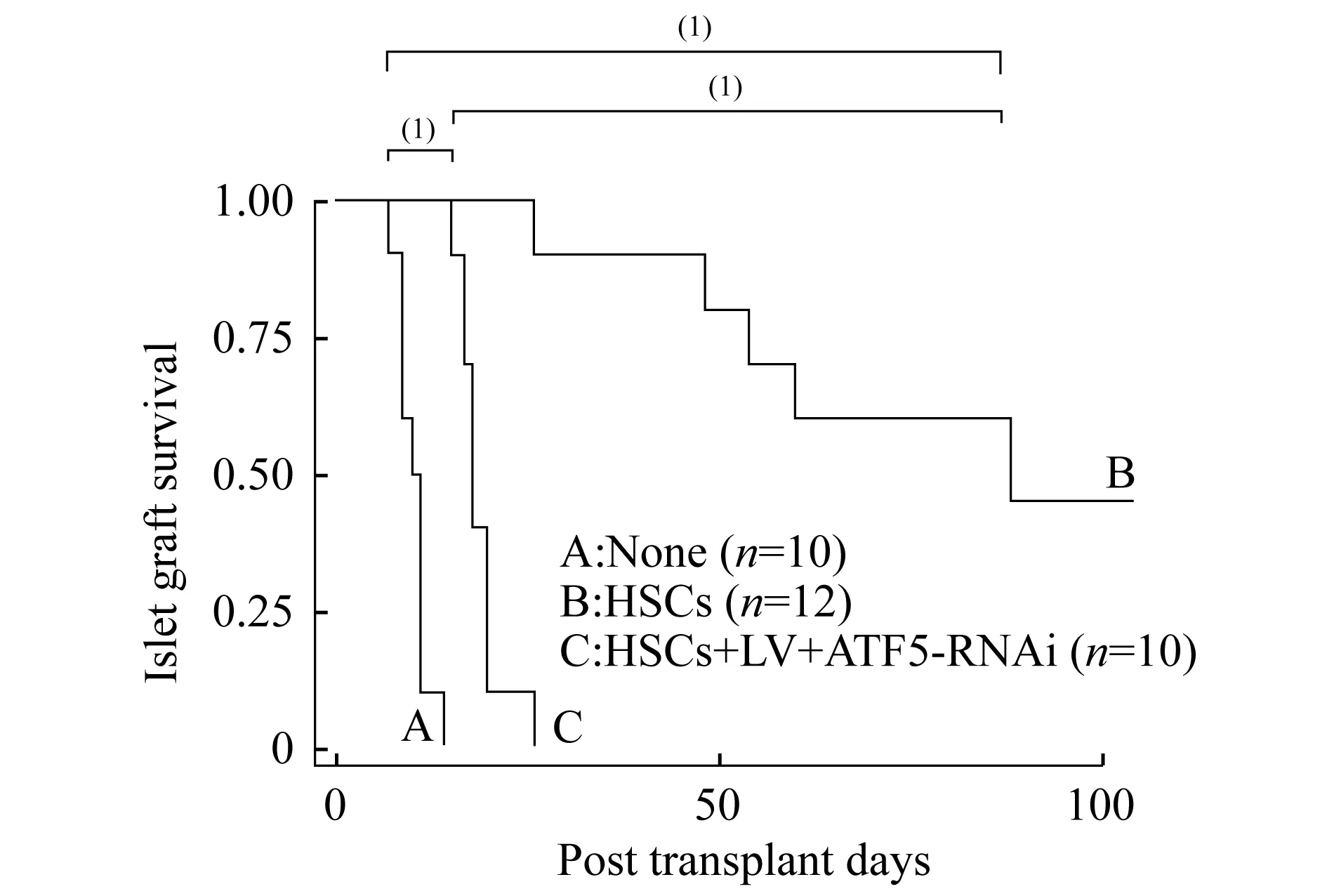
Median survival time in islets grafts.(1)P<0.01.
图7慢病毒(LV-ATF5-RNAi)感染HSCs
对小鼠胰岛移植的影响
Fig7EffectofHSCsinfectedwithLV-ATF5-RNAi
onisletstransplantationinmurine
讨 论
HSCs静止状态下作为储脂细胞主要参与维生素A的代谢,肝纤维化时HSCs 可在多种细胞因子及损伤因素的作用下激活并转化为肌成纤维样细胞,产生大量以Ⅰ型胶原为主的细胞外基质,并分泌转化生长因子β (transforming growth factor β,TGF-β)、血小板源性生长因子等各种促纤维化因子,在肝纤维化的发生发展中起着关键作用。近年来研究发现,活化的HSCs具有多种免疫细胞的特性,能够直接参与肝脏局部的免疫调控。有研究指出肿瘤微环境中的HSCs能显著影响肝癌细胞的生物学行为,促进肝癌细胞增殖与浸润[6-7]。其可能的机制一方面是活化的HSCs分泌多种细胞因子,通过旁分泌途径促进肝纤维化进而促进肝癌形成,另一方面是HSCs诱导免疫耐受,为肝癌细胞抵御了免疫系统的追踪和清除。
HSCs诱导免疫耐受的机制主要包括:(1)抑制T淋巴细胞增殖,促进活化的T 淋巴细胞凋亡。活化T细胞本身及其分泌的细胞因子IFN-γ可促进HSCs表达抑制性分子B7-H1,B7-H1可诱导活化T细胞自身的凋亡[2,8],此外,B7-H1可与T细胞表面受体PD-1结合,传递抑制性信号,增强免疫耐受[9];(2)抑制T淋巴细胞介导的细胞毒作用;(3)促进调节性T细胞的产生;(4)分泌具有诱导免疫耐受作用的细胞因子,如TGF-β1、B淋巴细胞趋化因子、粒细胞集落刺激因子等[10]。而Yang等[3]研究发现HSCs表达的TRAIL在保护同种异体移植的胰岛免受排斥反应中具有重要作用。在本研究中,我们也发现HSCs可明显抑制T细胞增殖反应。
TRAIL也被称为凋亡素2配体,属于Ⅱ型跨膜蛋白,是Wiley等[11]于1995年发现的肿瘤坏死因子超家族成员,是能够介导细胞凋亡的信号分子之一。而凋亡常见于发生排斥的器官及组织,某些免疫抑制剂也通过诱导凋亡而发生抗排斥作用。研究发现,TRAIL可能在促进免疫细胞凋亡、维持免疫耐受等方面起着一定的作用[12],其发挥免疫抑制作用的途径可能是作用于T淋巴细胞的细胞周期,抑制T淋巴细胞的增殖与活化,或促进活化T淋巴细胞的凋亡[13-14]。TRAIL及其受体结合,通过诱导凋亡来削弱活化T细胞和NK细胞对移植物的攻击,达到免疫耐受的效果,在移植免疫治疗中发挥重要的作用。但TRAIL及其受体在诱导免疫耐受中的调控特点和作用机制等尚需进一步阐明。
王晓敏等[15]研究发现,IFN-γ 可通过上调骨髓单个核细胞表面TRAIL及其受体DR5的表达来增强 TRAIL与死亡受体的结合度,并进一步增强TRAIL诱导的凋亡作用。本研究中,我们发现IFN-γ可促进HSCs高表达TRAIL且呈浓度依赖性,随着IFN-γ浓度的递增,HSCs的TRAIL表达量也在逐渐递增,这与李松岩等[16]的研究结果相似,他们发现IFN-γ以浓度依赖的方式上调 Jurkat 细胞TRAIL表达。但是,IFN-γ如何调控TRAIL的表达尚不清楚。
ATF5是转录激活因子/cAMP应答元件结合蛋白家族的新成员,在调节细胞增殖、分化和凋亡方面具有广泛作用[17]。ATF5能与细胞内多种蛋白分子相互作用,形成复合物,共同调节基因的转录,从而参与调控细胞的增殖与凋亡[18]。本研究中,我们发现IFN-γ作用于HSCs,HSCs中ATF5的表达亦增加,提示ATF5和TRAIL之间可能存在相关性。我们进一步用慢病毒介导的RNA干扰技术抑制HSCs中ATF5基因的表达,发现ATF5的表达减少,TRAIL表达亦减少,提示ATF5基因的表达可促进TRAIL的表达。使用IFN-γ作用于慢病毒(LV-ATF5-RNAi)感染的HSCs,发现抑制ATF5基因表达后,IFN-γ促进TRAIL表达的作用明显较弱,但TRAIL仍有一定的表达量,提示IFN-γ除了通过ATF5信号通路促进TRAIL表达,还存在其他信号通路促进TRAIL的表达。
本研究发现,胰岛联合HSCs共同移植到小鼠的肾包膜下,胰岛得到明显的保护,与单独胰岛移植相比,胰岛的存活期明显延长;但胰岛联合慢病毒(LV-ATF5-RNAi)感染的HSCs共同移植到小鼠的肾包膜下,HSCs中ATF5基因表达受到抑制,TRAIL的表达减少,慢病毒(LV-ATF5-RNAi)感染的HSCs对T细胞增殖反应的抑制作用减弱,对胰岛的保护作用明显下降,利用此体内试验进一步验证HSCs中ATF5可促进TRAIL的表达,TRAIL在诱导移植免疫耐受过程中发挥重要作用。
综上所述,小鼠HSCs中ATF5可促进TRAIL基因表达,表达TRAIL的HSCs可以抑制T细胞的增殖反应,此HSCs与胰岛细胞联合移植,明显延长小鼠同种异体胰岛移植物存活时间。TRAIL与相关受体结合发挥免疫抑制作用的具体机制,还有待我们进一步研究。
