初高中原子结构、元素化合物模块教学衔接的研究
2018-12-13孔晓宇翟宏菊孙德武郭颢怡
孔晓宇,翟宏菊,孙德武,郭颢怡
(吉林师范大学 化学学院,吉林 四平 136000)
化学学科的知识体系可以分为六大类:化学用语、基本概念、基本理论、化学实验、化学计算以及元素化合物知识[1],这六大类前三种为学习化学学科的基本工具,而后三类则更侧重于科学研究、生产生活、以及与实际应用相结合。元素化合物知识作为初高中化学学习内容的主线,也是高等教育体系中化学学科的分支-无机化学的重要组成部分,既是学生学习的重点也是学生学习的难点,元素化合物知识由于原子结构密切相关,因此需要初高中教师共同努力,做好初高中原子结构、元素化合物知识的衔接,使学生形成完整的知识体系。
1 初高中化学原子结构、元素化合物模块衔接现状
原子的结构是元素化合物部分的基础,人教版九年级上册第三单元:物质构成的奥秘中讲述了原子的结构,原子核外电子的排布状态以及如何书写元素周期表中前20号元素的原子结构示意图[2]。通过原子结构示意图也解释了初中化学中常见元素的化合价问题。随后教材对元素周期表进行了简单的介绍,教师引导学生利用前20号元素的原子结构示意图对原子核外电子的排布规律进行自主探究[3]。此部分内容是高中化学必修二中学习元素周期表、元素周期律的铺垫。
必修二学习元素的性质与原子结构时,选取金属钾和钠与水的反应进行对比实验,得出结论:碱金属元素的最外层电子数相同, 元素的化学性质相似。对于碱金属这一族,从上到下原子的电子层数增加,其原子半径随之增大,从锂到铯金属性增强。对于高一学生的认知体系来说,原子半径这一概念很陌生,金属性是以往的学习没有接触过的。元素周期表与与原子半径密切相关,因此导致一部分同学对知识的理解模糊不清。在后续元素周期律的学习的过程中,又涉及到元素的金属性与非金属性的规律,元素的金属性强弱可以通过它们最高价氧化物的水化物-氢氧化物的碱性强弱来判断,元素的非金属性强弱可以通过其最高价氧化物的水化物的酸性强弱来判断[4]。以对比硫元素和氯元素的非金属性为例,硫元素的最高价为+6价,其最高价氧化物的水化物为硫酸。氯元素的最高价为+7价,其最高价氧化物的水化物为高氯酸。高氯酸的酸性强于硫酸,因此得出结论:氯的非金属性强于硫。对于高一的学生来说,初中元素化合价的口诀中曾提过:二四六硫都齐全,长期的记忆使得学生对于硫的最高价态为+6价这个事实并不陌生。对于氯的最高价态为+7价,很多学生表示不能理解。在初中化学中的原子结构部分,对于最外层电子数大于4的元素来说,容易得到电子达到稳定状态,使得元素呈现出负价态。非金属元素具有正价对于学生来说是不能理解的,硫具有+6价也只是死记硬背而已,其本质并没有学生真正理解。初中化学仅仅要求学生掌握前20号元素的原子结构,并熟记常见元素的化合价,对于部分学校部分教师来说,应对中考才是化学学习最大的任务,导致此部分知识出现断层,初高中化学教学衔接出现了问题。
在初中学习原子结构时,教师只要求学生掌握到前20号元素。根据初中范围讲述的核外电子排布规律,第一层最多排布2个电子,第二层最多不超过8个电子,最外层电子数不超过8个,教师通常描述为"2 8 8"原则。高中化学选修三部分,第一章第一节更进一步讲述了原子结构。按照电子能量大小的差异,可以将核外电子分成不同的能层,第一能层用符号K表示,第二能层用符号M表示……第七能层用符号N表示。原子核外每一层所容纳的最多电子数如表1。
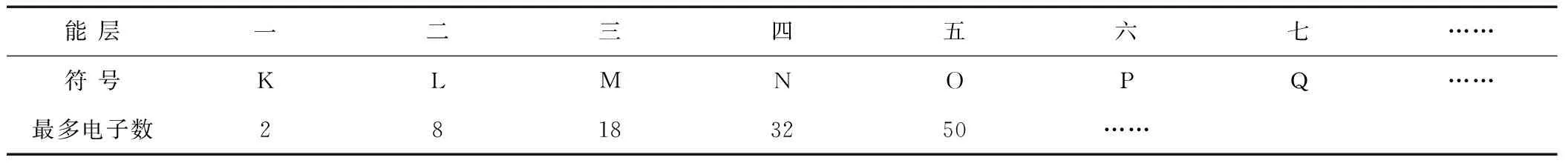
表1 每一能层所能容纳的最多电子数
这超出了学生的认知范围,在学生的原有知识中,每层最多排布8个电子,当学生初次接触M层最多能排布18个电子时,由于学生原有知识的局限性,学生认为原有知识和当前理论相互矛盾。高中化学又引进了一个新的概念:能级,即同一层的电子能量也可能不同,又可以把他们分为不同的能级。能级从s级开始,能级的数量等于能层的序数[5]。以s、p、d、f……排序,各能级可容纳的最多电子数为1、3、5、7的二倍。此部分内容学生初次接触,又比较微观抽象,较难接受,是学习当中的难点。选修三又讲述了电子排布式,钾原子的电子排布式为2、8、1,为什么不是2、8、8、1呢?这其中涉及到了构造原理,由于构造原理的理论性较强且抽象难懂。此部分内容在大学无机化学中才有清晰的讲述,大多数高中教师能传授给学生正确的规律,但其中的理论教师并不能完全掌握,并且学生的知识水平理解不到如此高深的程度,这也造成了学生学习的障碍。由此可以看出,初高中、高等教育的教学衔接也存在一定的问题。
化学性质是化学学习生活中很重要的一部分,只有研究清楚各种物质的反应,才能应用于生产生活实践。研究物质的性质,就要研究物质的结构。化学性质大多数通过化学方程式来表达,初中学生学习化学方程式主要通过死记硬背。在必修一学习非金属及其化合物-氯的时候,氯气的化学方程式繁多,单纯靠记忆掌握方程式,任务量太大,且容易出错。如果结合原子的结构来学习物质的化学性质,那么化学方程式就变得很容易。由于氯的最外层有7个电子,容易得到一个电子形成8电子稳定结构,因此具有很强的氧化性。氯气可以和金属反应,例如:铁、铜、钠,由于铁和铜都是变价金属,氯气可以把变价金属氧化成最高价。氯气也可以和非金属反应,例如:氢气,也体现了氯气的氧化性。相反,例如在初中学习置换反应时,铁与盐酸反应生成氯化亚铁,由于铁为变价金属,既有正二价,又有正三价,很多学生不明白其中的原因,容易记混淆。在选修三讲物质的结构时,讲述了铁原子的核外电子排布式,学生才能真正理解其中的原因。
2 初高中化学原子结构、元素化合物模块衔接的解决措施
首先,初高中化学教师都应该转变教学观念。九年级化学尚处于义务教育阶段,其目的在于培养学生的科学素养,熟悉化学基本概念、生活中常见的化学物质及其应用和基本的实验操作。而大多数教师迫于中考的压力,大部分的学习时间都在进行题海战术,不仅限制了学生的思维能力和创造能力,也使部分学生产生了厌学情绪。高中化学是初中化学的深入,高等化学的基础,其重要性不言而喻。由于高中化学的理论性更深,难度更大,且学生的课业压力繁重,大部分教师都把重点放在了高考的准备上,这也是一部分学生理论基础扎实,但是实验的动手能力很差。化学教师的教学应该注重理论的扎实性、实验的操作性、理论与现实的联系性,使学生真正的了解化学,应用化学。
其次,初高中化学教师都应该熟悉中学化学教材,具备完整的知识体系,而不是一昧的依靠总结出来的规矩,口诀去解题,把学生变成了只会解题的机器。只有对教材有深入的了解,初三教师才能根据高中课程及学生现阶段的认知水平展开铺垫性、延伸性的教学。高中教师也能根据学生已有的知识理论进行教学上的衔接,形成教学上良好的过渡。
