传统有机化学实验环己酮制备实验的改进
2018-12-13杨世军
杨世军
(桂林理工大学化学与生物工程学院, 广西 桂林 541004)
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体。也是重要的工业溶剂,如用于油漆,特别是用于那些含有硝化纤维、氯乙烯聚合物及其共聚物或甲基丙烯酸酯聚 合物油漆等。用于有机磷杀虫剂及许多类似物等农药的优良溶剂, 用作染料的溶剂,作为活塞型航空润滑油的粘滞溶剂,脂、蜡及 橡胶的溶剂。也用作染色和褪光丝的均化剂,擦亮金属的脱脂剂, 木材着色涂漆,可用环己酮脱膜、脱污、脱斑。环己酮与氰乙酸 缩合得环己叉氰乙酸,再经消除、脱羧得环己烯乙腈,最后经加 氢得到环己烯乙胺,环己烯乙胺是药物咳美切、特马伦等的中间体。用作指甲油等化妆品的高沸点溶剂。通常与低沸点溶剂和中 沸点溶剂配制成混合溶剂,以获得适宜的挥发速度和黏度[1-4]。目前国内有机化学实验教材中环己酮的制备是用浓硫酸催化的重铬酸盐氧化法[3-4],该法存在的主要缺点是严重污染环境(Cr6+是致癌物),药品较贵,操作繁琐,而且催化剂浓硫酸用量较大,废酸难处理,反应时间长 ,反应的后处理工作较为复杂困难 ;也有用有机金属配合物为催化剂 、过氧化氢为氧化剂的报道,而且产率高达 95 %[5],但反应时间长达12 h ,不适合有机化学实验教学。
为了改进实验教材中合成环己酮实验的不足,从根本上解决实验中环境污染问题,我们采用了30%H2O2作为氧化剂,在 75~80℃的温度下,采用无毒害的CuCl2催化剂催化氧化环己醇制备环己酮[6],反应条件温和,容易控制,氧化剂反应完后只留下水,无毒害废弃物产生,反应时间较短,适宜有机实验教学,而且反应后的产物也极易分离。
我校有机实验室从2000年开始一直进行实验方法和实验内容的改革。通过多年历届学生上千次的试验验证,达到了学生实验的相关要求和实验效果。
实验部分
1.1 实验试剂及仪器
环己醇(AR)、过氧化氢(cp)、氯化铜(AR)、无水乙醚、氯化钠。常用有机合成仪器。
1.2 实验步骤
1.2.1 常量实验
在250mL圆底烧瓶中,放置60mL冰水,慢慢加入10mL的浓硫酸,充分混合后,小心加入10.5mL(0.2mol)环己醇,在上述溶液中放入一支温度计,将溶液冷至30℃以下。
在烧杯中将21g Na2Cr2O7(0.07mol)溶于12mL水中,将此溶液分数批加入圆底烧瓶中,不断振摇使充分混合。氧化反应开始后,混合物迅速变热,并且澄红色的重铬酸盐变成墨绿色的低价铬盐。当瓶内温度达55℃时,可在冷水浴中适当冷却,控制反应温度55~60℃之间,待前一批重铬酸盐的澄红色完全消失后,再加下一批,加完后继续振摇,直至温度有自动下降的趋势为止。然后加入少量草酸(约1g),使反应液完全变成墨绿色,以破坏过量重铬酸盐。
在圆底烧瓶内加入100mL水,再加几粒沸石,装成蒸馏装置,将环已酮和水一起蒸馏出来,约收集80~100mL,用食盐(15~20g)饱和溶液,在分液漏斗中静置后分出有机层,用无水K2CO3干燥约15min。将干燥过的液体倒入60mL蒸馏烧瓶中,用空气冷凝管装成蒸馏装置,收集150~156℃的馏分,测其沸点和折光率,称重并计算产率[3]。
1.2.2 改进后的实验
在带有温度计、球形冷凝管、恒压滴液漏斗的250mL的三口烧瓶中加入10.5mL环己醇,2.0 g CuCl2,用恒压滴液漏斗慢慢滴加13.5 mL过氧化氢(30%),反应温度80 ℃,反应时间 70min。反应完成后在加入 50mL 水,改成蒸馏装置,将环己酮和水一起蒸出得到流出液;流出液用精盐饱和后,转入分液漏斗,静置分出有机层,用无水K2CO3干燥约15min。将干燥过的液体倒入蒸馏烧瓶中,用空气冷凝管装成蒸馏装置,收集150~156℃的馏分,得到产物。
1.2.3 半微量实验
本实验可以进行半微量实验的改造,对于实验能力强,操作娴熟的学生,可以采用1/6量实验,进行微量操作,也可以达到实验的要求[2]。
2 结果与讨论
2.1 催化剂用量对产率的影响
用 10.5mL 环己醇,13.5mL H2O2(100mmol),不同质量的 CuCl2,在75 ~80℃温度条件下,反应70min,研究催化剂CuCl2对实验产率的影响,实验结果见表1。
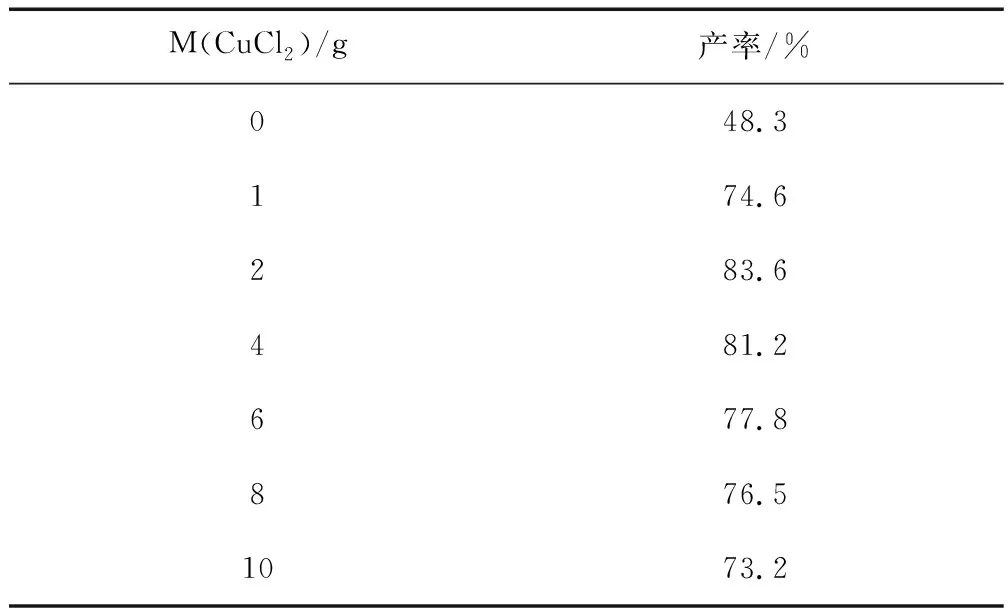
表1 催化剂用量对产率影响
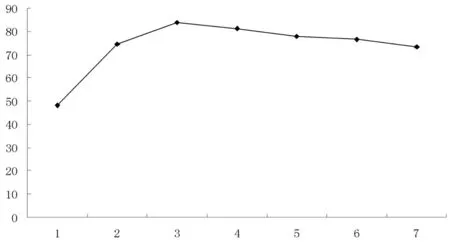
图1 催化剂用量对产率的影响曲线
图1可见,无催化剂时,环己酮产率仅为 48.3%,催化剂用量为2 g时,氧化产率最高。
2.2 过氧化氢用量对产率的影响
用10.5mL环己醇不同体积的H2O2,2g CuCl2,在75 ~80℃温度条件下,反应70min,研究过氧化氢对实验产率的影响,实验结果见表 2。
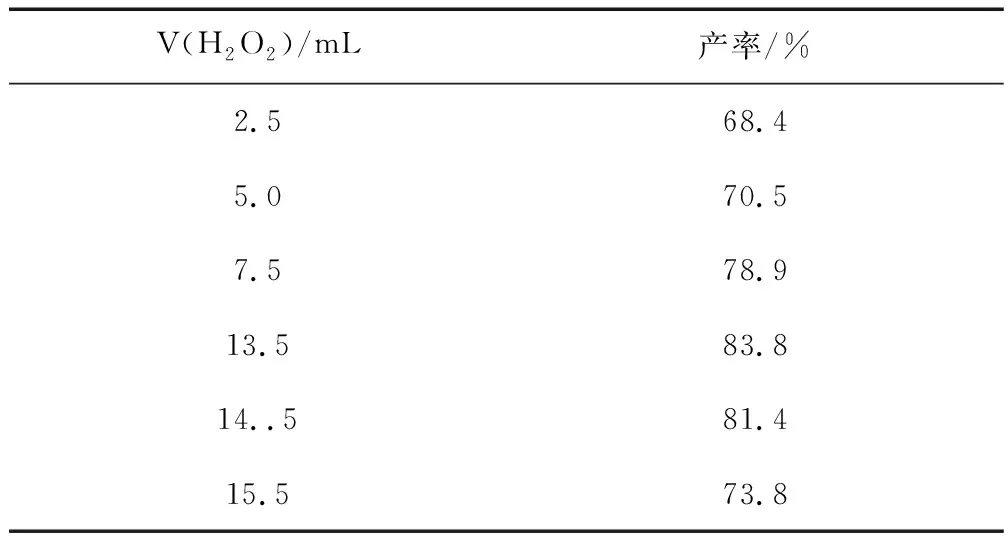
表2 过氧化氢用量对产率的影响

图2 过氧化氢用量对产率的影响曲线
通过图2可以看出, 当过氧化氢13.5mL是产率最高。随着过氧化氢用量增加产率慢慢升高,当达到最大值以后,过氧化氢再进一步增加产率反而下降。分析为生成的环己酮进一步氧化生成己二酸而使产率下降,因此本试验使用13.5mL H2O2作为反应量。
2.3 反应时间对产率的影响
用 10.5mL环己醇13.5mL H2O2(100mmol),2g CuCl2,在75~80℃温度条件下,变化反应时间,研究反应时间对实验产率的影响,实验结果见表 3。
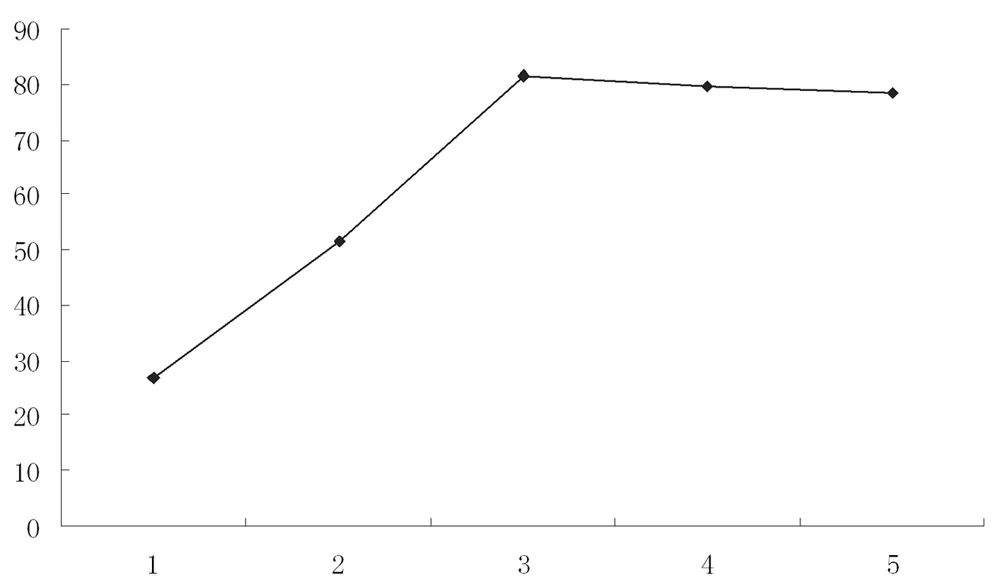
图3 反应时间对产率的影响曲线
由图3中看,当反应时间为70 min时环己酮的产率最高。因此本实验采用70min作为反应时间。
2.4 反应温度对产率的影响
用10.5mL环己醇13.5mL H2O2(100mmol),2g CuCl2,在不同的温度条件下,反应70min,研究催化剂CuCl2对实验产率的影响, 实验结果见表 4。
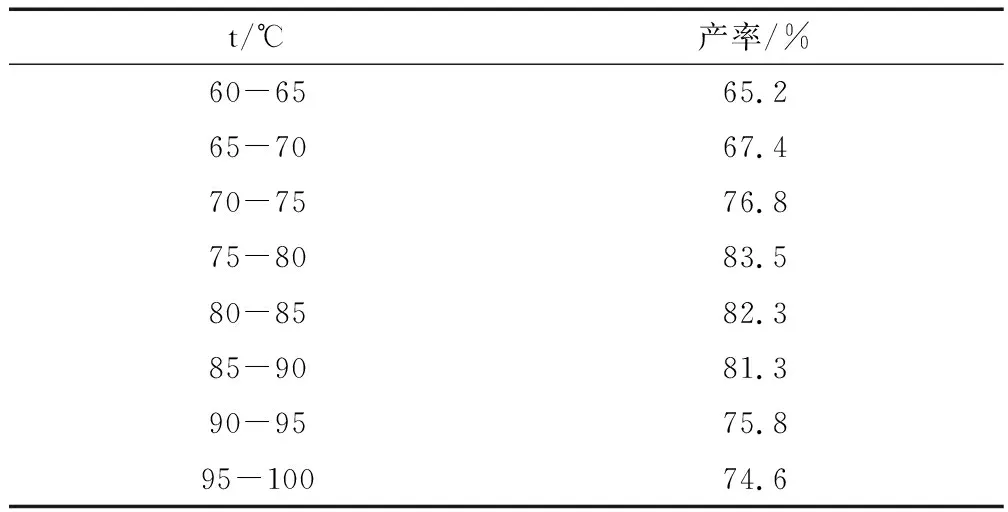
表4 反应温度对产率的影响
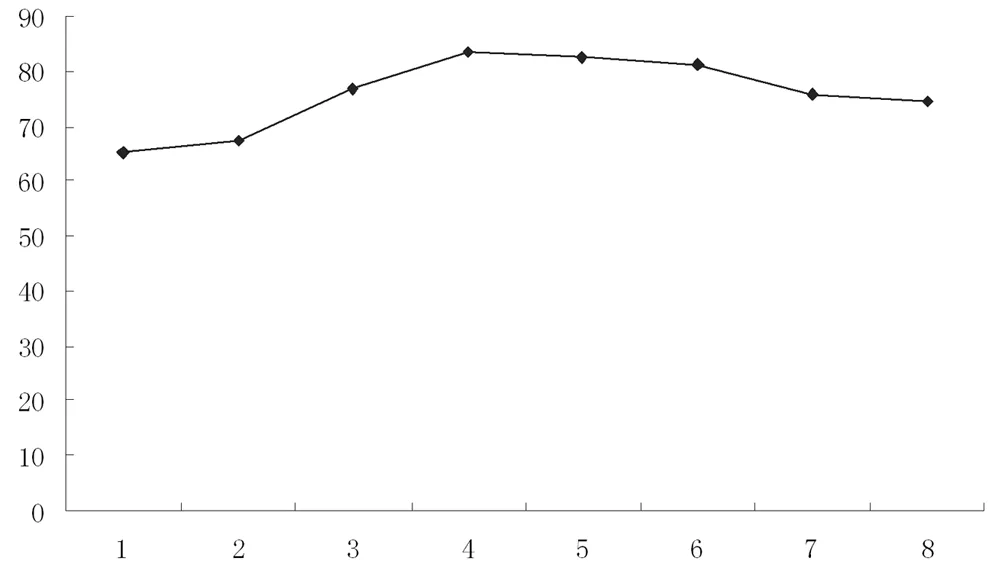
图4 反应温度对产率的影响曲线
由表4可以看出,反应温度达到75~80℃时,环己酮的产率最高。通过曲线发现随着反应温度提高,环己酮的产率增加;当达到最大值后,再提高反应温度,环己酮的产率又下降,这是因为温度过高会使生成的环己酮深度氧化为己二酸。本实验较适宜的反应温度为75~80℃。
3 结论
通过实验验证,学生实际操作,建议用于学生实验工艺参数为:10.5 mL环己醇,13.5 mL 过氧化氢(30 %),2.0 g CuCl2,反应温度80℃,反应时间 70 min。
该条件下,学生在70min内,可以完成制备过程,相比较于传统硫酸,重铬酸钠催化氧化制备产率高,反应时间短,产生的污染物质少,是一种可行的学生合成实验方法。
