创伤性脑损伤后核因子E2相关因子2在星形胶质细胞中的表达
2018-12-12李洪鹏
刘 璐 李 丹 刘 囡 张 卓 高 超 李洪鹏
(中国医科大学基础医学院解剖学教研室,沈阳 110013)
创伤性脑损伤(traumatic brain injury,TBI)是由外力引起的脑挫伤而导致神经功能障碍[1]。TBI最初会引起机械性损伤,而后会造成继发性损伤,例如氧化应激[2]。尽管TBI发生后可以通过手术,诊断技术来预防处理,但目前没有有效的药物能够治疗由继发性脑损伤造成的神经损伤[3]。TBI引起的继发性损伤中氧化应激占据重要位置[4],而核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)信号通路在抗氧化方面起着核心作用。在基础情况下,Nrf2定位在细胞质并被它的抑制剂kelch样ECH相关蛋白1(Keap1)固定[5]。在氧化应激状态下,Nrf2与Keap1分离,通过和抗氧化反应原件ARE反应,迁移入核并参与调解抗氧化基因的表达,如血红素加氧酶(Heme oxygenase-1,HO-1)[5]。据研究星形胶质细胞对TBI后的组织修复和突触重塑有作用,并能减轻TBI造成的后遗症[6]。在胶质细胞和神经元共培养的模型中发现显示,Nrf2主要在星形胶质细胞中表达,而且会促进下游蛋白HO-1等抗氧化酶表达,抵抗氧化应激,发挥其神经保护作用[7]。本研究以黑质纹状体通路损伤为模型探究创伤性脑损伤后Nrf2在星形胶质细胞中的表达情况,进而了解胶质细胞与Nrf2信号通路的关系,为神经功能恢复提供依据。
1 材料和方法
1.1 实验动物及分组
清洁级4~5周雄性昆明(KM)小鼠,25~30g,将小鼠随机分为组:假手术组(sham组),TBI后1d组,4d 组,7d组,每组12只,其中6只用于免疫荧光染色等形态学观察,6只用于制作免疫印迹检测。脑损伤后会出现部分小鼠死亡,将按计划数量进行补充。
1.2 模型制备及取材
创伤性脑损伤的模型为黑质纹状体通路损伤[8]。称量小鼠体质量,按照体质量(0.03ml/10g)行腹腔注射10%水合氯醛进行麻醉,剪毛后固定于脑立体定位仪(成都泰盟)上。以门齿低于耳杆3mm为标准进行固定,将长为2mm的切刀固定于立体定位仪上。消毒后剪开头皮,去除顶骨骨膜,找到前囟点,在颅骨中线右侧0.5mm,前囟点后方1.5mm处标记,用骨钻钻开一个长为2mm的长方形开口,暴露大脑。在标记处插入切刀,深度约5.5mm。最后缓慢拔出切刀,时刻关注小鼠呼吸,棉球止血后进行缝合。假手术组只暴露颅骨。损伤后1、4、7d各组进行灌流取材。每组进行免疫印迹检测的小鼠经心灌流0.9% Nacl后断头取出新鲜脑组织,-80℃储存,以备进行后续蛋白浓度检测实验。进行免疫荧光染色的小鼠先经心脏灌流0.9% Nacl后,继续用4%多聚甲醛心脏灌流固定后取出脑组织,再放入4%多聚甲醛中固定过夜。然后将脑组织转入到30%蔗糖溶液中进行沉糖1~2d直至脑组织沉底。再经冰冻切片机(德国莱卡)切片为10μm厚的水平脑组织切片,-20℃储存,以备免疫荧光染色实验。
1.3 免疫印迹检测
以新鲜脑组织损伤处为中心,取其上下1mm的组织,重0.07~0.09g之间,加入1ml生理盐水置于冰上进行剪碎,离心,倒掉含有血液的生理盐水,继续加入1ml生理盐水剪碎,离心。重复此操作,直到将血液去除干净。按比例加入RIPA裂解液(碧云天生物技术公司),蛋白酶抑制剂PMSF(碧云天生物技术公司)和磷酸酶抑制剂(碧云天生物技术公司)。再经过超生粉碎机粉碎后静置于冰上30min,12000r/min 4℃离心30min,取上清液。按BCA试剂盒(碧云天生物技术公司)说明书将样品加入96孔板进行蛋白浓度的测定,以蛋白质量为30μg/50μg除以浓度计算出所需要的体积。每次上样量为10μl,减去所求出的样品体积,其余用loading和PBS补齐;再将样品放入100℃5min,分装后存放于-80℃。SDS-PAGE凝胶试剂盒(碧云天生物技术公司)配制10%浓度分离胶,5%浓缩胶,蛋白上样量为10μl,Bio-Rad电泳仪进行电泳,80V浓缩胶,120V分离胶至分离胶底部。取出凝胶后使用Bio-Rad免疫印迹湿转法,将蛋白转至PVDF膜(Millipore),5%BSA进行37℃封闭1h,然后洗膜3次,加入所需一抗4℃过夜,所有一抗都使用1%BSA配制。所需一抗有Rabbit anti-Nrf2(美国Proteintech公司,1∶1000),Rabbit anti-胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP) (Abcam Cambridge,UK,1∶3000),Rabbit anti-GAPDH (Abcam Cambridge,UK,1∶5000)。次日洗膜3次,加入HRP标记山羊抗兔(美国Proteintech公司,1∶5000)于37℃恒温箱孵育90min。避光配制ECL发光液,发光观察条带。应用Image J进行灰度值分析,Nrf2,GAPDH与内参GAPDH灰度值的比值可作为Nrf2的表达量。
1.4 免疫荧光染色法
-20℃取出切片室温放置15min,PBS洗3次,每次5min,加入Triton X-100进行透膜10min,PBS洗3次,每次5min,后用1%BSA于37℃孵育30min,擦干封闭液,加入由PBS配制的Rabbit anti-Nrf2(美国Proteintech公司,1∶100)和Chick anti-GFAP(美国Millipore,1∶500)一抗混合液,4℃过夜。次日PBS洗3次,每次3min,在暗室中配制并加入由FITC 488 (Invitrogen,Goat anti-Rabbit,1∶100)和cy3(Invitrogen,anti-Chick 1∶200)制成的二抗混合液后于37℃孵育1h。取出后在暗室中PBS洗3次,每次10min,加入DAPI 3~5min,PBS洗3次,每次10min,加入抗荧光淬灭剂进行封片,使用荧光显微镜(Nikon,ECLIPSE 80i,日本)观察脑片,CCD Spot camera将图片进行采集,后由Adobe Photoshop CS6将图片进行处理修整。
1.5 统计学处理
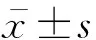
2 结果
2.1 创伤性脑损伤后各时间点Nrf2和GFAP的表达
免疫印迹结果显示(图1A),与假手术组相比,创伤性脑损伤1d时Nrf2表达开始上升,4d达到高峰,但7d时有所下降,差异具有统计学意义(P<0.05)。与假手术组相比,星形胶质细胞标志物-GFAP损伤后1d时(P<0.05)、4d时(P<0.01)升高;与损伤后1d组相比,损伤后4d时(P<0.05)升高;与损伤后4d组相比,损伤后7d时下降(P<0.05),差异具有统计学意义(图1B)。
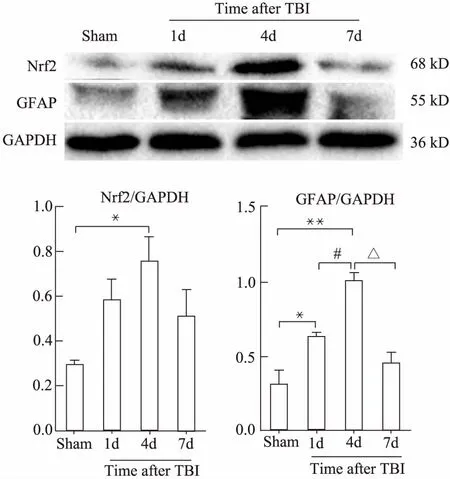
图1 创伤性脑损伤后Nrf2、GFAP蛋白的表达Fig 1 The expression of Nrf2,GFAP protein after traumatic brain injuryA:The expression of Nrf2 and GFAP protein by Western blotting; B:The integrate option density of Nrf2 and GFAP/GAPDH.*P<0.05,**P<0.01 vs sham;#P<0.05 vs the 1d group;△P<0.05 vs the 4d group
2.2 创伤性脑损伤后Nrf2在星形胶质细胞内的定位表达
Nrf2(绿色)、GFAP(红色)、细胞核(蓝色)免疫荧光双标染色法结果显示,在假手术组中(图2A~2D),Nrf2呈现出阴性表达或表达较弱,细胞质有少量表达,未见在核内有表达;损伤后(图2),Nrf2的阳性表达明显升高,损伤1d时Nrf2在细胞质和细胞核均有表达,4d时入核明显,在细胞核中的表达显著增高。

图2 假手术组(2A~2D),损伤后1d组(3A~3D)、4d组(4A~4D)和7d组(5A~5D)中Nrf2在星形胶质细胞中的表达,×40Fig 2 The expression of Nrf2 in astrocytes at the sham group (2A-2D),the 1d group after brain injury (3A-3D), the 4d group after brain injury (4A-4D),the 7d group after brain injury (5A-5D),×40A:DAPI staining; B:Nrf2 staining; C:Location of Nrf2 in nucleus; D:Overlapping for Fig A,Fig B and Fig C
3 讨论
本研究通过应用黑质纹状体通路损伤模型模拟创伤性脑损伤,免疫印迹结果显示损伤后1h损伤周围组织中Nrf2表达增加,4d时表达达到高峰,7d时有所减少。免疫荧光双重染色结果显示损伤后1d,Nrf2表达升高且定位在细胞核中;4d时,在细胞质和细胞核中阳性表达均有显著增加,且入核效果显著;7d时表达有所减弱。由此推断可能是Nrf2信号通路活化后进而激活下游的Ⅱ相解毒酶发挥了抗氧化作用。
星形胶质细胞广泛存在于中枢神经系统中,它能够支持神经元迁移并能为神经元提供营养,参与神经系统的修复和再生。但脑损伤后星形胶质细胞会发生增殖活化[9],活化形成的反应性星形胶质细胞可分泌炎症因子阻碍神经功能恢复[10]。近年来,Nrf2作为细胞抗氧化反应的一个重要组成部分受到越来越多的关注[5],且Nrf2已被证明在多种病理过程中扮演一种保护性分子的角色[11]。Nrf2的活化能够防止过多的氧自由基损伤脑组织[12]。研究表明Nrf2在脑损伤中起到神经保护作用[13],且Nrf2敲除后可导致小鼠脑损伤加重[14]。多种脑保护药物的应用是建立在通过激活Nrf2来减轻脑损伤的依据之上[15-18],其神经保护机制主要在于减少脑水肿,抑制氧化应激、细胞凋亡、炎症和保护血脑屏障[5]。
本实验结果表明创伤性脑损伤能使Nrf2,GFAP表达增加,其中GFAP在1d时增加即有统计学意义,Nrf2在损伤后4d时增加有统计学意义。损伤后Nrf2会定位表达在星形胶质细胞,且在4d时入核表达明显;7d时星形胶质细胞活化表达降低说明Nrf2入核后引起相应的信号通路活化,激活下游的Ⅱ相解毒酶发挥了抗氧化作用。而具体作用机制还需要进一步探究。
