脑室腹腔分流术在儿童新型隐球菌性脑膜炎合并脑积水治疗中应用☆
2018-12-11赵彩红田培超张碧王越史丹丹石小亚姚运
赵彩红 田培超 张碧 王越 史丹丹 石小亚 姚运
新型隐球菌性脑膜炎是由新型隐球菌感染脑膜或脑实质引起的中枢神经系统感染性疾病,发病率及病死率较高,接受抗真菌治疗者病死率仍达20%~60%[1]。持续而严重的颅高压是新型隐球菌性脑膜炎患者死亡和并发症发生的首要原因[2-3],而常规降颅压药物治疗效果不佳。新型隐球菌性脑膜炎常见于免疫功能障碍患者,儿童隐球菌性脑膜炎患者的数量有限,仅占所有隐球菌病例的2%[4],接受脑室腹腔分流术(ventricular peritoneal shunt,VPS)治疗的患儿更是少见。本文回顾性分析郑州大学第一附院自2012年1月至2018年1月收治的5例免疫功能正常的新型隐球菌性脑膜炎合并脑积水患儿经VPS治疗的效果,探讨VPS在儿童隐球菌性脑膜炎中的应用。
1 资料与方法
1.1 研究对象纳入标准:①新型隐球菌性脑膜炎儿童患者;②腰穿脑脊液墨汁染色阳性和/或脑脊液真菌培养新型隐球菌阳性;③合并脑积水;④脑脊液压力均≥250 mmH2O;⑤行脑室腹腔分流术者。排除标准:①神经症状损害归因于其他神经系统疾病;②合并免疫功能缺陷性疾病。收集郑州大学第一附属医院自2012年1月至2018年1月收治的新型隐球菌性脑膜炎合并脑积水患者资料,共有5例患儿入选,其中男4例,女1例,年龄4~5岁。
1.2 资料收集收集患儿入院后临床症状、体征,术前、术后头颅CT或MRI,脑脊液检查(压力、常规生化、隐球菌计数等),置管拔管时间、脱水药物用量、导管并发症等资料(见表1)。
1.3 药物治疗患儿入院后均给予抗真菌治疗,采用诱导 /维持治疗方案。静脉注射两性霉素B 从小剂量 0.1 mg/(kg·d)开始,逐渐增加至0.5~1 mg/(kg·d),鞘内注射两性霉素 B 从 0.025 mg 逐渐加量至0.5 mg,2~3次 /周。氟康唑静脉注射剂量为 6~12 mg/(kg·d),5 氟胞嘧啶口服剂量为100 mg/(kg·d)。 治疗同时辅以 20%甘露醇降颅压(0.25~1 g/kg),每 2~6h 重复给药。
1.4脑室腹腔分流术 所有患儿在抗真菌治疗过程中出现脑积水,进行性颅内压增高,经高强度的脱水治疗颅高压症状无好转,临床症状进行性加重,行VPS。使用索菲萨8档可调压分流管,腹部外接美敦力体外引流系统。术后根据患儿临床表现、脑脊液引流情况调节引流管压力。
2 结果
2.1 治疗结果1例(患者4号)术后病情无好转死亡。余4例头痛、呕吐均于术后3~7 d消失,1例腹痛者术后3 d消失,2例术前嗜睡患儿术后2 d意识恢复正常,3例抽搐者术后得到控制,1例失明者术后82 d视力完全恢复正常。所有患儿术后1周内脱水药物均大幅减少。
2.2 辅助检查5例患儿术后脑脊液压力明显下降,隐球菌数量明显减少,白细胞、蛋白、糖、氯化物变化不大。除4号患儿病情较重,脑积水无明显改善外,余4例患儿头颅MRI示脑积水均明显减轻(表 2)。
2.3 并发症1例(患者3号)患儿术后出现头痛,引流管堵塞,考虑脑脊液蛋白质浓度较高且儿童脑脊液引流管直径较小相关。1例术后出现发热,脑脊液培养提示细菌感染,考虑置管时间较长且患儿引流管护理依从性差相关,予拔管及抗炎治疗后症状缓解。
2.4 随访结果1例死亡,余4例均病情明显好转后出院,院外随访3~24个月,3例已完全恢复正常学习生活,1例遗留有轻度肢体运动障碍,日常生活可自理。
3 讨论
新型隐球菌为条件致病菌,主要感染免疫功能低下的人群,如艾滋病、器官移植、长期应用糖皮质激素或免疫抑制剂患者,儿童中少见。而隐球菌在人类身上有嗜中枢性,易穿透血脑屏障致中枢神经系统感染[5],隐球菌性脑膜炎是隐球菌病最致命的一种。本研究中5例患儿免疫功能均正常。
新型隐球菌性脑膜炎合并脑积水最严重的并发症为难以控制的颅内高压,定义为脑脊液(cerebrospinal fluid,CSF)开放压力≥250 mmH2O,并通常被认为与CSF中的高真菌负荷有关[6]。人体脑脊液主要产生于侧脑室脉络丛,并通过第三和第四脑室循环进入与蛛网膜下腔直接相通的脑池腔。目前隐球菌性脑膜炎性颅高压机制可能为:①隐球菌荚膜多糖及菌体的积聚堵塞蛛网膜颗粒,导致CSF的再吸收受损;②新型隐球菌引起的炎症反应造成蛛网膜绒毛的堵塞及血管通透性增加,进一步加重了脑脊液的循环障碍;③隐球菌荚膜多糖的积累可能增加脑脊液和间质液的渗透压,从而通过细胞外液的积聚促进脑水肿和颅内压升高[7];④新生隐球菌具有多种致病因素,如尿素酶,甘露醇和肌醇,这些因素与脑水肿和脑脊液渗透压增加有关[7]。本研究5例患儿中头颅MRI均提示有脑室系统扩大,3例提示侧脑室扩大,1例提示第四脑室扩大,1例为幕上性脑积水(交通性脑积水),除1例(4号)病情较重无好转外,余VPS术后复查头颅MRI扩大的脑室系统明显减小。
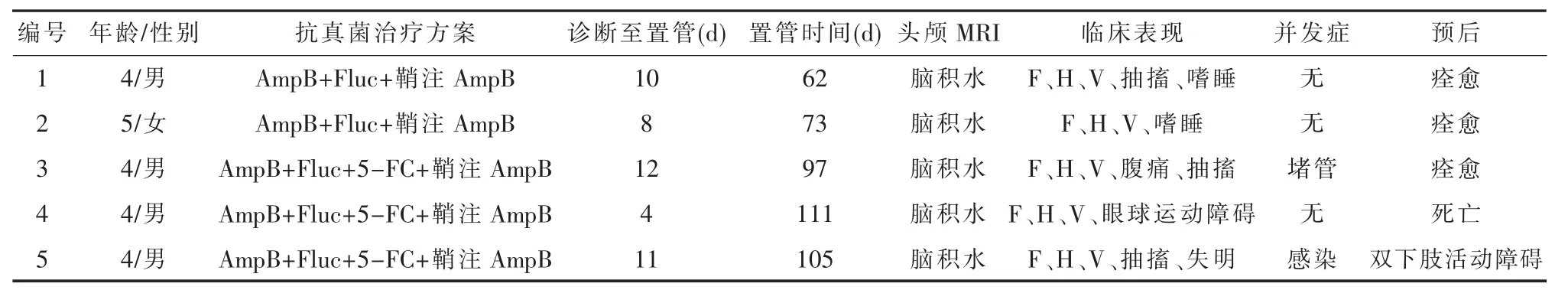
表1 5例新型隐球菌性脑膜炎患者临床资料

表2 患者VPS术前术后脑脊液检查及甘露醇用量情况对比
新型隐球菌感染中枢神经系统后可累及脑膜和/或脑实质,导致严重和永久性的神经功能缺损。临床主要表现包括发热、头痛 、惊厥、偏瘫、精神障碍、共济失调等[8],多达50%的患者有不同程度视力损害,大部分发生在疾病的2~4周内[9]。视力丧失的机制仍不确定,可能为隐球菌通过升高的颅内压间接损害视神经和其他颅神经,或者直接侵入视神经。一些视力和听力等颅神经损害的患者由于长期颅高压而不可逆。本组研究中,所有患者术后头痛、意识障碍改善明显,1例术前失明患者术后恢复正常,1例(4号)术前眼球活动障碍者因病情较重不可逆。
隐球菌脑膜炎治疗的目标是减少真菌负担并预防不可逆性神经损伤。控制颅高压有多种治疗方法,如药物治疗、重复腰椎穿刺、侧脑室外引流、腰大池置管引流、Ommaya囊植入术及VPS。恶性颅高压单纯药物治疗往往难以控制。早期腰大池置管外引流或侧脑室外引流,可有效降低颅高压,但外引流时间长易继发感染,还有可能因引流造成颅压不均,诱发脑疝形成。而Ommaya囊植入术与VPS术疗效相仿,手术创伤差别不大,却需多次反复经皮穿刺,亦易引起继发感染。脑室腹腔分流术是一种在侧脑室和腹腔之间置管的内引流术式。美国感染学会(IDSA)在2010年重新修订的隐球菌病治疗指南中推荐存在脑脊液梗阻、脑积水及长期的颅内压升高患者使用VPS。VPS治疗隐球菌性脑膜炎合并脑积水:①可以大幅降低颅内压,为抗真菌治疗赢得时间;②将大量带菌的脑脊液引至腹腔,减少颅内隐球菌数量。③改善患者意识、视力、听力等症状,避免永久性功能丧失;④减少脱水药物的使用,减少了肾功能损害的 副作用。在无法控制脑积水的患者中,实行VPS术的最佳时机存在争议,但一般来说,必须在开始最佳抗真菌治疗之后放置器械[10]。大多数研究小组建议早期分流以避免永久性神经损伤。WOODWORTH及NEGRONI等学者认为颅内高压是隐球菌性脑膜炎患者的严重并发症,即使在神经影像学检查未发现脑积水,也可以放置VP分流器进行充分治疗[11-12]。然而,部分研究组建议分流应延迟至控制感染以避免分流故障或通过分流传播感染[13]。本研究在抗真菌治疗的早期行VPS,治愈率为80%(4/5),可明显观察到术后临床症状改善,脑脊液中隐球菌数量下降,以及降颅压药物的减量。
脑室腹腔分流术的常见并发症有:①分流管堵塞;②分流术后感染;③过度分流。本研究采用可调压分流管,未出现过度分流情况,其中1例(3号)出现引流管堵塞,考虑引流液蛋白质浓度较高及分流管直径较小相关,1例(5号)术后90 d出现发热,脑脊液培养提示细菌感染,考虑引流时间较长,予拔管及抗感染治疗后症状好转,无腹腔感染扩散发生。本研究中VPS术后并发症少且可控,是安全的。
本研究中早期行VPS可以减轻脑积水,改善隐脑患者的临床症状,治疗效果良好,希望可以为临床提供一些治疗经验。结合既往文献资料我们认为在抗真菌治疗的早期行VPS治疗可能是有益和必要的。本研究样本量有限,进行多中心研究和更大样本量的进一步研究将更具说服力。
