低温胁迫下不同无核葡萄品种抗寒性的分析
2018-12-11李桂荣连艳会程珊珊辛董董牛生洋扈惠灵
李桂荣,连艳会,程珊珊,辛董董,牛生洋,扈惠灵
(河南科技学院园艺园林学院,河南新乡 453003)
【研究意义】葡萄(Vitis vinifera L.)属于葡萄 科,为落叶藤本植物,是世界最古老的植物之一。随着人们生活水平的提高,葡萄越来越受广大人民喜爱,在全球,葡萄生产和葡萄栽培面积越来越广。然而,我国北方地区气候差异大,低温是限制我国北方葡萄分布与生长的重要因素,对葡萄越冬栽培生产造成一定的损失,最终,葡萄产量下降,品质不佳。为了能够满足不同区域适宜栽培的葡萄品种,提高葡萄品质,近年来,在葡萄抗寒性方面做了大量的研究。【前人研究进展】卢精林等[1]认为抗寒性的砧木品种电导率,POD,CAT,SOD,可溶糖含量和丙二醛,与抗寒性关系密切,可作为抗寒性的鉴定指标。钟海霞等[2]研究不同葡萄品种根系抗寒力的强弱比较,认为电导率,可溶性糖,可溶性蛋白,游离脯氨酸和丙二醛等生理指标可以作为抗寒性鉴定指标。【本研究切入点】本试验以山葡萄,贝达和北醇为对照,3个无核葡萄品种(粉红无核、优无核、京早晶)为试材,测定相对电导率、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、可溶性蛋白、可溶性糖、丙二醛(MDA)和游离脯氨酸的含量,分析不同葡萄品种抗寒力大小,并通过灰色关联,研究不同抗寒指标与抗寒性的关系。【拟解决的关键问题】为北方冬季低温地区葡萄引种、杂交育种、种质筛选以及抗寒新品种栽培提供科学理论依据。
1 材料与方法
1.1 供试材料
通过不同品种的生物学性状比较,于中国农科院郑州果树研究所种质资源圃中选出6种葡萄品种材料进行试验研究,分别为:山葡萄、贝达、北醇、京早晶、优无核和粉红无核。以一年生休眠枝条为试验材料,粗0.5~1 cm,长20~50 cm长势较好的健壮、无病虫害的枝条进行标记沙藏,材料处理前取出并放在4℃冰箱中保存备用。
1.2 试验设计
将材料先用自来水冲洗3次,再用去离子水冲洗3次,放在滤纸上吸干水分,材料按不同品种均匀分成7份,用保鲜膜包好,并用吊牌进行标记,分别在7个温度(4、-5、-10、-15、-20、-25、-30℃)下进行低温处理,以4℃/h的速度降到处理温度并保持24 h,再以4℃/h的速度解冻,每0.5 h回升1个梯度,最终置于4℃冰箱中备用,测定其相关生理指标。
1.3 测定方法
采用电导率仪(DDSJ-308A)进行电导率的测定[3],氮蓝四唑法(NBT)进行超氧化物歧化酶(SOD)活性的测定[4],愈创木酚法进行过氧化物酶(POD)活性的测定[4],紫外吸收法进行过氧化氢酶(CAT)测定活性测定[4],考马斯亮蓝法进行可溶性蛋白含量的测定[5],蒽酮法进行可溶性糖含量测定[5],硫代巴比妥酸法(TBA)进行丙二醛(MDA)含量测定[6],茚三酮比色法进行游离脯氨酸含量的测定[6]。
1.4 数据分析
用Microsoft Office Excel 2010软件进行统计分析和DPS软件(15.10)进行数据分析。
2 结果与分析
2.1 低温胁迫下葡萄枝条电导率的测定
从图1可以看出,各材料总体趋势逐渐升高,呈现一定的变化规律,-15~-25℃下,粉红无核、优无核和京早晶出现跃升,山葡萄、贝达和北醇变化趋势不明显,当温度达到-25℃时,粉红无核上升至61.29%,优无核由上升至71.31%,京早晶上升至72.21%,山葡萄上升至 40.55%,贝达上升至42.36%,北醇上升至44.07%。京早晶、优无核和粉红无核在初遇低温时电解质渗出率稍有上升,有可能是枝条内部细胞的自我保护作用,随着处理温度的降低,在-25℃时电导率急剧上升,说明枝条内部细胞已经受到明显的伤害,膜透性丧失功能。山葡萄、贝达和北醇变化趋势仍不明显。由试验结果看出,随处理温度的降低,原生质膜透性逐渐增大,当电解质渗出率达到100%时,质膜完全破坏[7]。
2.2 logistic方程拟合葡萄低温半致死温度
由表1可以看出,方程的相关回归系数在0.7544~0.8617,经检验表明,Logistic方程拟合度R2显著,半致死温度在-10.39~ -37.83℃。其中山葡萄、贝达和北醇抗寒性较强,山葡萄的半致死温度为-37.83℃,贝达的半致死温度为-36.01℃,北醇的半致死温度为-31.88℃,可知山葡萄抗寒性最强,细胞伤害率最低,抵御低于外界低温能力强,其次是贝达和北醇。而优无核和粉红无核抗寒性较低,优无核半致死温度为-14.13℃,粉红无核半致死温度为-14.89℃,可知粉红无核和优无核的细胞伤害率较大,抵御外界低温能力较低。抗寒性最弱的为京早晶,半致死温度为-10.39℃,细胞伤害率最大,抵御外界能力最低。所得半致死温度与电解质渗出率结论一致。由Logistic方程计算出的半致死温度可以看出抗寒性大小:山葡萄>贝达>北醇>粉红无核>优无核>京早晶。
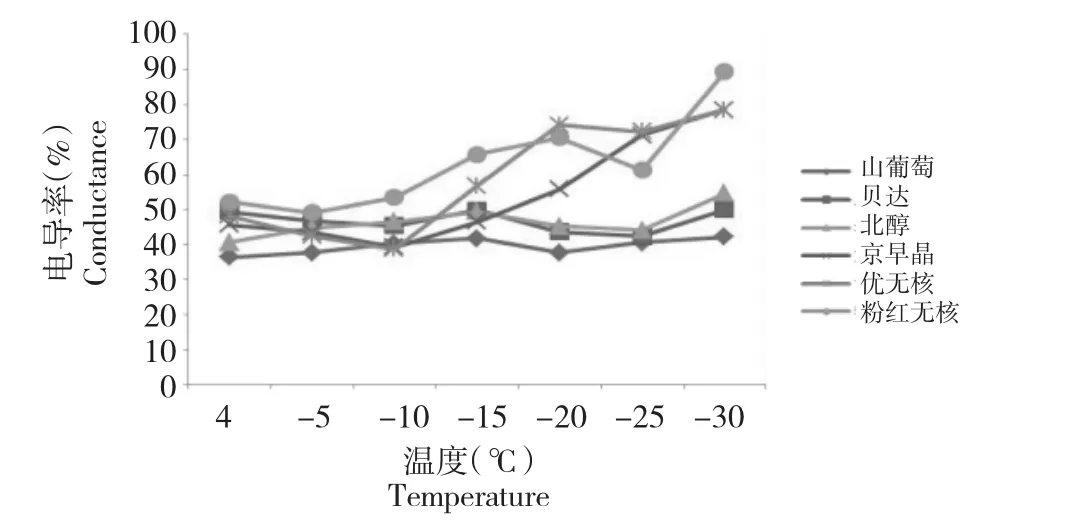
图1 低温胁迫下葡萄枝条的电解质渗出率Fig.1 Electrolyte leakage of grape branch under low temperature
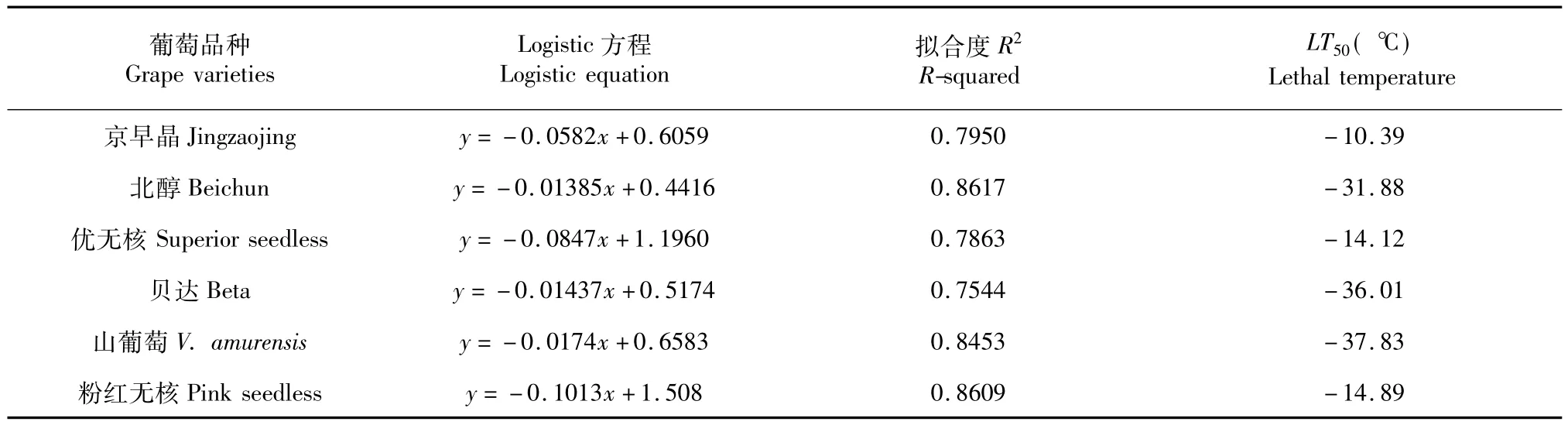
表1 低温胁迫下不同葡萄枝条半致死温度Table 1 Half lethal temperature of grape branch under low temperature
2.3 低温胁迫下葡萄枝条酶活性的分析
由表2可知,3种无核葡萄品种(京早晶、优无核、粉红无核)酶活性随温度的下降,整体为先上升后下降。其中,京早晶SOD酶活性在-20℃时有明显的升高,其酶活性从4℃(52.38±4.60)U/g上升到 -20℃的(112.07±3.73)U/g,-20 ℃后,继续上升,在 -25℃时达到最大值(137.52±5.01)U/g,之后随着处理温度的降低其酶活性开始下降,-25℃时与其他温度相比差异显著,P<0.05且P<0.01,这说明在-25℃时酶抵御低温的能力达到最大,之后酶活性丧失;POD酶活性和CAT酶活性在-20℃下,POD酶活性达到最大值(11.33±0.13)U/g·min,由(3.26 ±0.17)U/g·min 上升到(11.33 ±0.13)U/g·min,CAT 酶活性达到最大值(34.13 ±3.95)U/g·min,由(10.39 ±1.94)U/g·min 上升到(34.13 ±3.95)U/g·min,之后随着处理温度的降低其酶活性开始下降,-20℃时与其他温度相比差异显著,P <0.05且 P <0.01。
优无核SOD酶活性在-20℃时有明显的升高,其酶活性从4℃(55.76±3.60)U/g上升到-20℃(170.98±3.46)U/g,-20 ℃后,继续上升,在 -25 ℃时达到最大值(195.08±2.93)U/g,之后随着处理温度的降低其酶活性开始下降,-25℃时与其他温度相比差异显著,P<0.05且 P<0.01,这说明在-25℃时酶抵御低温的能力达到最大,之后酶活性丧失;POD酶活性和CAT酶活性在-20℃下,POD 酶活性达到最大值(12.43±0.13)U/g·min,由(4.27±0.03)U/g·min 上升到(12.43 ±0.13)U/g·min,CAT 酶活性达到最大值(37.14 ±3.72)U/g·min,由(14.53 ±2.89)U/g·min 上升到(37.14±3.72)U/g·min,之后随着处理温度的降低其酶活性开始下降,-20℃时与其他温度相比差异显著,P <0.05 且 P <0.01。
粉红无核的SOD酶活性在-20℃时有明显的升高,其酶活性从4℃(21.41±2.02)U/g上升到-20 ℃的(195.76±3.56)U/g,-20 ℃后,继续上升,在-25 ℃时达到最大值(219.84±5.91)U/g,之后随着处理温度的降低其酶活性开始下降,-25℃时与其他温度相比差异显著,P<0.05且 P<0.01,这说明在-25℃时酶抵御低温的能力达到最大,之后酶活性丧失;POD酶活性和CAT酶活性在-20℃下,POD酶活性达到最大值(13.14±0.14)U/g·min,由(5.14 ±0.20)U/g·min 上升到(13.14 ±0.14)U/g·min,CAT酶活性达到最大值(38.04±2.33)U/g·min,由(8.15 ±1.16)U/g·min 上升到(38.04 ±2.33)U/g·min,之后随着处理温度的降低其酶活性开始下降,-20℃时与其他温度相比差异显著,P <0.05且P <0.01。
3种对照葡萄品种(山葡萄、贝达、北醇)酶活性随温度的降低总体趋势为先上升后下降。其中,山葡萄的SOD酶活性在-20℃时有明显的升高,其酶活性从4℃(120.32±1.6)U/g上升到-20℃的(268.77±3.33)U/g,-20 ℃后,继续上升,在 -25℃时达到最大值(310.05±1.96)U/g,之后随着处理温度的降低其酶活性开始下降,-25℃时与其他温度相比差异显著,P<0.05且 P<0.01,这说明在-25℃时酶抵御低温的能力达到最大,之后酶活性丧失;POD酶活性和CAT酶活性在-20℃下,POD酶活性达到最大值(16.13 ±0.15)U/g·min,由(7.83 ±0.37)U/g·min上升到(16.13 ±0.15)U/g·min,CAT 酶活性达到最大值(55.32 ±3.53)U/g·min,由(25.93 ±1.93)U/g·min 上升到(55.32±3.53)U/g·min,之后随着处理温度的降低其酶活性开始下降,-20℃时与其他温度相比差异显著,P <0.05 且 P <0.01。
贝达的SOD酶活性在-20℃时有明显的升高,其酶活性从4℃(115.77±2.6)U/g上升到 -20℃的(164.83 ±3.8)U/g,-20 ℃后,继续上升,在-25 ℃时达到最大值(270.32 ±3.7)U/g,之后随着处理温度的降低其酶活性开始下降,-25℃时与其他温度相比差异显著,P<0.05且 P<0.01,这说明在-25℃时酶抵御低温的能力达到最大,之后酶活性丧失;POD酶活性和CAT酶活性在-20℃下,POD 酶活性达到最大值(14.56±0.11)U/g·min,由(6.38±0.11)U/g·min 上升到(14.56 ±0.11)U/g·min,CAT 酶活性达到最大值(47.35 ±3.1)U/g·min,由(26.14 ±3.6)U/g·min 上升到(47.35 ±3.1)U/g·min,之后随着处理温度的降低其酶活性开始下降,-20℃时与其他温度相比差异显著,P<0.05 且 P <0.01。
北醇的SOD酶活性在-20℃时有明显的升高,其酶活性从4℃(114.08±2.01)U/g上升到-20℃的(230.53±10.26)U/g,-20 ℃后,继续上升,在 -25 ℃时达到最大值(264.19±3.37)U/g,之后随着处理温度的降低其酶活性开始下降,-25℃时与其他温度相比差异显著,P<0.05且P<0.01,这说明在-25℃时酶抵御低温的能力达到最大,之后酶活性丧失;POD酶活性和CAT酶活性在-20℃下,POD酶活性达到最大值(13.79±0.05)U/g·min,由(5.98±0.12)U/g·min上升到(13.79±0.05)U/g·min,CAT酶活性达到最大值(44.39±2.86)U/g·min,由(22.31±1.61)U/g·min上升到(44.39±2.86)U/g·min,之后随着处理温度的降低其酶活性开始下降,-20℃时与其他温度相比差异显著,P<0.05且P<0.01。
由此可知,不同葡萄品种的酶活性总体趋势呈S型曲线上升。SOD在-25℃时达到最大值,增加幅度最大,在4~-25℃时细胞系统产生了自我保护功能,这种保护能力逐渐上升,超过-25℃时,这种保护能力下降,而POD和CAT在-20℃下达到最大值,增加幅度最大,超过-20℃时,细胞膜造成了严重伤害,膜系统受到破坏。不同酶保护系统性能的增强,可提高组织的抗寒性[8]。可得出供试品种的抗寒性顺序为:山葡萄>贝达>北醇>粉红无核>优无核>京早晶。
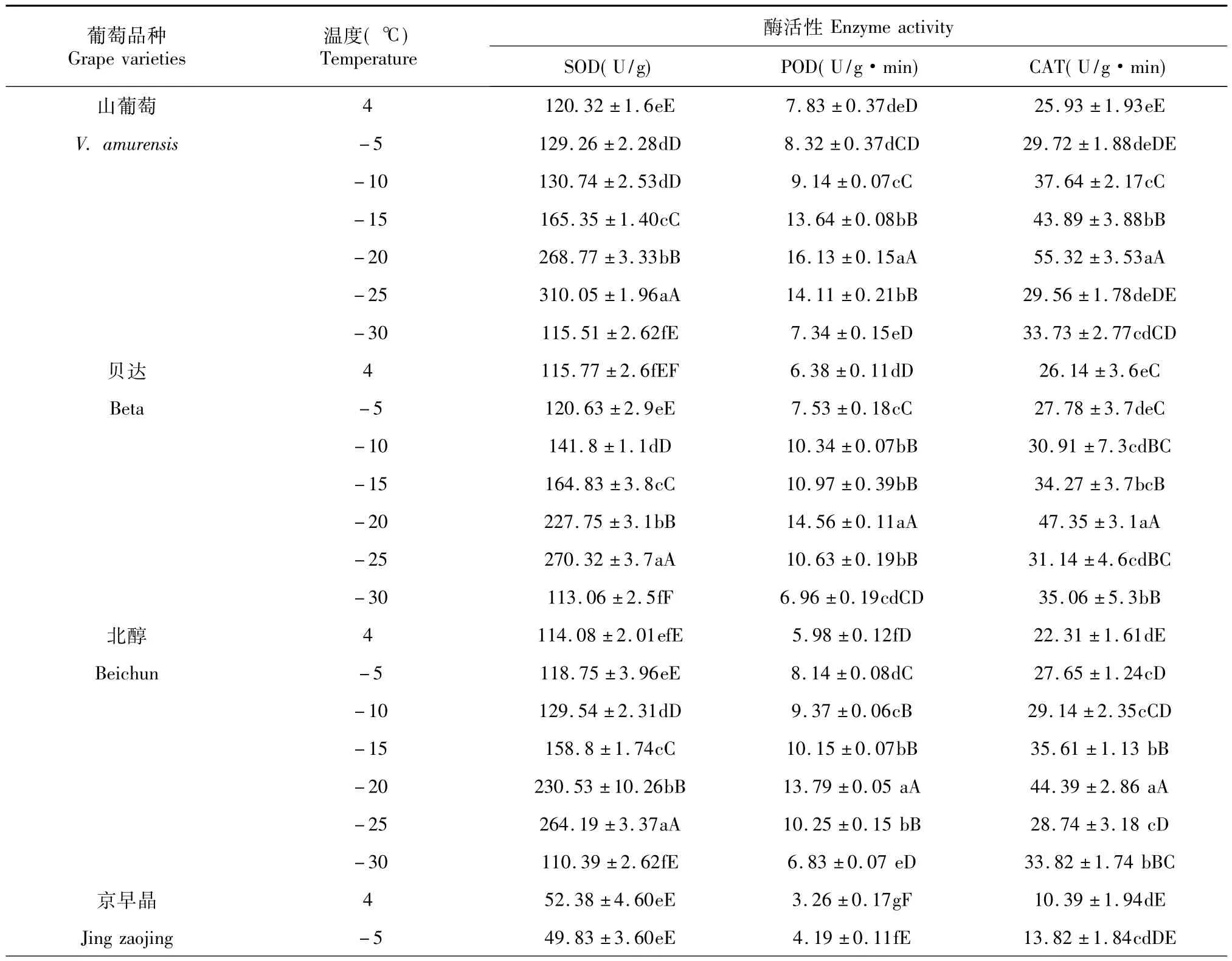
表2 低温胁迫下葡萄枝条的酶活性Table 2 Antioxidant enzyme activities of grape branch under low temperature

续表2 Continued table 2
2.4 低温胁迫下葡萄枝条的生理指标分析
由表3可知,随着胁迫温度的下降,不同葡萄品种可溶性蛋白含量出现先上升后下降的趋势,在不同温度下,抗寒性较强的葡萄品种可溶性蛋白含量增幅明显高于抗寒性弱的葡萄品种。其中,当温度降到-25℃时,对照品种(山葡萄、贝达、北醇)可溶性蛋白含量逐渐上升,山葡萄从4℃的(0.25±0.03)mg/g上升到(0.81±0.04)mg/g,达到-30℃(0.84±0.04)mg/g时差异显著,P<0.05且 P<0.01,贝达从4℃的(0.23±0.01)mg/g上升到(0.80±0.03)mg/g,达到 -30 ℃(0.81±0.03)时差异显著,P<0.05且 P<0.01,北醇从4℃的(0.23±0.06)mg/g上升到(0.71±0.02)mg/g,达到-30℃(0.72±0.02)mg/g时差异显著,P<0.05且P<0.01;无核葡萄品种(粉红无核、优无核、京早晶)-15~-25℃时可溶性蛋白含量缓慢上升,达到-30℃时差异显著,粉红无核(0.48±0.052)mg/g、优无核(0.45 ±0.01)mg/g、京早晶(0.44±0.02)mg/g,P<0.05且 P<0.01。由此可见,总体上山葡萄增幅最大,可溶性蛋白变化明显,抗寒性最强,其次,京早晶增幅最小,可溶性蛋白含量变化不明显,抗寒性最弱。
随着胁迫温度的下降,不同葡萄品种可溶性糖含量出现逐渐上升的趋势,可溶性糖含量越高,积累糖分越大,提高细胞内的渗透势,保护细胞膜系统的结构不受破坏,抗寒性越强。其中,当温度降到-25℃时,对照品种(山葡萄、贝达、北醇)可溶性糖含量逐渐上升,-30℃时差异显著,山葡萄(7.32±0.18)%、贝达(6.96±0.23)%、北醇(6.68±0.12)%,P<0.05且 P<0.01,无核葡萄品种(粉红无核、优无核、京早晶)达到-30℃时差异显著,粉红无核(4.76±0.20)%、优无核(4.84±0.13)%、京早晶(5.78±0.30)%,P<0.05且P<0.01。
随着胁迫温度的下降,不同葡萄品种MDA含量出现逐渐上升的趋势。MDA对质膜产生毒害作用,主要破坏细胞内的细胞膜系统,当枝条受低温伤害时,含量增加,达到一定程度植株死亡[8],而山葡萄、贝达和北醇的MDA含量在低温胁迫过程中明显低于其他品种,可知,山葡萄、贝达和北醇抗寒性优于其它品种。其中,当温度降到-30℃时差异显著,山葡萄(0.38±0.01)μmol/g、贝达(0.39±0.02)μmol/g、北醇(0.42 ±0.01)μmol/g,P <0.05且 P <0.01,粉红无核(0.76±0.02)μmol/g、优无核(0.72±0.01)μmol/g、京早晶(0.68±0.01)μmol/g,P <0.05且P <0.01。

表3 低温胁迫下葡萄枝条的生理指标Table 3 Physiological indexes of grape branches under low temperature

表4 山葡萄生理生化指标与抗寒性的灰色关联分析Table 4 Grey correlation analysis of physiological and biochemical indexes and cold resistance
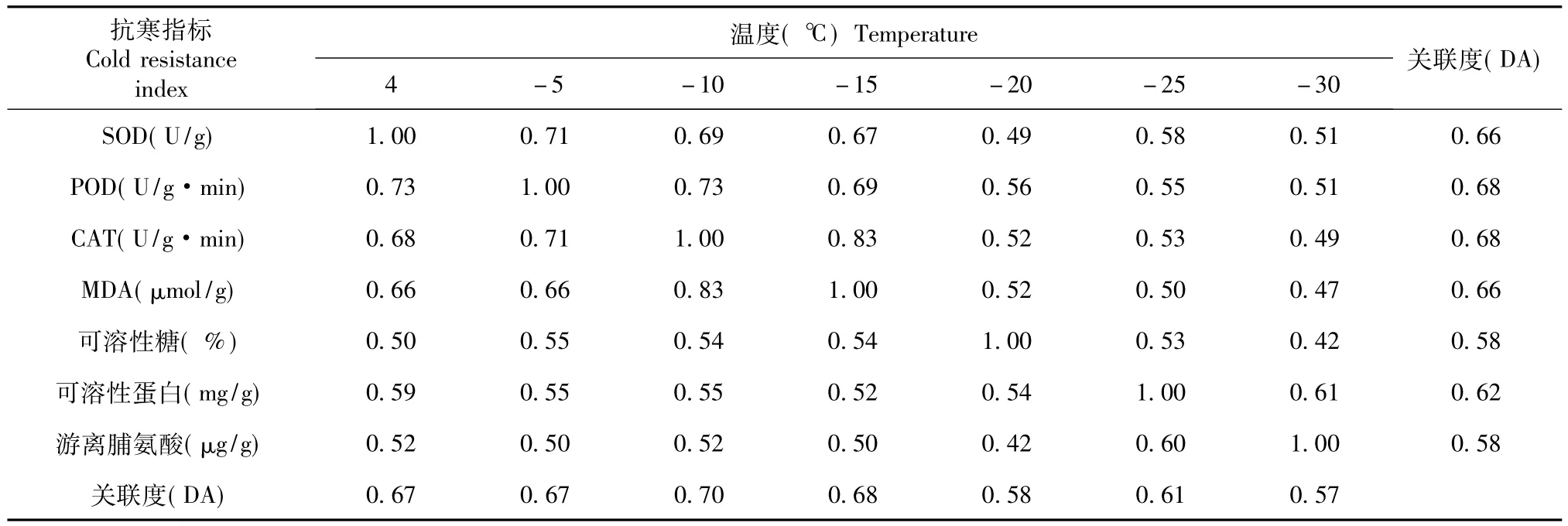
表5 京早晶生理生化指标与抗寒性的灰色关联分析Table 5 Grey correlation analysis of physiological and biochemical indexes and cold resistance
随着胁迫温度的下降,不同葡萄品种游离脯氨酸含量出现逐渐上升的趋势,由于细胞内游离脯氨酸大量积累,此时,葡萄枝条通过渗透势的降低来维持细胞膜内结构的完整。抗寒性较强的山葡萄和贝达在-25℃时,游离脯氨酸的含量达到最高,分别为(63.28±0.29)和(59.28±0.32)μg/g,P <0.05且P<0.01。而抗寒性较差的优无核和京早晶分别在-10和-15℃达到最高,分别为(39.52±0.01)和(43.31±0.05)μg/g,P<0.05且P <0.01。
2.5 不同抗寒指标灰色关联分析
为了研究葡萄枝条不同抗寒指标和抗寒性关联程度,做灰色关联分析。按灰色系统理论要求,将不同品种的抗寒指标的平均值和不同处理温度视为一个整体,即灰色系统,进行分析。
对数据进行标准化处理之后,由表4可见,和山葡萄的抗寒性关联最大的抗寒指标是CAT(0.72),其次是POD(0.70)和MDA(0.70),其他指标均在0.60以上,并且和山葡萄关联最高的温度是-25℃(0.71)。由表5可见,和京早晶抗寒性关联最大的抗寒指标是POD(0.68)和CAT(0.68),其次是SOD(0.66)、MDA(0.66),并且和京早晶关联最高的温度是-10℃。
综上可知,和所研究葡萄品种关联度最高的抗寒指标是CAT,其次是POD和MDA。
3 讨论
抗寒性是不同植物对低温寒冷环境下长期适应中通过本身的遗传变异和自然选择获得的一种抗寒能力,是果树的一个重要性状。有不少学者在果树抗寒性方面做了大量的研究。本试验发现,在电导率测定中,随着处理温度的降低,电导率整体呈逐渐升高的趋势,这与骆建霞研究的用电导法对8种地被植物抗寒性的测定结果一致[9]。在酶的测定中,随着处理温度的下降,酶活呈现先上升后下降,这与曹建东[10],鲁金星[11],曲凌慧[12]的研究一致。在可溶性糖含量的测定中,6个葡萄品种随着处理温度的降低,可溶性糖含量总体变化趋势逐渐上升,这与孟艳琼[13]和王小媚[14]研究结论一致。在丙二醛含量的测定中,随着处理温度的降低,丙二醛含量逐渐升高,这与段肖翠[15]究的低温胁迫对阿月浑子抗寒生理指标中在不同温度处理下,丙二醛含量的变化一致。在可溶性蛋白的测定中,其含量随着处理温度的降低而升高,抗寒性强的品种上升幅度快,这与牛锦凤等[16]的研究结论相一致。在游离脯氨酸的测定中,其含量也随着处理温度的降低而呈现出升高趋势,这与沈洪波[17]的研究结论一致。综上所述,相对电导率、SOD酶活性、POD酶活性、CAT酶活性、可溶性糖、可溶性蛋白、丙二醛和游离脯氨酸含量可以作为测定植物抗寒性的指标。
本试验是在人工模拟低温的条件下进行的,人工低温处理和室外自然条件有一定的差异,仅在实验室条件下进行测量具有一定的局限性,在今后的研究中我们将在室外低温的条件下进行抗寒鉴定,从而更加准确全面地反应抗寒性。
4 结论
由测得的电导率并结合Logistic方程求得不同葡萄品种半致死温度分别为:山葡萄-37.83℃,贝达-36.01℃,北醇 -31.88℃,粉红无核 -14.89℃,优无核-14.12℃,京早晶-10.39℃。除了对照品种。其余品种的致死温度均在-10~-15℃之间。
通过酶活性的测定,酶活性均呈现先升高后下降的趋势。通过理化指标的测定与分析,随着处理温度的下降,各指标含量均呈现上升趋势,并且抗寒性强的品种上升的幅度比抗寒性弱的品种上升的幅度大。其中,对抗寒指标进行灰色关联分析,得出与所研究葡萄品种关联度最高的抗寒指标是CAT,其次是POD和MDA。综合结果分析,不同葡萄品种抗寒性强弱依次为:山葡萄>贝达>北醇>粉红无核>优无核>京早晶。
