山羊FGF1基因腺病毒超表达载体的构建
2018-12-11林亚秋朱江江马洁琼
黄 凯,林亚秋,朱江江,马洁琼,王 永*
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.青藏高原动物遗传资源保护与利用四川省重点实验室,四川成都 610041)
成纤维细胞生长因子家族(Fibroblast Growth Factors,FGFs)总共有 23 个成员[1-3],是一类由垂体和下丘脑分泌的具有多种生物学功能的信号蛋白。家族各成员之间有20%~50%相同的氨基酸序列,其中心区域更有约120个氨基酸序列存在高度的同源性[4]。FGFs被证明在各种生理过程中发挥着重要作用,如胚胎发生、肿瘤形成、组织修复以及细胞的增殖、分化、迁移、凋亡等[5-6],成纤维细胞生长因子1(FGF1)是成纤维细胞生长因子家族中的一员,关于FGF1的作用研究最初主要集中在肿瘤发生等方面,关于其在脂代谢、糖尿病等方面的作用直到近几年才引起重视。Hutley等研究表明,外源性FGF1可促进人前体脂肪细胞的增殖与分化;2011年,又研究发现,FGF1能够通过抑制FGF2的表达促进人的前体脂肪细胞向脂肪细胞方向分化[7-8]。2012年,Jonker等发现高脂饮食喂养敲除FGF1的小鼠中能出现脂肪的异常增生[9]。上述研究均表明FGF1在脂代谢和脂肪细胞分化中具有重要作用,但研究主要集中于人和小鼠,在山羊中还未见报道,本实验室前期研究发现其在山羊前体脂肪细胞分化前后表达水平发生变化,推测其对山羊前体脂肪细胞的分化具有重要的调控作用。
超表达和干扰是分子生物学中研究基因功能的重要手段,因此本实验室为了最终阐明FGF1基因对山羊前体脂肪细胞分化的调控作用,需要利用上述两种手段,而目的基因超表达载体的构建是超表达研究所必须的步骤。因此本研究拟利用pAdEasy系统构建山羊FGF1超表达载体,为进一步研究其在山羊肌内前体脂肪细胞分化中的作用奠定基础。
1 材料与方法
1.1 试验动物及样品采集
本试验所用细胞由本实验室前期分离、鉴定和培养获得[10]。
1.2 主要试剂
pGM-T连接试剂盒、感受态细胞 DH5α、D2000 DNA Marker、D15000 DNA Marker、高纯度质粒小提中量试剂盒和质粒小提试剂盒(离心柱型)均购自北京天根生化科技有限公司;SYBRPremix Ex Taq TM(2×)购自Takara公司;限制性内切酶PmeⅠ、PacⅠ与限制性内切酶KpnⅠ、Hind III均购自Thermo公司;卡那霉素购自biosharp公司;DMEM高糖培养基、DME/F12培养基、0.25%胰酶与双抗均购自Hyclone公司;胎牛血清购自Gemini公司;LipofectamineTM3000与购自Invitrogen公司;HEK 293细胞系由四川大学生物治疗国家重点实验室赠予;含有腺病毒骨架pAdEasy-1的E.coli BJ5183菌种与穿梭质粒pAdTrack-CMV由西北农林科技大学陕西省农业分子生物学重点实验室赠予。
1.3 目的基因的亚克隆
1.3.1 引物的设计与合成 根据实验室前期克隆获得的山羊FGF1基因(GenBank登录号KT899959)序列,利用Primer 5.0软件设计一对带有酶切位点的引物,上下游分别带有KpnⅠ和Hind III的酶切位点,引物序列见表1。送交生物公司进行合成。
1.3.2 完整CDS区的克隆 以背部皮下脂肪组织提取的总RNA反转录而成的cDNA为模板,与表1中设计的引物进行PCR扩增,反应体系为:模板cDNA 1.0(l,2 × Long Taq PCR Master Mix 12.5 μl,10 μmol·L-1、下游引物各 1.0(l,ddH2O 9.5 μl。反应条件如下:94℃预变性4 min;94℃ 20 s,Tm 60 s,72℃ 90 s;39个循环,72℃延伸10 min。取PCR产物进行凝胶电泳检查,确认片段大小与预期相符,参照DNA凝胶回收试剂盒对目的片段进行纯化回收。
1.3.3 质粒 pGM-T-FGF1的获得 将 FGF1基因回收片段与pGM-T载体进行连接,得到连接产物pGM-T-FGF1,将连接产物转化入感受态细胞DH5α,取经菌落PCR鉴定正确的菌液摇床培养,扩繁后提取质粒,用KpnⅠ和Hind III对获得的质粒进行双酶切鉴定。
1.4 质粒pAdTrack-CMV的转化、扩增与提取
穿梭质粒pAdTrack-CMV采用热激法转化感受态细胞DH5α,过夜培养后挑取阳性菌落并进行扩大培养,用质粒小提试剂盒(离心柱型)提取质粒pAdTrack-CMV。
1.5 腺病毒穿梭质粒 pAdTrack-CMV-FGF1的构建与鉴定
将鉴定正确的重组质粒pGM-T-FGF1和穿梭质粒pAdTrack-CMV用限制性内切酶KpnⅠ和Hind III同时进行双酶切反应,1%凝胶电泳检测后,分别纯化回收FGF1片段和穿梭质粒pAdTrack-CMV大片段。将FGF1片段与线性化的质粒大片段用T4 DNA连接酶连接,16℃过夜,连接产物转化感受态细胞DH5α,接种于含卡那霉素的琼脂平板上37℃培养过夜。挑取阳性菌落进行扩大培养(37℃,180 r/min,14 h)并提取质粒,对提取的质粒进行双酶切鉴定,筛选出重组质粒pAdTrack-CMV-FGF1并送生物公司测序。
1.6 重组腺病毒 pAdEasy-FGF1的构建与鉴定
用PmeI酶切线性化阳性的穿梭质粒pAdTrack-CMV-FGF1,然后转入含有腺病毒骨架载体pAdEasy-1的大肠杆菌BJ5183感受态细胞中,涂布于含kan的固体培养基上,37℃培养过夜。挑取阳性单菌落扩大培养(37℃,180 r/min,14 h)提取质粒,进行PacI酶切鉴定,阳性质粒命名为pAdEasy-FGF1并送生物公司测序。
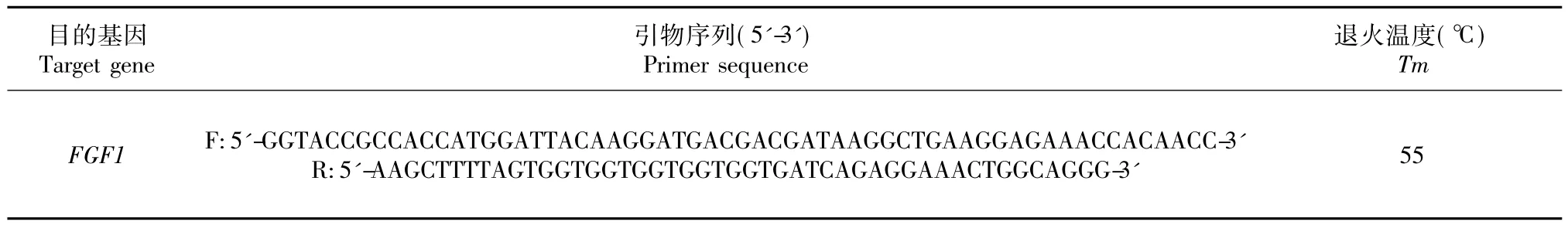
表1 引物序列Table 1 Primers sequence
1.7 重组腺病毒pAdEasy-FGF1的包装与扩增
阳性质粒pAdEasy-FGF1进行PacI酶切,并利用异丙醇沉淀法纯化回收酶切后的DNA。将293A细胞接种于培养瓶中进行复苏,待其长至80%融合时,取8 μg纯化回收后的DNA按照转染试剂LipofectamineTM3000说明转染293A细胞,进行病毒包装。此后每天换液,并观察293A细胞绿色荧光蛋白(Green Fluorescent Protein,GFP)的表达情况与病变情况。转染后7~8 d,观察出现彗星尾巴样荧光,再等1~2 d收毒。收集的细胞毒液经37℃ 30 min,-80℃ 30 min反复3次使细胞破裂释放出病毒。收集的第1代病毒再用于感染293A细胞,通过3~4代感染扩增病毒。
1.8 重组腺病毒pAdEasy-FGF1侵染山羊肌内前体脂肪细胞
培养山羊肌内前体脂肪细胞F3代长至80%融合时,加入包装后的重组腺病毒pAdEasy-FGF1毒液,感染48 h后收集细胞。提取细胞总RNA,参照试剂盒进行反转录,实时荧光定量PCR检测FGF1的表达情况。qPCR反应体系如下:SYBRPremix Ex Taq TM(2 × )PCR 10 μl,10 μmol·L-1上下游引物各 1 μl,模板 cDNA 1 μl,ddH2O 7 μl。反应条件:95 ℃ 预变性3 min,95 ℃ 10 s,Tm 10 s,72 ℃ 15 s,40 个循环。
1.9 统计学分析
运用SPSS 21.0软件对实验数据进行统计分析,实验数据以“平均值±标准误”表示,采用t检验对不同组别的差异进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 腺病毒穿梭质粒pAdTrack-CMV-FGF1的构建与鉴定
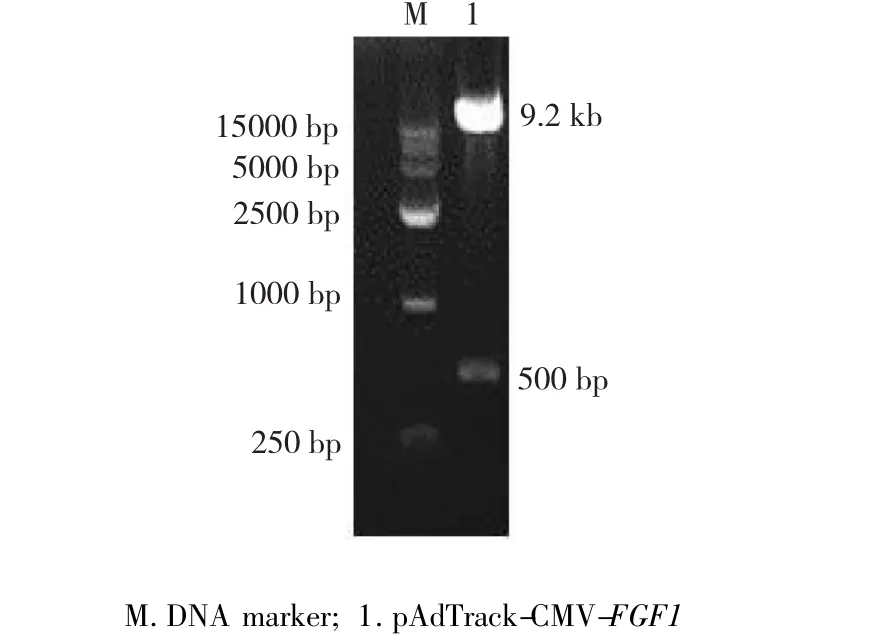
图1 pAdTrack-CMV-FGF1双酶切鉴定Fig.1 Digestion identification of pAdTrack-CMV-FGF1
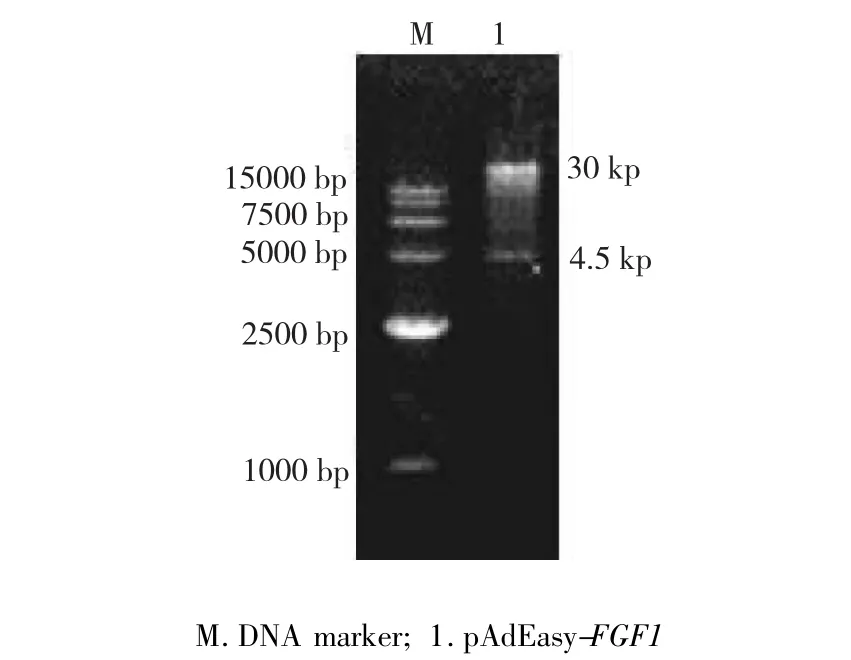
图2 pAdEasy-FGF1的Pac I酶切鉴定Fig.2 Digestion identification of pAdEasy-FGF1
取重组的腺病毒穿梭质粒pAdTrack-CMV-FGF1进行双酶切鉴定,酶切产物进行0.8%凝胶电泳。电泳结果显示,得到1条约500 bp的目的基因片段和1条约9.2 kb的pAdTrack载体片段(图1)。回收小片段测序后与FGF1基因序列进行比对,结果显示回收片段与FGF1基因CDS区序列完全吻合,证明穿梭质粒pAdTrack-CMV-FGF1构建成功。
2.2 重组腺病毒 pAdEasy-FGF1的构建与鉴定
重组腺病毒载体pAdEasy-FGF1经PacI酶切后电泳,获得1条30 kp的带和1条4.5 kp的带(图2),测序结果显示插入片段与预期序列一致,表明成功构建腺病毒超表达载体pAdEasy-FGF1。
2.3 重组腺病毒pAdEasy-FGF1的包装与扩繁
pAdEasy-FGF1经Pac I酶切线性化之后转染培养复苏的293A细胞(图3),转染72 h后倒置荧光显微镜下可观察到GFP的表达,转染7 d后出现病毒包装过程中典型的“彗星尾”现象(图4-A),8 d后大部分细胞出现荧光。收集细胞毒液,反复感染293A细胞3代后(图4-B)可获得高滴度的腺病毒。
2.4 pAdEasy-FGF1感染山羊肌内前体脂肪细胞后对FGF1表达的影响

图3 正常的293A细胞(200×)Fig.3 Normal 293Acelsl(200 × )

图4 pAdEasy-FGF1转染293A细胞后GFP表达情况(100×)Fig.4 GFP expression of 293A cell transfected by pAdEasy-FGF1
重组腺病毒pAdEasy-FGF1经包装后感染山羊肌内前体脂肪细胞,2 d后,约有60%的细胞被腺病毒感染并产生荧光。收集细胞,提取RNA,实时荧光定量PCR检测FGF1 mRNA的表达水平。结果显示,与未感染病毒的前体脂肪细胞空白组相比,FGF1 mRNA的表达水平增加了约350倍,被成功超表达(图5)。说明表达FGF1的重组腺病毒载体构建成功,并在293A细胞中成功包装,具有在细胞内超表达FGF1的能力。
3 讨论
目前被广泛应用的病毒载体有腺病毒(Adenoviruses)、慢病毒(Lentivirus)和逆转录病毒(Retrovirus)载体等。与只能感染分裂期细胞的逆转录病毒和具有一定致病性的慢病毒相比,腺病毒载体能够感染处于分裂期和非分裂期的细胞,并且感染谱广、容量大、体外可操作性强,因此是目前基因转移运用最广泛的载体之一[11]。基础研究常用的腺病毒载体构建系统pAdEasy是由He等(1998)于1998年提出来的,该系统首先将目的基因插入到穿梭载体(pAdTrack-CMV)中,然后用PmeI酶切使之线性化,线性化产物转染到含有骨架载体pAdEasy-1的大肠杆菌BJ5183感受态细胞中。穿梭质粒与骨架载体的重组方式有2种,也正因为重组方式的不同,重组腺病毒质粒PacⅠ酶切鉴定也显示2种不同的结果,因此其条带出现在4.5 kb处或是3.0 kb处都可认为其重组成功[12]。
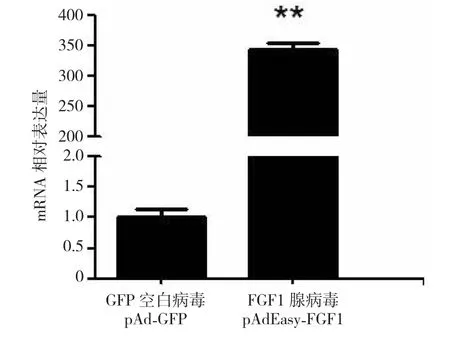
图5 转染pAdEasy-FGF1质粒对山羊肌内前体脂肪细胞FGF1基因表达的影响Fig.5 Expression of FGF1 gene after goat’s preadipocyte infected by pAdEasy-FGF1
本试验通过酶切已知载体得到了外源目的基因,成功构建了穿梭载体 pAdTrack-CMV-FGF1,通过同源重组,将外源目的基因FGF1整合到腺病毒骨架载体中,得到了pAdEasy-FGF1,由于各种正常组织均能表达腺病毒特异性受体柯萨奇/腺病毒受体(coxsackie/adenovirus receptor,CAR)[13],因此本研究所构建的腺病毒超表达载体能用于感染各种类型的细胞,适用于下一步对山羊肌内脂肪细胞进行超表达的研究。但是,腺病毒载体的目的基因不能整合到靶细胞基因组上,容易造成目的基因丢失、不能长期表达[14]。因此,病毒扩繁不宜超过五代,在试验中最好采用第3代或第4代病毒进行研究,以获得较好的试验结果[15]。包装扩繁后的pAdEasy-FGF1感染山羊肌内前体脂肪细胞;实时荧光定量PCR结果显示,pAdEasy-FGF1可以极显著上调FGF1 mRNA的表达水平,为后续研究FGF1对山羊肌内前体脂肪细胞分化的作用机理奠定了基础。
4 结论
腺病毒超表达载体pAdEasy-FGF1通过同源重组构建成功,于293A细胞中成功包装。包装的pAdEasy-FGF1感染山羊肌内前体脂肪细胞后,检测其FGF1 mRNA的表达水平与未感染病毒的前体脂肪细胞空白组相比增加了约350倍,被成功超表达。
