波纹唇鱼雄激素受体基因的克隆与表达分析
2018-12-11邹文慧单鳞茜林浩然
邹文慧,单鳞茜,韩 邦,骆 剑,齐 鑫,林浩然,
( 1.海南大学 海洋学院,南海海洋资源利用国家重点实验室,热带生物资源教育部重点实验室,海南 海口 570228; 2.中山大学,水生经济动物研究所,广东省水生经济动物良种繁育重点实验室,广东 广州 510275 )
波纹唇鱼(Cheilinusundulatus)为大型珊瑚礁鱼类,属硬骨鱼纲、鲈形目、隆头鱼科、唇鱼属[1],在我国主要分布于南海与东海南部,海南万宁、陵水等海域以及香港、台湾诸岛。波纹唇鱼存在天然的性逆转现象,种群性别结构影响其性逆转的发生[2],在波纹唇鱼野生群体中大部分成年个体都是雌鱼,群体中少数体形较大、年龄较长的个体才发育为雄鱼。此外,由于波纹唇鱼颜色艳丽、体形巨大、肉质细嫩且营养价值高,其售价持续上涨[3]。在巨大的经济利益驱使下,波纹唇鱼野生资源遭到严重破坏,濒临灭绝。
雄激素在脊椎动物的性别分化、性成熟和精子发生中起重要作用[4],其通过雄激素受体(ar)激活下游信号通路,从而行使其功能。雄激素受体属于核受体超家族成员[5],具有3个主要结构域,包括N端超变量转录激活结构域、高度保守的DNA结合区域和C端配体结合区域。小鼠(Musmusculus)中,突变雄激素受体基因产生对雄激素不敏感的表现型缺失[6-7]。据此,雄激素受体在雄性性别分化和发育过程中起重要作用。在鱼类中,斑马鱼(Daniorerio)雄激素受体基因在精巢支持细胞中高度表达,而鱼类的支持细胞与精原细胞的发育有关,这表明斑马鱼雄激素受体基因在精原细胞的增殖和分化中起重要作用。雄激素受体基因在鳗鲡(Anguillajaponica)精巢早期发育阶段的高度表达也说明,雄激素受体在雄性鱼类性别分化和发育过程中起重要的作用。有研究表明,雄激素受体拮抗剂氟他米处理成熟雄性黑头呆鱼(Pimephalespromelas),引起抗苗勒氏管激素的表达下降,据此,可进一步说明雄激素受体在调节鱼类精巢发育过程中发挥重要的作用。此外,雄激素受体在雌性生殖功能中也扮演着非常重要的角色。在鳗鲡卵巢中,雄激素11-KT的靶细胞主要是滤泡细胞和产卵层的上皮细胞,进而可以推测,雄激素作为卵子发生直接调控因子,通过雄激素受体在卵母细胞发育过程中发挥重要作用。在澳洲鳗鲡(A.australis)中,雄激素11-KT可以通过雄激素受体对卵黄卵母细胞的发育进行调控,从而刺激卵巢中甘油三酯的积累并增大卵母细胞的直径[8]。
波纹唇鱼作为性别分化研究的良好材料,又以肉质鲜美和较高的观赏性而得到人们的青睐,所以具有很高的研究价值。并且,目前尚无人工繁殖的波纹唇鱼,所以其人工繁殖研究非常重要。笔者以波纹唇鱼为研究对象,首次克隆了雄激素受体基因的cDNA序列全长,并进行序列分析,与其他鱼类雄激素受体基因氨基酸序列比对,并构建进化树,Realtime PCR分析波纹唇鱼雄激素受体基因mRNA在13种组织中的表达量,为进一步研究波纹唇鱼内分泌生理奠定基础,也为该鱼生殖调控提供科学依据。
1 材料与方法
1.1 样品的采集及RNA提取
试验所用的波纹唇鱼取自海南三亚刚渔排网箱人工暂养的野生个体,共3尾2龄雌性,共2.7 kg。解剖,取前脑、中脑、后脑、垂体、下丘脑、卵巢、肝脏、心脏、脾脏、前肠、后肠、肾脏、肌肉13种组织,立即放入液氮中,用Trizol试剂(invitrogen公司)提取总RNA,提取的RNA通过琼脂糖电泳进行鉴定后于冰箱-80 ℃备用。
1.2 雄激素受体 cDNA的分子克隆
1.2.1 波纹唇鱼雄激素受体基因核心区cDNA的克隆
取1 μg的性腺RNA,使用反转录试剂盒合成cDNA。根据波纹唇鱼雄激素受体基因的转录组序列,用Primer 5.0软件设计中间片段的引物ar-mid-F和ar-mid-R(表1)。以性腺cDNA为模板进行PCR扩增。反应体系为:10×Buffer 2 μL,dNTP 2 μL,cDNA 1 μL,Taq DNA polymerase 0.2 μL,ddH2O 12.8 μL,正反引物各1 μL。反应程序为:94 ℃预变性3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,共35个循环;72 ℃ 10 min。纯化目的片段、连接到PGEM-T载体,转染大肠杆菌(Escherichiacoli)感受态细胞,菌液涂布于LB固体培养基上12 h后挑菌,验证,测序,于美国国立生物技术信息中心网站上比对。
1.2.2 cDNA末端快速扩增
用SmartTM-race cDNA Amplification Kit合成可用于扩增3′和5′端SmartTM-race-ready cDNA。以核心区序列为模板设计5′RACE-PCR 和3′RACE-PCR 套式引物3′-ar-RACE-F1、3′-ar-RACE-F2、5′-ar-RACE-R1、5′-ar-RACE-R2,通用引物为UPM和NUP(表1)。反应体系及反应程序如上所述。纯化目的片段、连接到PGEM-T载体,转染大肠杆菌感受态细胞,菌液涂布于LB固体培养基上12 h后挑菌,验证,测序,于美国国立生物技术信息中心网站上比对。
1.3 序列测定和分析
使用ORFFinder(https:∥www.ncbi.nlm.nih.gov/orffinder/)寻找ORF;信号肽预测采用Sinnal P 4.1(http:∥www.cbs.dtu.dk/services/SignalP/);用SMART(http:∥smart.embl-heidelberg.de/)在线程序进行蛋白结构域分析;运用DNAstar软件,将所得雄激素受体基因的cDNA序列转化为氨基酸序列,与美国国立生物技术信息中心网站中的雄激素受体基因氨基酸资源进行系统发生分析,采用邻接法(1000次运算)运用Mega 7.0软件,进行多重比对,构建系统进化树。
1.4 雄激素受体在波纹唇鱼中的组织表达
取各组织1 μg,将其反转录为cDNA。利用Primer 5.0设计1对定量引物ar-real-F和ar-real-R以及内参引物βactin-real-F,βactin-real-R和EF1α-real-F,EF1α-real-R,引物序列见表1。将cDNA稀释10倍,作为模板,进行荧光定量PCR,体系为:cDNA 0.5 μL,SYBR 5 μL,正反引物各0.2 μL,H2O 4.1 μL。
2 结 果
2.1 波纹唇鱼雄激素受体基因的克隆及系统发生分析
利用RT-PCR扩增得到的雄激素受体基因的全长为3514 bp,其中包括111 bp的5′UTR,1104 bp的3′UTR(去除poly A尾)以及2268 bp的ORF。经BLAST比对,获得的雄激素受体基因的片段与其他鱼类的雄激素受体基因有很高的相似性,表明这段序列为波纹唇鱼的雄激素受体基因序列。将所获得的序列提交到美国国立生物技术信息中心,获得登录号为MG383647。
波纹唇鱼雄激素受体基因cDNA编码755个氨基酸,用Singal P程序分析发现无信号肽酶切位点,预测其蛋白分子量约为84.7 ku,等电点约为6.83。用BLASTP分析雄激素受体基因的氨基酸序列,发现它的3个结构域:转录激活区(TAD,AA1-393)、DNA结合结构域(DBD,AA394-475)和配体结合结构域(LBD,AA510-754),进一步分析显示该序列还含有大部分物种中均含有的P-box(GSCKV)和D-box(ASKND)特殊结构,其均位于DNA结合结构域,此外,在配体结合结构域区还有1个八肽的亮氨酸拉链区(图1)。

表1 波纹唇鱼雄激素受体基因克隆和表达所用的引物
采用BioEdit软件进行多重序列比较分析发现,波纹唇鱼雄激素受体基因的氨基酸序列在各物种之间的相似性较高,波纹唇鱼雄激素受体基因与贝氏隆头鱼(Labrusbergylta)、西氏拟隆头鱼(Pseudolabrussieboldi)和欧洲舌齿鲈(Dicentrarchuslabrax)的雄激素受体基因的相似性分别为85.0%、82.5%和79.5%(表2)。将所得的雄激素受体基因序列与美国国立生物技术信息中心中16个物种的雄激素受体序列进行同源性比对,利用Mega 7.0软件采用邻接法和最大似然法构建系统发育树。两种系统发育树分析均表明,波纹唇鱼与隆头鱼科鱼类贝氏隆头鱼和西氏拟隆头鱼聚为一小支,与其他鱼类聚为一大支,而哺乳类聚为一支(图2~3)。各物种雄激素受体序列在GenBank的注册号分别为:西氏拟隆头鱼(ADI24924.1),欧洲舌齿鲈(AAT76433.1),大黄鱼(Pseudosciaenacrocea)(NP_001290296.1),绒须石首鱼(Micropogoniasundulatus)(AAU09477.1),斜带石斑鱼(Epinepheluscoioides)(ADQ43815.1),真鲷(Chrysophrysmajor)(AB017158.1),金头鲷(Sparusaurata)(AEO13404.1),雀鲷(Stegastespartitus)(XP_008301461.1),黑鲷(Acanthopagrusschlegelii)(AAO61694.1),三刺鱼(Gasterosteusaculeatus)(AB545869.1),贝氏隆头鱼(XP_020485876.1),人(Homosapiens)(M20132.1),小鼠(NM_013476.4),斑马鱼(NP_001076592.1),尼罗罗非鱼(Oreochromisniloticus)(NM_001279615.1)。
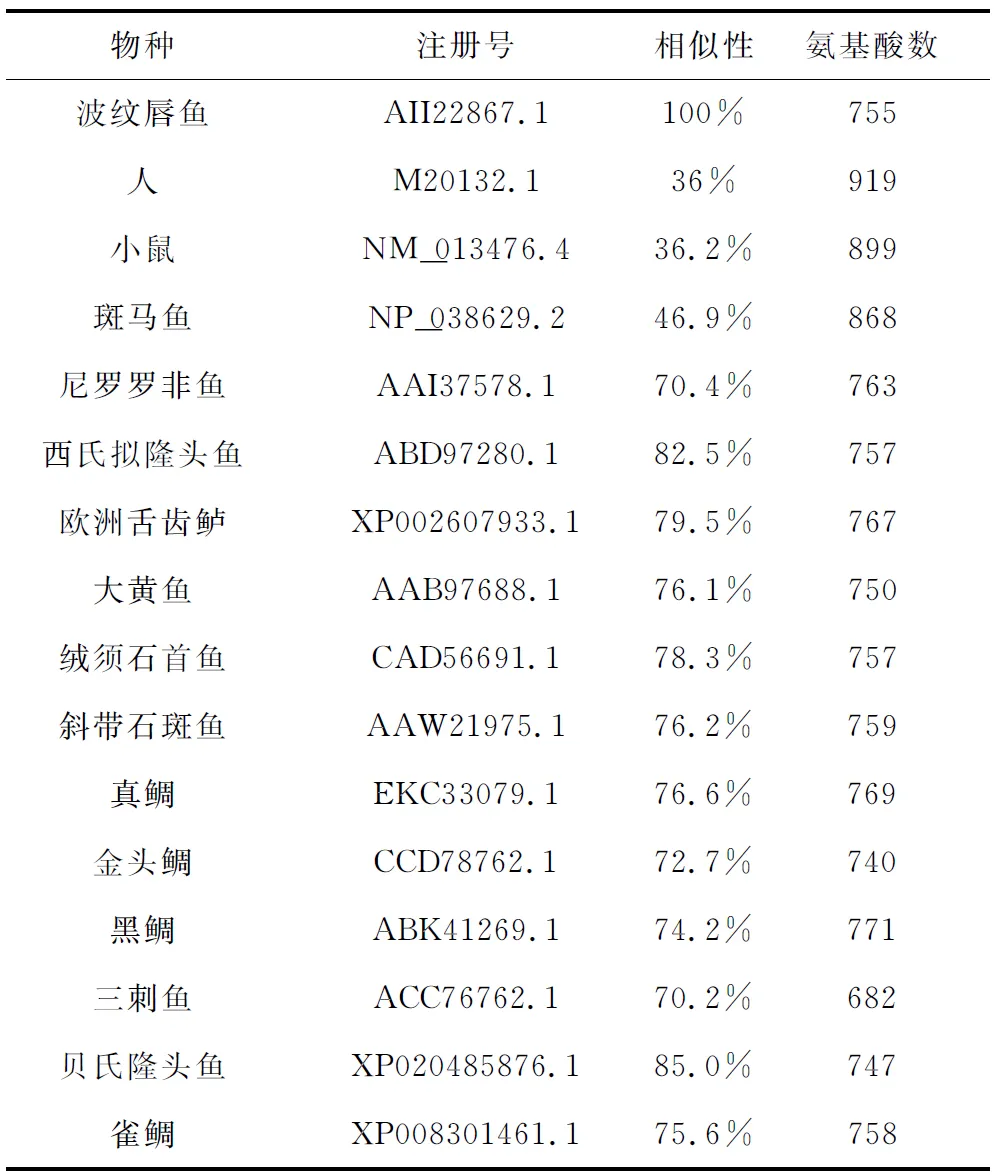
表2 波纹唇鱼雄激素受体氨基酸序列与其他已知物种的雄激素受体基因氨基酸序相似性分析
2.2 组织表达分布
通过荧光定量PCR的方法检测雄激素受体基因在波纹唇鱼的前脑、中脑、后脑、垂体、下丘脑、心脏、肝脏、卵巢、脾脏、肾脏、前肠、后肠、肌肉13种组织中的表达量。结果表明,波纹唇鱼雄激素受体基因在这13种组织中均有表达,在肾脏中表达量最高,而在前肠中的表达量最少(图4)。

图1 波纹唇鱼雄激素受体基因的cDNA序列及推测的氨基酸序列第一段黑色部分为转录激活区,蓝色部分为DNA结合域,红色部分为配体结合域,黄色区域为P-box和D-box,绿色部分为八肽的亮氨酸拉链区. 终止密码子以*号表示.
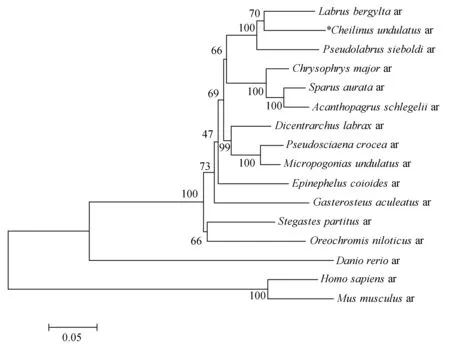
图2 16种动物雄激素受体基因mRNA序列邻接法构建的系统进化树
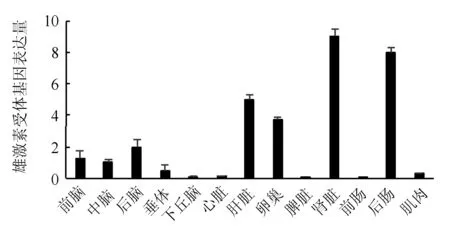
图4 雄激素受体基因在波纹唇鱼各组织中的表达
3 讨 论
3.1 波纹唇鱼雄激素受体基因的克隆及系统发生分析
本试验克隆了波纹唇鱼雄激素受体基因的全长cDNA序列,全长为3514 bp,其中包括111 bp的5′UTR,1104 bp的3′UTR(去除poly A尾)以及2268 bp的ORF,其蛋白分子量约为84.7 ku,等电点约为6.83。经BLAST对比,其与贝氏隆头鱼、西氏拟隆头鱼和欧洲舌齿鲈的雄激素受体基因的相似性分别为85.0%、82.5%和79.5%,可以确定其为波纹唇鱼的雄激素受体基因。与其直系同源的雄激素受体相似,波纹唇鱼雄激素受体的氨基酸序列同样包含了3个特征结构域,即转录激活区,DNA结合域和配体结合域。转录激活区的低同源性被认为是构成许多直系同源雄激素受体基因主要结构差异的原因,同时也是导致不同组织分布的原因,为研究的重点[9]。高度保守的DNA结合域有2个锌指结构[10],这2个锌指结构分别包含P-box(GSCKV)(参与雄激素受体与其配体反应元件的结合)以及D-box(ASKND)(参与识别反应元件half-sites的间距)。同源性较不保守的配体结合域呈螺旋状结构,参与配体受体结合作用,在其C端末发现的亮氨酸拉链结构,对受体的二聚体化作用很重要[11]。序列分析表明,波纹唇鱼雄激素受体基因的DNA结合域和配体结合域高度保守。
系统发育分析表明,鱼类和哺乳类位于2个明显不同的分支,克隆得到的波纹唇鱼的雄激素受体基因位于鱼类分支中,再次证明克隆得到的片段为波纹唇鱼的雄激素受体基因。此外,一些鱼类同时存在2种雄激素受体基因,推测其可能是全基因组复制—退化—补偿过程所致[12]。即原始雄激素受体基因的复制推测起来可能发生在鱼类第2次基因组复制(2R)时[13-15],于是产生了雄激素受体α基因和雄激素受体β基因。在进化过程中,雄激素受体α基因或者雄激素受体β基因丢失。可能因为在长时间的进化中,其中1个基因会以特异性世系的方式丢失[16]。
3.2 波纹唇鱼雄激素受体基因的组织分布
波纹唇鱼雄激素受体基因在各组织中的荧光定量PCR结果表明,波纹唇鱼的雄激素受体基因在各个组织中均有表达,只是表达量有差异,说明雄激素受体在波纹唇鱼中具有广泛的生理作用。波纹唇鱼的雄激素受体基因在肾脏中表达量最高,而在前肠中的表达量最低。研究表明,含有2种雄激素受体基因亚型的鱼类,其组织表达模式也存在很大的差异,如虹鳟(Oncorhynchusmykiss),雄激素受体α基因在垂体、脑、卵巢、精巢、肝脏和心脏中均有表达,而雄激素受体β基因只在垂体、脑、精巢和卵巢中有表达,鳗鲡的雄激素受体α基因在脾脏、肾脏、心脏、肌肉、肝脏、精巢、卵巢和脑中有表达,但雄激素受体β基因只在肌肉、脾脏和精巢中有表达[17]。以上研究表明,雄激素受体α基因在许多组织中均有表达,只是表达量有差异,在一些重要组织中具有较高的表达水平,而雄激素受体β基因只在个别组织中表达。只含有1种雄激素受体基因的鱼类存在相似的组织表达模式,即在各个组织中均有表达,如南方鲇(Silurusmeridionalis)在脑、垂体、鳃、心脏、肝脏、肠、脾脏、性腺、肾脏和肌肉中均有表达,其中雄鱼在肝脏中表达量较高;对雄性半滑舌鳎(Cynoglossussemilaevis)的研究发现,雄激素受体基因在各组织中均有表达,其中肾脏的表达量最高[18]。而波纹唇鱼雄激素受体基因的表达模式与只含有1种雄激素受体基因鱼类的表达模式相似,其中肾脏中表达量最高,推测其可能只含有1种雄激素受体基因。此外,波纹唇鱼的雄激素受体基因在肝脏中的表达量较高,与之前的研究结果一致,提示鱼类中的雄激素可能是通过性激素受体调控卵黄蛋白原的合成[19]。除此之外,波纹唇鱼的雄激素受体基因在卵巢中的表达量也较高,说明雄激素受体在雌性的生殖功能中也起着重要的作用。
