辽宁沿海鲬mtDNA控制区结构和遗传多样性分析
2018-12-11李玉龙刘修泽于旭光李轶平王小林
李玉龙,刘修泽,吉 光,于旭光,李轶平,付 杰,王小林,郭 栋,董 婧
( 辽宁省海洋水产科学研究院,辽宁省海洋生物资源与生态学重点实验室,辽宁 大连 116023 )
鲬属(Platycephalus)鱼类广泛分布于印度—西太平洋海域,是一类具有较高经济价值的大型底栖性经济鱼类,属鲉形目、鲬科[1-3]。目前鲬属具有有效种名的种类为16种,绝大多数分布于东南亚和大洋洲海域,西北太平洋海域仅分布有两种,分别为印度鲬(Platycephalusindicus)和刀鲬(P.cultellatus)[1-4]。但近期的研究表明,在鲬属鱼类中尚存在很多隐蔽种,有关其分类以及一些物种的有效性方面也存在诸多争议[4-6]。在目前的形态分类研究中,黄、渤海分布的鲬种类一直被定为印度鲬,且被认定是我国沿海分布的唯一鲬属鱼类[1-4]。秦岩等[4-5]通过对采自东营、青岛、舟山及北海近海共174尾鲬的形态特征和DNA条形码分析后认为,广泛分布于我国沿海的鲬并非印度鲬,而与东北亚海域发现的一个种名未定的鲬属有效种Platycephalussp.1更为接近,将其称为褐斑鲬并作为一个新种加以描述。
近年渔业资源调查发现,在黄渤海经济鱼种资源衰退的背景下,鲬已成为辽宁沿海为数不多的尚有一定产量的经济种类,但其年资源量浮动较大,且缺乏对其种群状况及遗传背景的详细了解。目前对鲬属鱼类进行的分子遗传方面的研究相对较少,仅见利用线粒体COⅠ基因序列和控制区部分序列进行鲬属鱼类的DNA条形码分析和群体遗传分析[4-6],对鲬属鱼类线粒体控制区全序列多态性及结构功能方面的研究鲜见报道。对鱼类线粒体控制区D-loop序列、结构功能进行研究,不仅有助于探明线粒体DNA复制、转录启动机制和进化规律,对进一步了解相关种类的分类鉴定、遗传多样性及种质资源状况也具有重要意义。因此,本研究测定了渤海辽东湾和黄海北部鲬群体的线粒体控制区全序列,并与已知的其他鲬属鱼类同源序列进行比较和分析,明确分布于辽宁沿海鲬的分类地位,为今后进一步检测其遗传多样性状况以及进行该物种的监测和资源保护提供基础资料。
1 材料与方法
1.1 样品采集与种类鉴定
2014—2015年,在辽宁沿海渔业资源调查时获得鲬样品25尾,其中辽东湾海域20尾,黄海北部海域5尾。参照《海洋生物名录》[1]、《黄渤海鱼类图志》[2]和《辽宁省动物志·鱼类》[3]等资料进行种类鉴定。此外,参照文献[4-5]列出的鲬属鱼类的形态特征差别,根据侧线鳞数和尾鳍颜色对25尾辽宁沿海鲬样品进行形态分类鉴定,发现辽宁沿海鲬应为褐斑鲬,而非以往一直认为的印度鲬(表1),据此将采集的辽宁沿海鲬统一视为褐斑鲬加以描述,并通过本研究的结果进行验证。辽宁沿海鲬经形态鉴定后于超低温冰箱中保存备用。

表1 辽宁沿海鲬样品与4种鲬属鱼类形态特征比较
1.2 DNA提取、扩增和测序
采用CTAB法提取基因组DNA后,参考GenBank中已报道的印度鲬线粒体全序列(登录号AP006783),选择位于控制区两侧保守性较高的区域设计合成扩增引物,DL-F: 5′-CCCACCACTAACTCCCAAAGC-3′,DL-R: 5′-TTAACTCCCACCCCTGGCT-3′,对样品进行扩增,PCR反应体系25 μL,包括0.2 mmol/L每种dNTPs,0.2 μmol/L每种引物,1 μL DNA模板,1 U Taq,2.0 mmol/L MgCl2,2.5 μL 10×缓冲液,灭菌超纯水补足剩余体系。PCR产物经1%琼脂糖凝胶电泳检测并回收后送至生工生物工程(上海)股份有限公司进行双向测序,测序引物与扩增引物一致。
1.3 数据分析
利用Bioedit软件[7]对测序所得序列进行拼接并辅以人工校对,通过BLAST(http://www.ncbi.nlm.gov/BLAST/)检索确定为目的片段。应用CLUSTAL X 1.83软件对序列进行比对分析。根据印度鲬线粒体基因组全序列确定控制区的起点和终点,并参照已报道的鱼类线粒体控制区结构特征,对辽宁沿海鲬线粒体控制区全序列进行结构特征分析。Mega 5.0软件[8]统计碱基含量、变异位点, 采用Kimura双参数模型计算单倍型间遗传距离。单倍型数、多态位点数、单倍型多态度、核苷酸多态度等分子多样性指数以及中性检验和核苷酸不配对分布等群体历史动态分析由Arlequin3.5[9]软件计算,扩张参数τ通过公式τ=2ut转化为实际的扩张时间,其中u是所研究的整个序列长度的突变速率。鲬属鱼类缺乏线粒体控制区分子钟的相关资料以及化石证据,本研究采用3%/百万年~10%/百万年这一海洋鱼类线粒体控制区序列突变速率假设[10]对辽宁沿海鲬群体的扩张时间进行估算。采用中介网络法[11]构建单倍型网络关系图。
2 结果与分析
2.1 辽宁沿海鲬控制区序列变异及遗传多样性分析
基于控制区全序列的鲬属种内和种间的遗传距离见表2。基于D-loop计算的辽宁沿海鲬样品与文献[4]描述的褐斑鲬(登录号KC662184)间的遗传距离为0.005,其种内的遗传距离为0~0.008,平均遗传距离为0.003,这一结果也从基因层面上进一步证实,25尾辽宁沿海鲬样品为文献[4-5]中描述的褐斑鲬。褐斑鲬与印度鲬间的差异较大(0.093~0.153),而印度鲬日本样品(登录号AP006783)与中国样品(登录号KC662185)间的遗传距离为0.151,远高于种内水平,甚至高于不同种间的遗传距离,提示两者为不同的种。
辽宁沿海25尾褐斑鲬控制区全序列中共检测到22个变异位点,约占总序列长度的2.5%,其中包括20个转换、颠换位点和2个插入/缺失位点(表3)。经Mega 5.0软件计算得到序列中A、T、G和C平均碱基含量分别为30.7%、31.1%、16.2%和22.0%,与其他鱼类控制区碱基组成相似,控制区全序列A+T含量(61.8%)明显高于C+G含量(38.2%)。不计位于保守序列区的2个插入/缺失位点,20个变异位点中检测到11个变异位点位于终止序列区内(55%),6个变异位点位于中央保守区,3个变异位点位于保守序列区。25尾个体中共得到16个单倍型,其中3个为共享单倍型, 其他为特有单倍型。辽宁沿海褐斑鲬群体核苷酸多样性指数相对较低(0.0026±0.0017),而单倍型多样性指数相对较高(0.92±0.04)。

表2 基于D-loop序列的鲬属种内和种间遗传距离
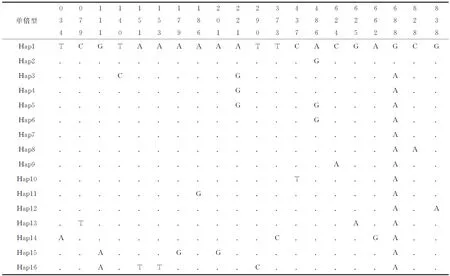
表3 辽宁沿海褐斑鲬不同单倍型控制区序列的变异位点分布
辽宁沿海褐斑鲬控制区全序列单倍型间中介网络关系见图1,网络关系呈现明显的星状结构,主体单倍型Hap7位于网络中心,其他所有单倍型通过一步或多步突变与该主体单倍型相连,对辽宁沿海褐斑鲬群体进行Tajima′sD检验[12]和Fu′sFs检验[13]的结果也均为负值且检验均显著(P<0.05),提示褐斑鲬在辽宁沿海可能经历了近期的群体扩张。此外,用核苷酸不配对分布分析了褐斑鲬辽宁沿海群体的历史动态。辽宁沿海褐斑鲬群体核苷酸不配对分布呈单峰类型(图2),对θ0和θ1进行的估算表明,褐斑鲬群体经历过明显的群体增长,也提示分布于辽宁沿海的褐斑鲬群体经历过近期的群体扩张事件。辽宁沿海褐斑鲬的τ值的观测值为1.656(95%置信区间:1.063~3.338),根据控制区序列3%/百万年~10%/百万年的进化速率u和τ值用公式τ=2ut推算出的辽宁沿海褐斑鲬群体扩张时间t约为19 000~63 000 年。
2.2 鲬属鱼类控制区序列特征
参照印度鲬线粒体基因组全序列,确定辽宁沿海褐斑鲬控制区的起点和终点,其线粒体控制区全长为876~878 bp。对比已报道的鲤形目、鲇形目、鲽形目、鲈形目、鲱形目及鲉形目等鱼类线粒体控制区结构[14-28],将CSB-F和CSB-1分别作为识别终止序列区、中央保守区和保守序列区的界线,识别了鲬属鱼类终止序列区的TAS序列、中央保守区的CSB-F、CSB-E和CSB-D的核心序列以及保守序列区的CSB1、CSB2和CSB3的核心序列。
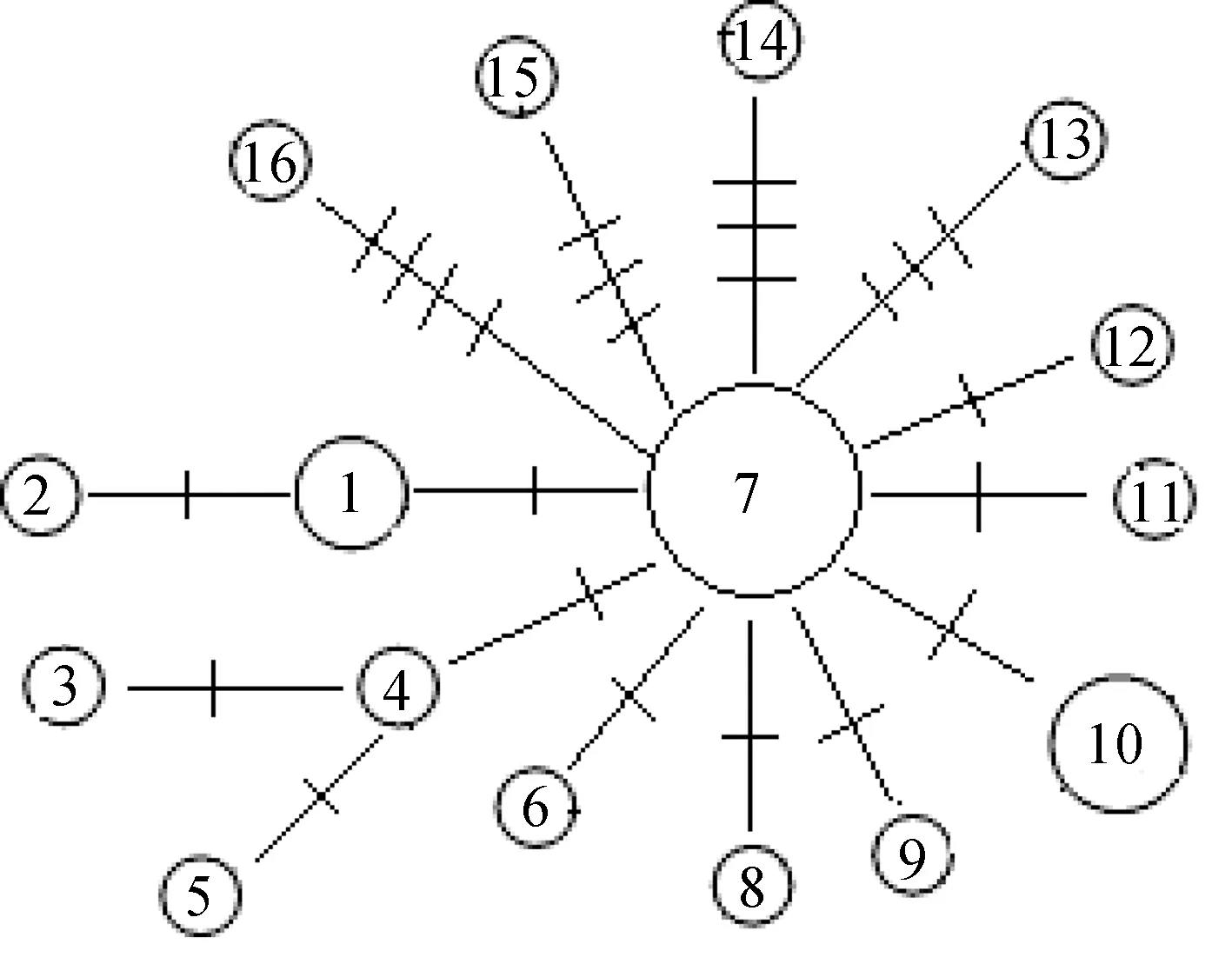
图1 褐斑鲬单倍型网络关系

图2 辽宁沿海褐斑鲬D-loop序列核苷酸不配对分布图
终止序列区通常也被称为高变区,该区域是控制区内变异速率最快的区域。褐斑鲬控制区终止序列区长度为308 bp,印度鲬为306~309 bp,在鲬属鱼类检测到1个与终止相关的序列——ETAS,其普遍形式为TACATATATGTA,ETAS序列主体的核心部分是TACAT及其反向互补序列ATGTA(图3),可形成稳定的发卡结构,这与鲀科鱼类[14]及同目的松江鲈(Trachidermusfasciatus)[15-16]的TAS序列极为相似。此外,在鲬属鱼类中还检测到另外1个可能的TAS序列,褐斑鲬为TACATATATGTA,印度鲬则为CACATATATGTT,两者略有不同,在鲬属鱼类中未发现串联重复序列。
作为控制区中最为保守的区域,本研究在鲬属鱼类中央保守区识别出CSB-D、CSB-E、CSB-F 3个特征片段,全长363 bp。其中CSB-F序列为ATGCAGTAAGAACCGACCAA,紧接其后的CSB-E序列为AGGGACAATTATTGTGGGGG,含有Lee等[17]所描述的GTGGG-box,CSB-D序列为TATTCCTGGCATTTGGTTCCT。鲬属鱼类中央保守区D、E、F 3个保守片段的特征序列与近年来报道的其他鱼类差异不大,较为保守,容易识别。
鲬属鱼类保守序列区全长205~207 bp,通常包含3个保守序列CSB1、CSB2和CSB3。通过比较发现,CSB1变异最大,不易识别,与已报道的一些鱼类CSB1 3′端均含有特征基序GACATA不同,鲬属鱼类中未发现此特征基序,其CSB1普遍形式为ATAACTGATATCATGTACATAA……ATTACCCCC,核心序列为ATAACTGATATCATGTACATAA,与暗纹东方鲀(Takifugufasciatus) CSB1序列(ATTATTGATATCAAGGACATAA)[12]较为相似,仅有4个碱基的差异;其后有1个较为保守的TATGCCCCC序列,这与松江鲈(TGATTTATTACTCGAAACT……ATTTACCCCCC)[13-14]、鳑鲏鱼类(TTATTATTGAAGACATA ……TATGCCCCC序列)[18]CSB1后边检测到的一个以5~6个串联C形式存在的保守序列类似。CSB2含有以TA间隔的两段串联的C,其序列为AAACCCCCCTACCCCCCTAA,CSB2的普遍形式TGAAAACCCCCCGGAAACAG,含有鱼类中以3~6个以串联形式存在的A和C的典型特征(图3)。鲬属鱼类的CSB2、CSB3序列相对较为保守,易于识别。

图3 鲬属鱼类线粒体控制区序列及结构终止相关序列(ETAS)、中央保守序列(CSB-F, CSB-E, CSB-D)和保守序列(CSB1, CSB2, CSB3)用阴影表示; 关键序列用方框表示.
3 讨 论
3.1 辽宁沿海鲬样品种类鉴定
形态学特征分析和mtDNA控制区条形码分析的结果均显示,本次获得的辽宁沿海鲬实为褐斑鲬,而非以往一直认为的印度鲬。辽宁沿海25尾鲬样品背鳍鳍条13~14,臀鳍鳍条13~14,胸鳍鳍条17~19,腹鳍鳍棘Ⅰ,腹鳍鳍条5,侧线鳞数目85~94,尾鳍无黄色条纹,这些特征符合秦岩等[4-5]对褐斑鲬形态特征的描述。DNA条形码一直被认为是鉴别种类的高效而可靠的方法,本研究中,基于D-loop计算的辽宁沿海25尾鲬样品的遗传距离为0~0.008,与褐斑鲬(登录号KC662184)样品间的遗传距离为0.005,属于种内差异水平,远小于鲬属鱼类之间种间进化距离(表2),也证实辽宁沿海鲬样品为褐斑鲬而不是印度鲬。此外,中国海域印度鲬样品与日本附近海域印度鲬样品间差异极大,甚至大于属内不同种间的遗传距离,表明两者为不同的种,这佐证了其他研究者报道的鲬属鱼类中存在隐蔽种的观点,另一种可能是样品鉴定有误,导致结果出现偏差。
3.2 辽宁沿海褐斑鲬控制区序列变异及群体遗传多样性分析
由于受选择压力小、进化速度快,线粒体DNA控制区是进行鱼类遗传多样性研究应用最广泛的分子标记。本研究利用线粒体控制区全序列对辽宁沿海褐斑鲬群体进行的遗传多样性分析表明,其核苷酸多样性指数(0.0026±0.0017)相对较低,而单倍型多样性指数(0.92±0.04)相对较高,属于海水鱼类中高单倍型多样性、低核苷酸多样性的遗传多样性模式[29],这种遗传多样性模式在辽宁沿海分布的海洋生物中普遍存在,如弯棘斜棘(Repomucenuscurvicornis)[30]、细纹狮子鱼(Liparistanakae)[31]、中国明对虾(Fenneropenaeuschinensis)[32]及海蜇(Rhopilemaesculentum)[33-34]等。究其原因,通常认为由于这些海洋生物种群经历了近期的群体扩张,群体的快速增长积累了丰富的单倍型多样性,但缺乏足够的时间来积累足够的核苷酸变异导致[29-33]。在辽宁沿海褐斑鲬群体中检测到的星状结构的单倍型网络关系图、单峰类型的核苷酸不配对分布,以及检验显著的负的Fu′sFs值和Tajima′sD值均揭示,褐斑鲬经历了近期的群体增长。根据参数τ推算,辽宁沿海褐斑鲬群体扩张时间距今约19 000~63 000年,这一时间刻度与晚更新世末—全新世初黄渤海海域发生的多次大范围的海侵和洋面回升事件相吻合,在这一时期,与褐斑鲬同域分布的其他几种海水鱼类如梭鱼(Lizahaematocheila)[10]、弯棘斜棘[30]、黄姑鱼(Nibeaalbiflora)[35]、棘头梅童鱼(Collichthyslucidus)[36]等也经历了类似的晚更新世群体扩张事件。
3.3 鲬属鱼类线粒体控制区的结构
控制区与线粒体DNA的复制、终止、转录密切相关,是线粒体DNA中进化最快、结构最复杂的区域。在对多种鱼类线粒体控制区结构进行的研究表明,鱼类控制区的基本结构大致相同,主要的功能单元较为保守,易于识别,例如终止序列区(ETAS)的终止相关序列以及中央保守区序列(CSB-F、CSB-E、CSB-D)和保守区序列(CSB1、CSB2、CSB3)等[14-28]。此外在一些鱼类如鲱形目[22]、鲽形目[27]种类中检测到控制区全序列存在长度多态性现象,终止序列区长串联重复序列的存在是造成其长度不同的主要原因。本研究通过与其他鱼类的比对,识别了鲬属鱼类终止序列区、中央保守区和保守序列区的相关核心序列。在终止序列区中识别了可形成发卡结构的特征序列(ETAS),其主体序列为TACAT及反向互补序列ATGTA。在鲬属鱼类中未发现串联重复序列,但检测到另外一个可能发生变异的终止相关序列,褐斑鲬为TACATATATGTA,印度鲬则为CACATATATGTT,推测可能仅第一个ETAS能够行使功能,这也佐证了刘焕章[18]的研究结论,他认为鱼类只有一个行使功能的ETAS,但可能存在多个复制的不行使功能的ETAS。
中央保守区的CSB-F、CSB-E、CSB-D的特征序列均相对比较保守,CSB-E 的关键序列中含有GTGGG-box序列[10],与其他多种鱼类的研究结果[14-15,17-18,22]相似。保守序列区的CSB1特征序列在鱼类中存在着较大变异,不易被识别[17-18,22]。在鲬属鱼类保守序列区内并未发现CSB1的特征序列(GACATA),参照暗纹东方鲀[14]及其他鱼类的CSB1序列,本研究发现,鲬属鱼类的CSB1序列为ATAACTGATATCATGTACATAA,并在其后检测到1个较为保守的TATGCCCCC序列,这与松江鲈[15-16]、鳑鲏鱼类[18]等类似。鲬属鱼类的CSB2和CSB3序列相对保守,其中CSB2最为保守,含有以1~3个嘧啶核苷酸间隔的两段串联的C;CSB3富含A和C,与目前已知的鱼类线粒体控制区的结构和进化规律一致[14-28]。
综上所述,分布于辽宁沿海的鲬为褐斑鲬,而非以往认定的印度鲬;辽宁沿海褐斑鲬群体遗传多样性水平偏低,这可能与其自然资源的破坏及过度捕捞有关。由于受采样范围及数量限制,对褐斑鲬遗传多样性及遗传结构方面的了解仍较为缺乏,但本研究的结果表明,线粒体控制区序列是进行鲬属鱼类群体遗传学研究的良好分子标记,可为下一步褐斑鲬的种质资源保护、可持续利用及渔业资源管理提供基础资料。
