澳洲坚果各部位蜀黍苷含量的测定
2018-12-10,,,,,,*
,,,,,,*
(1.暨南大学食品科学与工程系,广东广州510632; 2.广西南亚热带农业科学研究所,广西崇左532415)
澳洲坚果(MacadamiaternifoliaF. Muell.)是山龙眼科、澳洲坚果属植物,营养价值和保健价值高,原产于澳大利亚[1],世界热带地区均已有栽培,我国云南、广东、广西等省已大量栽培。澳洲坚果果实由外壳(青皮)、壳(木质硬壳)和果仁组成[2]。其中,圆形、奶香味的果仁是其唯一的可食用部分,营养丰富,除高含量的脂质(60%以上)外,还含有丰富的蛋白质、碳水化合物、多种重要微量元素和其他生物活性物质,属高档干果,有“干果之王”之称。
澳洲坚果品种甚多,但仅光壳型澳洲坚果(M.Integrifolia)和粗壳澳洲坚果(M.Tetraphylla)及其杂交种有商业价值,其他品种均因其果仁中的蜀黍苷(图1,I,一种生氰糖苷)含量较高而不宜食用,或脱氰后才可以食用[3]。Miller等[4]对澳洲坚果幼苗中的生氰糖苷进行测定,称多数澳洲坚果品种含有蜀黍苷与proteacin两种生氰糖苷,但成熟澳洲坚果各部位蜀黍苷的含量目前仍未见有报道。而我国广西、云南等地现有用澳洲坚果花、叶泡茶[5],其青皮用作饲料或生产抗氧化剂[6]和化妆水[7],其壳用于生产吸附剂[8]等方面的报道,故有必要对澳洲坚果各部位的糖苷毒性进行评估,以保证其用于食品、化妆品和其他领域产品开发利用的安全性。

图1 蜀黍苷酶解途径和苦杏仁苷分子结构Fig.1 Enzymatic hydrolysis pathway of dhurrin and the molecular structure of amygdalin
由蜀黍苷生成氢氰酸(HCN)分为两步。其先被内源性蜀黍苷酶(dhurrinase,EC 3.2.1.21,属于β-D-葡萄糖苷酶)水解,生成葡萄糖和不稳定的对羟基-(S)-扁桃腈(图1,II);此中间产物再在内源性R-羟基腈裂解酶的作用下或碱性条件下,快速转化为游离HCN和对羟基苯甲醛(见图1)。
生氰糖苷含量的测定方法包括间接法和直接法。间接法主要通过检测糖苷水解所释放的HCN以定量生氰糖苷,常用的有巴比妥酸法[9]、碱性苦味酸盐法[10]、硝酸银滴定法、分光光度法[11]、氰化物电极测定法[12]等。这些方法所用仪器简单,但精密度、准确度均较低。为准确、快速、简便地检测澳洲坚果中的生氰糖苷,本实验拟选用价廉易得的苦杏仁苷(图1,IV)作为内标物质,用高压液相色谱法(HPLC)直接定量样品中的蜀黍苷,为成熟澳洲坚果各部位的毒性评估和开发应用提供依据。
1 材料与方法
1.1 材料与仪器
澳洲坚果仁及其油粕、花、叶、青皮、壳 均由广西省寿香乡有机农业产品开发有限公司惠赠(品种包括HAES900、桂热、Own Choice、A16、Pahala、Beaumont,其中所用果仁、青皮和壳取自成熟果实,叶子为幼叶);水:怡宝纯净水 华润怡宝食品饮料(深圳)有限公司;0.45 μm微孔滤膜 天津津腾试验设备有限公司;蜀黍苷标准品 纯度≥90%,经归一化法测定后,按90%计算 法国Extrasynthése公司;苦杏仁苷标准品 纯度≥98%,成都德斯特生物技术有限公司;乙腈 HPLC级,欧普森试剂有限公司;无水乙醇 HPLC级,天津市科密欧化学试剂有限公司;甲酸 分析纯,天津化学试剂一厂。
Shimadzu LC-20AT 高效液相色谱仪 日本岛津公司;Alltech ELSD 2000ES 蒸发光散射检测器 美国Alltech公司;FA1104N电子分析天平 上海精密科学仪器有限公司;SB-5200DTS超声波清洗机 宁波新艺超声设备有限公司;KDC-1044离心机 科大创新股份有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;111型高速中药粉碎机 瑞安市永历制药机械有限公司。
1.2 实验方法
1.2.1 样品提取与制备
1.2.1.1 澳洲坚果花与叶待测样品的制备 参考Kobaisy等[13]所述方法进行澳洲坚果中蜀黍苷的提取,将澳洲坚果花、叶冻干粉碎后,精密称取0.33 g于50 mL容量瓶中,70%乙醇定容后室温下超声30 min。取出,放置过夜。第二天定容后取适量提取液3500 r/min离心30 min。取一定量该上清液,加入已知浓度的苦杏仁苷标准品溶液,0.45 μm微孔滤膜过滤后置于1.5 mL自动进样瓶,HPLC检测。
1.2.1.2 澳洲坚果仁和青皮、果壳样品的制备 澳洲坚果仁称重,粉碎后用正己烷脱脂,干燥至恒重,记录重量。澳洲坚果冷榨油粕亦用正己烷脱脂后干燥至恒重。称取1.36 g脱脂油粕粉置于50 mL 容量瓶中;将澳洲坚果青皮、壳样品进行干燥,粉碎,精密称取2 g于100 mL容量瓶中,70%乙醇定容,其余步骤同澳洲坚果花和叶的处理过程。
1.2.2 HPLC和HPLC-MS分析条件 使用Diamonsil C18色谱柱(150 mm×4.6 mm,5 μm)柱温35 ℃;流动相为乙腈(A)和0.1%甲酸溶液(B)进行梯度洗脱[14],优化洗脱梯度如表1所示,进样量5 μL,流速:1.0 mL/min;ELSD以干燥洁净的压缩空气为雾化气体,压力0.5 MPa,气体流速3.0 L/min,漂移管温度100 ℃,增益值1。通过预实验证实,该条件下,方法噪音信号较小,基线平稳。通过比较样品与标准品的保留时间和峰面积可对样品中的蜀黍苷进行定性定量分析。

表1 HPLC梯度洗脱条件Table 1 Gradient elution of HPLC analysis
质谱条件为:ESI为离子源,同时进行正、负离子模式扫描,离子源温度350 ℃,雾化压力25 psi,干燥气体为N2,流速10 L/min,CID气流230 kPa,DL温度250 ℃,加热块温度400 ℃,接口温度300 ℃,质量扫描范围m/z为300~550。
1.2.3 标准曲线的测定 精密称取5.2 mg蜀黍苷标准品,甲醇溶解定容并进行稀释,得浓度分别为0.52、0.38、0.26、0.13、0.065、0.0325 mg/mL的系列蜀黍苷标准品溶液(-20 ℃保存,1个月内用完[15])。另精密称取8.3 mg内标物苦杏仁苷,用甲醇溶解并定容至25 mL,得浓度0.332 mg/mL的苦杏仁苷标准溶液。分别取上述不同梯度蜀黍苷标准溶液各2 mL于5 mL容量瓶中,各加2 mL苦杏仁苷标准品溶液,甲醇定容至刻度,摇匀,即得含内标物质的系列梯度标准品溶液。0.45 μm微孔滤膜过滤后置于1.5 mL进样瓶中,HPLC分析,分别记录蜀黍苷与苦杏仁苷的峰面积。

式(1)
式中,ωD为样品中蜀黍苷的含量(mg/g),ci(mg/mL)为使用标准工作曲线所得样品提取液中蜀黍苷的浓度(mg/mL),Vextr为提取液总体积(mL),m为样品重量(g)。
1.2.5 方法学试验
1.2.5.1 精密度试验 按照1.2.3中的方法精确配制浓度分别为0.21、0.27 mg/mL的蜀黍苷-苦杏仁苷甲醇标准品溶液,连续进样5次,进样体积为5 μL,对试验结果的精密度进行分析。
1.2.5.2 重复性试验 平行提取澳洲坚果花样品5份,每个样品重复进样5次以考察HPLC分析的重复性。
1.2.5.3 回收率试验 以澳洲坚果花为分析对象,5个平行样品分别加入一定量不同浓度的蜀黍苷-苦杏仁苷混合标准品溶液(其中蜀黍苷浓度分别为0.013、0.0104、0.0078、0.0052和0.0026 mg/mL,苦杏仁苷浓度分别为0.107、0.0785、0.0615、0.0415、0.027 mg/mL)进行提取。每个样品重复进样两次,取其平均值后,按照1.2.2所述标准曲线定量提取液中的蜀黍苷,并与添加量进行比较以计算回收率。
1.2.5.4 稳定性试验 制备澳洲坚果花提取液,分别于0、2、4、8、24 h测定蜀黍苷含量,计算相对标准偏差RSD。
1.3 数据处理
试验结果用Microsoft Excel和SPSS进行分析,取3次或5次平行实验结果的平均值。结果均表示为平均值±标准差,并对几次平行结果的相对标准偏差(RSD)进行计算。
2 结果与分析
2.1 苦杏仁苷符合测定蜀黍苷内标物的标准
对比蜀黍苷(图1,I)与苦杏仁苷(图1,IV)的分子式可以看出:两者结构相近,应当具有类似的色谱行为。由图2可以看出:蜀黍苷(图2A峰)保留时间6.960 min,峰型对称,分离效果良好;苦杏仁苷(图2B峰)保留时间为7.351 min,与蜀黍苷峰相近且完全分离,无干扰,即苦杏仁苷与蜀黍苷保留时间较为接近,可以作为澳洲坚果中蜀黍苷测定的内标物质。此外,在相同实验条件下,蜀黍苷与苦杏仁苷的相对保留时间(蜀黍苷保留时间/苦杏仁苷保留时间)约为0.95∶1,可在本洗脱、测定条件下,作为蜀黍苷的定性分析作参考指标。
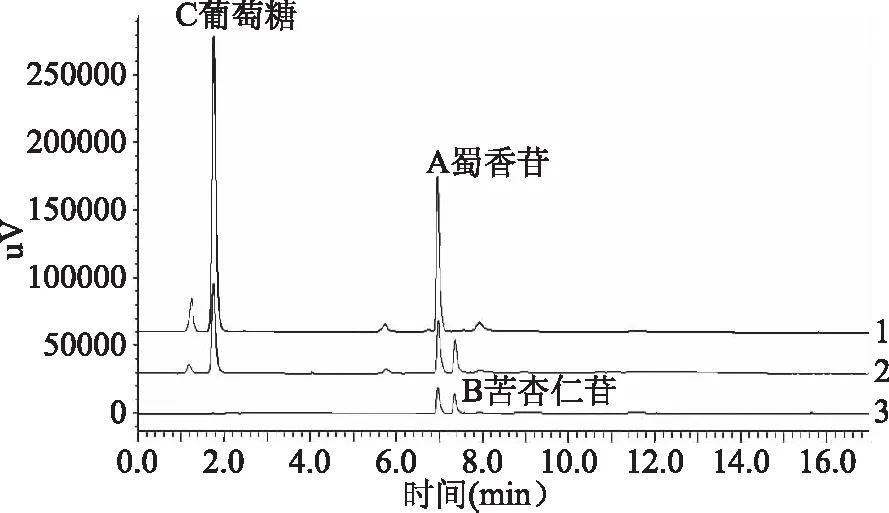
图2 澳洲坚果花提取样品的HPLC色谱图Fig.2 HPLC chromatogram of macadamia flower extraction注:3为蜀黍苷与苦杏仁苷混合标准品,2为加入苦杏仁苷的澳洲坚果花提取液,1为未加苦杏仁苷的澳洲坚果花提取液。
采用液质联用法对图2A峰进行测定,在ESI正离子模式下,该峰的一级质谱离子峰为:[M+NH4]+329,[M+Na]+334,[M+K]+350;负离子模式下,离子峰为:[M-H]-310,[M+Cl]-346,[M+HCOO]-356。据这些相关峰,可以计算出准分子离子峰的分子量M为311,而蜀黍苷分子式C14H17NO7,其分子量也是311。从上述HPLC保留时间与HPLC/MS两方面的证据,均证实图2A峰为蜀黍苷。由此可见,澳洲坚果样品中不含苦杏仁苷(图2B)、而两种生氰糖苷色谱行为相同,即杏仁苷可以作为内标测定澳洲坚果中的蜀黍苷。
2.2 蜀黍苷的标准工作曲线
将一定浓度的蜀黍苷标准品甲醇溶液进行逐级稀释,并用HPLC定量检测,信噪比为3时所对应的蜀黍苷溶液浓度即为本方法的检出限。结果显示,检出限为3.0×10-3mg/mL,检测范围为0.0330~0.4554 mg/mL。
2.3 方法学试验
按1.2.5所述进行方法学试验,所获结果见表2。精密度试验结果RSD为2.60%,仪器精密度良好。重复性试验结果的RSD为1.50%,表明方法重复性良好。24 h内,样品中蜀黍苷定量结果的RSD为0.82%,平均回收率为97.93%±2.35%,RSD为2.39%,检测结果可靠。因此,从稳定性、回收率、准确度等方面考虑,该法是测定澳洲坚果中的蜀黍苷含量的适宜方法。

表2 方法学试验结果Table 2 Results of methodology test
2.4 澳洲坚果各部位蜀黍苷的含量和毒性评估
2.4.1 澳洲坚果各部位蜀黍苷的含量 HPLC-ELSD内标法测定澳洲坚果各部位蜀黍苷含量的结果见表3,其中澳洲坚果花中蜀黍苷的含量最高(49.92±0.96) mg/g,其后依次为叶>青皮>壳>油粕>果仁,这与Dahler等[17]所述生氰糖苷主要存在于生长代谢旺盛组织的报道一致。由表4可知,不同品种澳洲坚果青皮中蜀黍苷含量存在较大差异,其中含量最少的为Pahala,测定结果为(0.51±0.03) mg/g;含量最高的为Beaumont,测定结果为(5.74±0.08) mg/g,相差2~15倍。因此,在选育澳洲坚果品种、考虑利用澳洲坚果青皮资源时,应当以蜀黍苷含量作为重要品质指标之一。

表3 澳洲坚果不同部位蜀黍苷的含量(不同品种的平均值)Table 3 Dhurrin content in different part of macadamia(Average value of different cultivars)
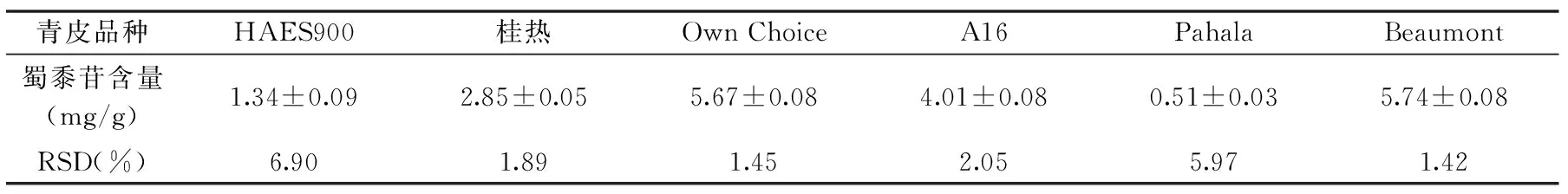
表4 不同品种澳洲坚果青皮中蜀黍苷的含量Table 4 Dhurrin content in different macadamia husks
2.4.2 澳洲坚果各部位用作食品原料的安全性分析 生氰糖苷的毒性是由其水解所得氰氢酸和醛类化合物产生的,氰氢酸最小致死口服剂量为0.5~3.5 mg/kg体重[18]。而对于人体,若体重按50 kg算,口服约25 mg HCN致死;换算成对应蜀黍苷含量(假设完全水解成产物),该剂量相当于澳洲坚果花、叶、果仁、油粕、壳、青皮(干重计)分别为19.58、36.04、1078、308.27、709.38、269.56 g。可以看出:澳洲坚果仁蜀黍苷含量最低,而且每日摄入量一般小于100 g,因此,食用澳洲坚果仁不会导致氢氰酸中毒,即食用澳洲坚果仁是安全的。但澳洲坚果花、叶、油粕、壳、青皮中蜀黍苷含量则相对较高,尤其是花的含量最高;若将花、叶等部位用于生产茶类(每天摄入量小于2~4 g)时,亦应当是安全的;但若将其用作饲料,由于牲畜日摄入量比较大,则应考虑脱除蜀黍苷以保证牲畜安全。实际上,蜀黍苷酶解不可能完全产生游离HCN,其具体的转化率则视植物组织受损情况、环境温度、pH等诸多因素影响,故具体的转化率数据还有待后续实验研究。因此,如果拟利用澳洲坚果花、幼叶加工花茶、浸泡酒等食品时,应当考虑脱除其所含的蜀黍苷;而澳洲坚果的青皮、壳、油粕、果仁中蜀黍苷含量一般低于5 mg/g,可以不采用脱除蜀黍苷的工艺处理措施。
3 结论
选用苦杏仁苷作为内标物质,使用HPLC-ELSD内标法对澳洲坚果花、叶、果仁、青皮和壳中的蜀黍苷进行定量检测,试验结果表明该方法准确度、稳定性和重复性均较好,可作为澳洲坚果中蜀黍苷的一种快速简便的检测方法。通过对澳洲坚果不同部位蜀黍苷含量进行定量分析,其中花中蜀黍苷含量最高,叶次之,而果仁中仅含微量的蜀黍苷,在安全食用范围之内。苦杏仁、银杏等中草药中所含的生氰糖苷,常常是其重要的活性成分;而对于单蜀黍苷的生物活性则有待进一步研究。
