克氏原螯虾壳膜几丁质酶的分离纯化
2018-12-10,,
,,
(1.上海海洋大学食品学院,上海 201306; 2.上海水产品加工及贮藏工程技术研究中心,上海 201306; 3.国家淡水水产品加工技术研发分中心(上海),上海 201306)
几丁质是N-乙酰葡糖胺通过β-1,4糖苷键连接聚合而成的不溶性多糖。是自然界中最丰富的多糖之一,主要构成真菌细胞壁[1],以及一些节肢动物的角质层和外皮[2]。几丁质酶广泛存在于各种生命体中,从微生物、动植物到人类均能产生几丁质酶,参与多种生物过程,包括几丁质食物消化,形态发生,发病机理和防御带有几丁质的病原体等。几丁质酶酶系包括几丁质内切酶、外切酶和N-乙酰-β-D-氨基葡萄糖苷酶,只有这三种酶协同发挥作用,才能将天然存在的几丁质酶彻底分解为单糖[3-4]。
目前几丁质酶在食品、医疗及环保等诸多行业开始逐渐发展起来,具有广泛的应用,如在生物防治方面,几丁质酶可作为保护植物的化学农药替代品,由于几丁质是许多真菌细胞壁的重要成分,可借助基因工程将几丁质酶基因导入植物细胞,培育出可以抑制病原真菌侵袭的转基因植物。在药物治疗上,几丁质酶可用于增强抗真菌药物的活性,因此可添加在抗真菌乳膏和乳液中。另外有研究表明哺乳动物酸性几丁质酶(AMCase)是控制哮喘疾病中的一个重要媒介[5]。在降解产物方面,甲壳动物约75%的总重量为下脚料,其中几丁质占下脚料干重的20%~58%[6],所以生产几丁质酶是利用好甲壳动物几丁质下脚料的关键。目前关于甲壳动物几丁质酶的研究主要包括虾、蟹、鳃足虫、溞等[7]。这些研究主要集中在微生物产酶、酶基因表达及克隆以及几丁质酶在蜕壳中的生理作用等。有关体内天然几丁质酶分离纯化的研究不多,所采用的纯化手段也不尽相同,但主要以凝胶层析、离子层析、亲和层析居多。
克氏原螯虾(Procambarusclarkii),也称小龙虾、红螯虾等,隶属节肢动物门甲壳纲,是营养价值较高、具有一定保健作用的水产品[8]。克氏原螯虾从幼虾到性成熟要经过11次蜕壳[9]。随着几丁质酶基础研究的日益发展,几丁质酶的来源已经扩展到几乎整个生物界,从富含几丁质的甲壳动物体内提取几丁质酶不失为一种产生几丁质酶的理想来源,本文以克氏原螯虾虾壳为材料,分离纯化几丁质酶,以期为后续酶学性质的研究提供基础,为不同生物来源的几丁质酶系的性质和功能的比较研究提供借鉴,对于丰富几丁质酶多样性,提供充分的科研支持具有重要的现实意义。
1 材料与方法
1.1 材料与仪器
新鲜克氏原螯虾 上海古棕路菜市场;几丁质 安徽酷尔生物工程有限公司;N-乙酰氨基葡萄糖苷 南京奥多福尼生物科技有限公司;Sephadex G-100葡聚糖凝胶填料、苯基疏水低取代填料、DEAE-32纤维素填料填料 购于GE公司;三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、丙烯酰胺、N,N-甲叉双丙烯酰胺、聚丙烯酰胺凝胶电泳(SDS-PAGE)标准蛋白 购于生工;3,5-二硝基水杨酸、盐酸、氯化钠、硫酸铵、氢氧化钠等 购于国药公司,分析纯。
SS250-E组织捣碎机 方胜电器实业有限公司;KYC-100C恒温振荡水浴锅 上海新苗医疗器械制造有限公司;PHS-3C pH计 上海雷磁仪器公司;Sorvall Lynx 4000高速冷冻离心机 赛默飞世尔科技;YC-2型层析实验冷柜 北京博医康实验仪器有限公司;CHRIST ALPHA1-2冷冻干燥机 北京博劢行仪器有限公司;DYY-III型稳压稳流电泳仪、DYCZ-24D型垂直板电泳槽 北京市六一仪器厂;UNICO UV-2000型紫外可见分光光度计 北京谱析通用仪器有限责任公司;TS-2000A型脱色摇床 海门市其林贝尔仪器制造有限公司;凝胶成像仪 Bio-Rad公司;MALDI Biotyper飞行时间质谱仪 北京布鲁克(BRUKER)科技有限公司。
1.2 实验方法
1.2.1 胶体几丁质的制备 参照李奕雅[10]的方法作部分改动。10 g几丁质缓慢加入到60 mL预冷的浓HCl中,4 ℃剧烈搅拌12 h,倒入1 L 4 ℃的95%乙醇中,磁力搅拌并室温放置12 h,4 ℃、5000 r/min离心20 min,收集沉淀,蒸馏水洗至中性后用50 mmol/L Tris-HCl(pH7.5)缓冲液配成1%胶体几丁质。
1.2.2 粗酶液的制备 参照Koga等[11]、林建城[12]的方法作部分改动。将克氏原螯虾解剖,操作过程中尽可能不破坏虾壳内附着的一层壳膜,以W∶V=2∶1加入预冷的50 mmol/L Tris-HCl(pH7.5)缓冲液,于高速组织捣碎机中匀浆1~2 min,放置4 ℃冰箱抽提过夜,10000 r/min下离心10 min,取上清液即得到粗酶液,分装后置于-80 ℃冰箱内保存。
1.2.3 酶的分离纯化
1.2.3.1 硫酸铵分级沉淀 取粗酶液进行硫酸铵分级沉淀。收集沉淀蛋白,用少量的50 mmol/L Tris-HCl(pH7.5)缓冲液溶解,以相同缓冲液为外液进行充分透析,用等量1% BaCl2与透析外液混合,直至无白色沉淀为止为透析充分。
1.2.3.2 Sephadex G-100葡聚糖凝胶层析 经透析除盐后的酶液上样于已用50 mmol/L Tris-HCl(pH7.5,含有0.2 mol/L NaCl)缓冲液平衡好的凝胶层析柱,柱规格为1.6 cm×50 cm,流速为8 mL/h,自动收集,每管3.5 mL。检测每管蛋白质含量和酶活力,收集酶活较高的洗脱峰。
1.2.3.3 苯基疏水层析 将1.2.3.2所得活力组分冷冻浓缩后加入硫酸铵调节其终浓度为1 mol/L,过0.45 μm滤膜后上样于已用50 mmol/L Tris-HCl(pH7.5,含1 mol/L硫酸铵)缓冲液平衡好的疏水层析柱,柱规格为 2.6 cm×7 cm,待上述缓冲液流洗去除不结合的杂蛋白之后,分别用含1~0 mol/L(间隔0.5 mol/L)硫酸铵的缓冲液阶段梯度洗脱,流速为1 mL/min,自动收集,每管3 mL,检测每管蛋白质含量和酶活力,收集酶比活较高的洗脱峰。
1.2.3.4 DEAE-32阴离子层析 经苯基疏水层析收集的酶液装入透析袋,用50 mmol/L Tris-HCl(pH7.5)缓冲液为外液进行充分透析,浓缩后过0.22 μm滤膜后,上样于已用50 mmol/L Tris-HCl(pH7.5)缓冲液平衡好的离子层析柱,柱规格为2.6 cm×10 cm,分别用含0~0.6 mol/L(间隔0.2 mol/L)NaCl的缓冲液作阶段梯度洗脱,流速为1 mL/min,自动收集,每管3 mL。测定每管蛋白质含量和酶活力,收集酶比活较高的洗脱峰。
1.2.4 蛋白质含量的测定
1.2.4.1 蛋白质标准曲线的测定 采用Folin-酚试剂法[13]测定蛋白浓度。精确称取0.0300 g牛血清白蛋白溶解于离子水中,定容至100 mL,配成0.3 mg/mL的标准溶液。取该溶液稀释成不同浓度:0.06,0.12,0.18,0.24,0.3 mg/mL。取不同浓度的蛋白标准溶液1 mL,分别加入5 mL Folin-酚A试剂,混匀后室温放置10 min,再加入0.5 mL Folin-酚B试剂,立即摇匀,室温放置30 min后于650 nm处测定吸光度值。以OD650为纵坐标,蛋白标准溶液浓度为横坐标绘制标准曲线。
1.2.4.2 样品蛋白含量的测定 取1 mL稀释一定倍数的酶液,按1.2.4.1中步骤加入Folin-酚各试剂,测定其OD650。根据1.2.4.1得蛋白质含量标准曲线方程为y=0.00231x,x代表蛋白质含量,y代表OD650,R2=0.9972,通过标准曲线公式计算可得出对应的蛋白质含量。
1.2.5 几丁质酶活力测定
1.2.5.1 几丁质酶活力标准曲线的测定 采用DNS法测定酶活力。精确称取0.1000 g N-NAG溶解于去离子水中,定容至100 mL,配成1 mg/mL的N-NAG标准品。取该溶液稀释成不同浓度:0.1,0.2,0.3,0.4,0.5 mg/mL。取不同浓度的N-NAG标准品1 mL,分别加入2 mL DNS试剂,煮沸5 min,冷却至室温后,于500 nm处测定吸光度值。以OD500为纵坐标,N-NAG浓度为横坐标绘制标准曲线。
1.2.5.2 酶活体系的测定 以沸水浴煮沸5 min的热变性酶为对照组,取1.5 mL胶体几丁质与1 mL酶液混匀,40 ℃反应30 min后立即加入1 mL的2.0 mol/L NaOH溶液终止反应。取上述混合液1 mL,加入2 mL DNS试剂,沸水浴显色5 min,冷却后于10000 r/min离心10 min,取上清液定容至4 mL,测定500 nm处吸光度值。1个酶活力单位定义为:上述条件下,每毫升溶液中每分钟水解胶体几丁质释放lμg的N-乙酰氨基葡萄糖(N-NAG)所需的酶量。根据1.2.5.1得N-NAG标准曲线方程为y=1.83x,x代表N-NAG含量,y代表OD500,R2=0.9906,通过标准曲线公式计算样品酶液N-NAG的生成量而得出几丁质酶活性。
1.2.6 酶相对分子质量和纯度鉴定 分子质量测定结合SDS-PAGE和飞行质谱。SDS-PAGE:分离胶浓度为12%,浓缩胶浓度为5%,用标准蛋白质(14.4~97.4 KDa)作为参照,将几丁质酶样品与上样缓冲液按比例混合,沸水浴煮沸5 min,冷却后上样。浓缩胶电流为15 mA,分离胶电流为30 mA。用1%考马斯亮蓝R-250对凝胶染色,根据已知分子量的标准蛋白在SDS-PAGE中的相对迁移率Rf,作Rf-lgMr图,求得样品相对分子质量;飞行质谱:取1 μL稀释后的酶样品与1 μL饱和CHCA基质溶液混匀,点在飞行质谱仪的ground steel靶板上,自然干燥后送入质谱仪中检测。
1.3 数据处理
每次实验结果均为3次测定求平均值。统计分析采用通用统计软件Excel 2016。
2 结果与分析
2.1 纯化结果
2.1.1 硫酸铵分级沉淀 克氏原螯虾壳膜经Tris-HCl缓冲液抽提出粗酶液之后进行硫酸铵分级沉淀,从图1可以看出随着硫酸铵饱和度的增大,上清液中的蛋白含量和酶活力都呈下降趋势,硫酸铵饱和度在0~30%之间酶活降低较慢,但蛋白质含量下降幅度较大,说明目标酶基本上还留在上清液中,沉淀中主要为其他杂蛋白;当硫酸铵饱和度达到70%时,上清液中的酶活力基本不再减少,趋于平缓,说明大部分酶已经被沉淀,综合酶活与酶回收率两方面考虑,确定收集30%~70%的沉淀。收集沉淀之后用少量缓冲液复溶,透析之后获得了纯化倍数为1.50倍的粗酶制剂。
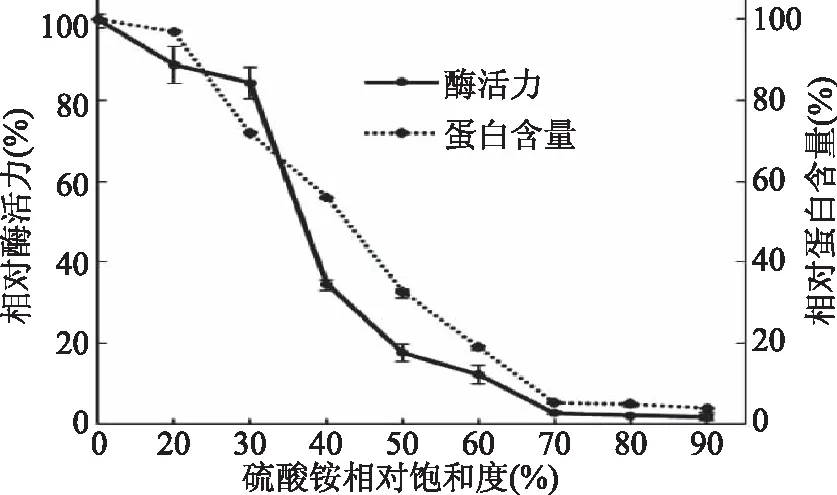
图1 硫酸铵分级沉淀Fig.1 Ammonium sulfate fractionation
2.1.2 Sephadex G-100凝胶层析 经硫酸铵沉淀之后的酶液上样于Sephadex G-100凝胶层析,根据分子量大小的差异,洗脱出3个蛋白质峰和3个酶活力峰(图2),其中酶活力峰p1和p3的比活力都较高,但p3蛋白含量较低,p1与p2未完全分开,考虑到三个峰的重叠情况和保证酶的回收率,收集14~25管进行后续纯化,酶经此步骤获得了比活力7.65 U·mg-1,纯化倍数为2.77倍的酶制剂。
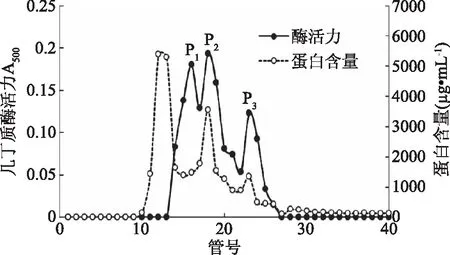
图2 Sephadex G-100凝胶层析洗脱图谱Fig.2 Sephadex G-100 chromatography
2.1.3 苯基疏水层析 上一步收集的酶活力峰冷冻浓缩后,上样于苯基疏水层析柱进一步纯化,根据蛋白质疏水性的差异,在洗脱过程中共出现了3个蛋白峰(图3),其中p1为一开始用含1 mol/L硫酸铵的缓冲液洗脱出的部分未吸附上柱的杂蛋白,通过逐步降低硫酸铵浓度洗脱出2个蛋白质峰(p2、p3),均检测出了酶活,p2的酶比活力最高,因此收集p2进行后续纯化,此时洗脱液中硫酸铵浓度约为0.5 mol/L左右。此步的纯化倍数为10.54,比上一步提纯近4倍。
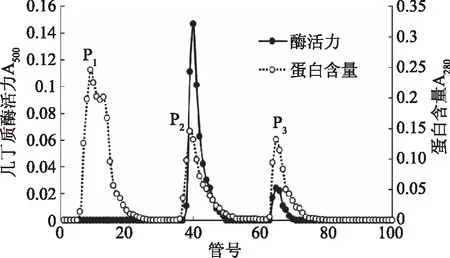
图3 苯基疏水层析洗脱图谱Fig.3 Phenyl Sefinose 6 Fast Flow chromatography
2.1.4 DEAE-32阴离子层析 苯基疏水层析所得酶液经透析除盐,浓缩后上样于DEAE-32阴离子层析柱。根据蛋白质所带电荷的不同,共洗脱出3个蛋白峰(图4)。当离子强度约为0.2 mol/L时活性部分被洗脱下来。此步提纯1.5倍多,回收率为22%。
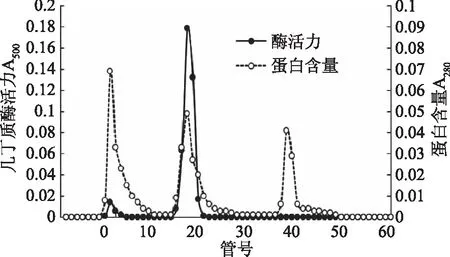
图4 DEAE-32阴离子层析洗脱图谱Fig.4 DEAE-32 Sepharose Fast Flow chromatography
从表1可以看出,本研究对从克氏原螯虾壳膜中粗提出的几丁质酶进行了4步纯化:硫酸铵分级沉淀、G-100凝胶层析、苯基疏水层析、DEAE阴离子层析,最终几丁质酶的比活达44.93 U/mg,纯化倍数约16.28倍,酶回收率为2.98%。其中G-100凝胶层析的纯化倍数较低,可能是为了保证酶回收率而选择的酶活力峰区间较宽造成的。苯基疏水层析的纯化效果较高,说明几丁质酶与其他杂蛋白的疏水差异较大。Michiko KONO等[14]对日本对虾肝脏几丁质酶进行了盐析和2次Sephadex G-100凝胶层析、2次DEAE离子交换层析、1次CM离子交换层析、1次羟磷灰石离子层析,虽然得到了纯化了61.3倍、回收率为20.9%的高纯度几丁质酶,但操作步骤过于繁琐,不适于放大生产。程明哲等[15]对中国对虾虾头采用了无机沉淀和一次精制几丁质亲和层析,得到了纯化倍数达108倍的几丁质酶制剂。亲和层析是分离蛋白质的一种极为有效的方法,根据载体与被分离物质之间高度的亲和力而进行分离,通常只需经过一步即可使样品从复杂的蛋白质混合物中分离出来,但载体交昂贵,配基制备困难,有的配基本身要经过分离纯化,且实验条件不同也会造成纯化结果不同。李奕雅[10]通过Affi-Gel blue亲和层析、CM-Sephadex C-50弱阳离子交换层析和Sephadex G-75凝胶层析三种分离技术,从花生中分离纯化出一种抗菌几丁质酶,纯化倍数为46倍,回收率只有0.009%。造成本实验酶回收率较低的原因可能是,粗酶液中的部分杂蛋白和几丁质酶有相似的酶切作用,都可以产生N-NAG,使得粗酶液总活力很高,而经过3步纯化后,酶液中已不含有其他杂蛋白,总活力降低,导致回收率不高。另外蛋白质经过柱层析会被缓冲液稀释,可通过冷冻浓缩富集之后再上样,但缺点是比较耗时耗原料,应尽可能在短时间的实验周期内多次将样品富集以提高纯化倍数和回收率。
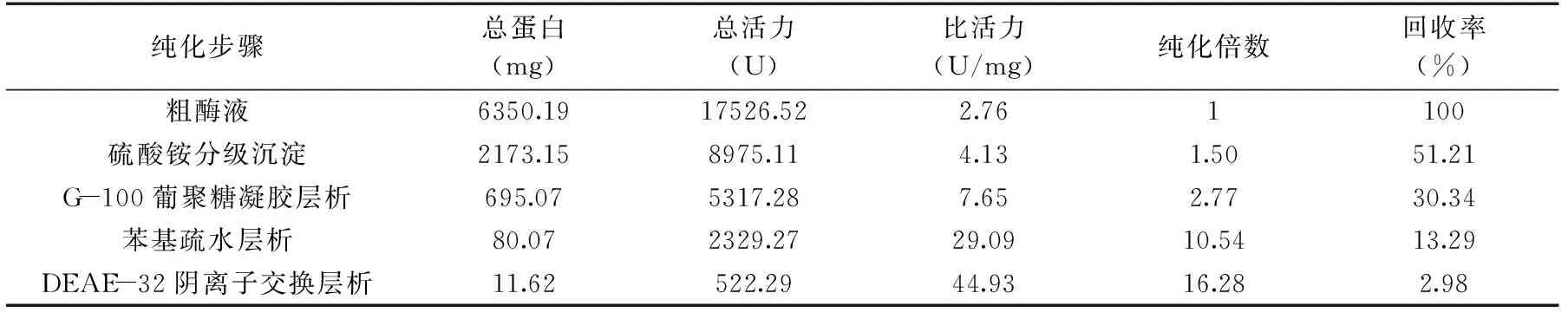
表1 克氏原螯虾壳膜几丁质酶的纯化结果Table 1 Purification of chitinase from shellfish of Procambarus clarkii
2.2 分子质量和纯度
SDS-PAGE显示经过DEAE收集的活性部分只含有1条蛋白带,说明几丁质酶已经达到电泳纯度,纯化步骤完成,所得几丁质酶无亚基,为单体结构(图5)。以标准蛋白质的相对迁移率为横坐标,以标准蛋白质的分子量的对数值为纵坐标,绘制标准曲线,直线的方程为y=-1.38x+2.30。根据样品的迁移率,可求得几丁质酶分子量约为36.8 kDa(图6),与飞行质谱检测出的酶分子量37.7 kDa(图7)相近。
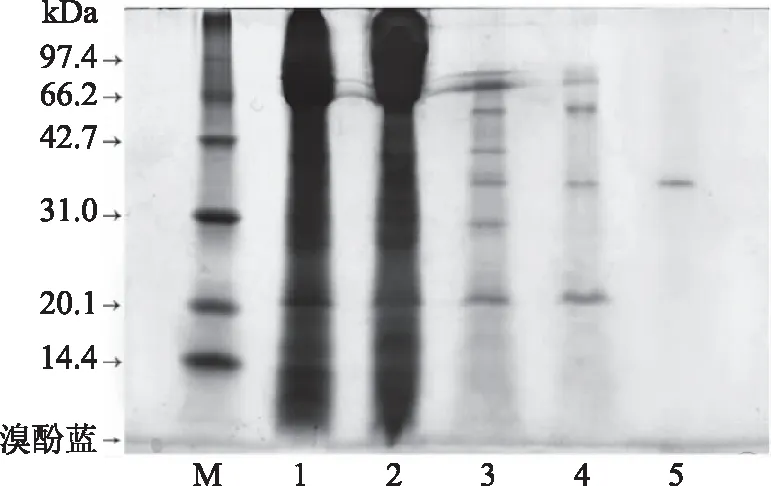
图5 克氏原螯虾几丁质酶纯化过程电泳图Fig.5 SDS-PAGE of chitinase from Procambarus clarkia注:M:标准蛋白;1:粗酶液;2:30%~70%硫酸铵沉淀后酶液;3:G-100凝胶层析后酶活力峰;4:苯基疏水层析后酶活力峰;5:DEAE-阴离子层析后酶活力峰。
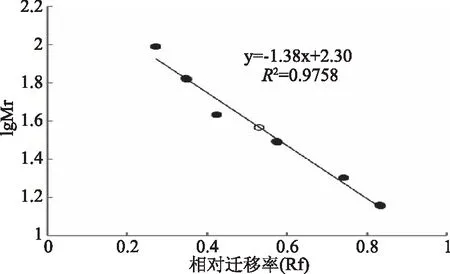
图6 SDS-PAGE蛋白相对分子量对数与电泳相对迁移率关系图Fig.6 Relation curve of lgMr and SDS-PAGE relative front
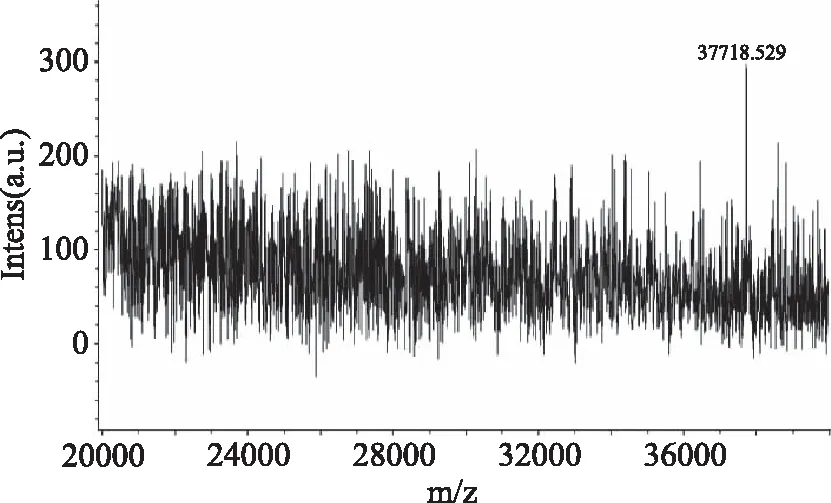
图7 飞行质谱测定几丁质酶分子量Fig.7 Determination of chitinase molecular weight by flight mass spectrometry
通常几丁质酶相对分子质量在20~120 kDa之间,不同来源的几丁质酶相对分子量差异较大,已报道的虾、蟹等甲壳类动物一般在30~70 kDa之间,本实验结果与罗氏沼虾[16]肝胰腺中提取到的几丁质酶(38 kDa)和日本对虾[14]肝脏中分离出的几丁质酶(37 kDa)分子质量相当;但低于凡纳滨对虾[17]消化腺中的几丁质酶(50 kDa),中国对虾[15]虾头几丁质酶(44.7kDa)以及脊尾白虾[18]肝胰腺中的两种几丁质酶(65、44 kDa);高于丰年虫[19]的几丁质酶(32 kDa);Lynn[20]在和克氏原螯虾同属十足目的美洲螯龙虾胃液内提取出三种分子量都为66 kDa的几丁质酶,说明几丁质酶分子质量大小会因种族、部位及其生活环境差异而各不相同。陈欣颖[21]从克氏原螯虾内脏中分离出一种N-乙酰-β-D-氨基葡萄糖苷酶,测得该酶含有79.9、38.8 kDa两条亚基,全酶分子量为118.66 kDa,几乎是本实验结果测出的几丁质酶分子量的3倍,由此可见虽然同属于一个物种的几丁质酶系,但不同的酶之间差距也非常大。
3 结论
本实验以克氏原螯虾壳膜为提取材料,经过匀浆抽提得到粗酶制剂,进一步通过硫酸铵沉淀、G-100凝胶层析、苯基疏水层析、DEAE-32离子层析几种不同的分离方法纯化出了比活力为44.93 U/mg,纯化倍数约16.28倍,酶回收率为2.98%的几丁质酶,SDS-PAGE显示只有一条蛋白带,表明几丁质酶已达到电泳纯,该酶为单体结构,不含亚基,结合飞行质谱测定出该几丁质酶为37.7 kDa。存在的问题是回收率不高,纯化步骤略繁琐,但可为以后纯化步骤提供有利条件,今后可考虑采用亲和层析等其他方法进行比较及改善,对纯化路线的优化有利于酶活的保持和几丁质酶纯度的提高。在酶分离纯化的过程中发现G-100凝胶层析出现了三个酶活力峰,并且苯基疏水层析分离出有较弱的几丁质酶活性的酶活力峰,说明可能有同工酶的存在,有待于进一步的纯化。酶的分离纯化过程是对其接下来各种性质等研究的分子基础,为进一步探讨酶的结构与功能、酶活性调控与克氏原螯虾生长发育、疾病及环境因素之间的相关性奠定重要的研究基础。
