还原氧化石墨烯/介孔TiO2复合材料的合成及其光解水制氢性能
2018-12-10谢怡婷王亚飞
谢怡婷 谭 涓 王亚飞 于 靖 刘 靖
(大连理工大学化工与环境生命学部化工学院,大连 116024)
0 引 言
科技的进步离不开能源的支持,但是当今以化石燃料为主的能源消费结构不仅造成能源的快速消耗,还带来大量污染物(如 CO2、SO2、氮氧化物、可吸入性固体颗粒等)的排放问题[1]。因此,高效、清洁能源的利用是目前亟待解决的世界性问题[2]。氢气是一种超清洁二次能源,具有燃烧热值高、可再生、清洁无污染、运输与存储方便等优点日益受到重视[3-4]。此外,作为重要的化工原料,氢气在内燃机燃料、制冷剂制备、加氢等领域也有着广泛的应用。随着氢技术领域的不断创新,研究者也将越来越多的目光投入到氢能的利用上。2015年,国际能源署发布了《世界能源展望》的专题报告,再一次强调了氢能的重要,预计至2040年底,氢能的使用量在总能源消耗中的比例将达50%。
但是,截至目前,工业上化石燃料法制氢所占比重高达90%以上[5-6],此外,还有生物制氢[7]、电解水制氢[8]、催化分解低碳氢化合物制氢[9]、人工光合作用制氢[10]、光电解水制氢和太阳能制氢[11]等技术。自1972年Fujishima等[12]首次在TiO2电极上观测到光解水产氢现象以来,开发利用太阳能光催化制氢的技术已成为全球瞩目的研究课题。用于光催化制氢领域的催化材料主要有二氧化钛、硫化物及其固溶体类半导体化合物,以及新型的铌基、钽基和层状化合物等[13-20]。其中,TiO2由于其高效、低价、光稳定性高及无毒害等特点被认为是最有前景的光催化材料[21],但是由于 TiO2的禁带宽度较大(3.2 eV),对紫外光的吸收效率较高,而对占太阳光能量的43%的可见光则无响应,因此,研究者从价态和性质不同的元素入手,对其进行化学修饰及调变,合成了许多离子掺杂型[22-24](如 Pd-TiO2、C-TiO2、F-TiO2等)及复合型[25-27](如 CdS/TiO2、CuS/NiS/TiO2、rGO-TiO2等)光催化材料,以提高其在可见光下的制氢效率。
在本文中,采用溶胶凝胶法,以TTIP为钛源,CTAB为模板剂,水和乙醇溶液为溶剂,在不同条件下合成了介孔二氧化钛,在一定温度下焙烧后获得具有较大比表面的光催化材料(m-TiO2),并研究了合成体系的温度、水量、模板剂用量、焙烧温度和催化剂用量等因素对合成样品在紫外光下光催化水解产氢性能的影响。在此基础上,采用水热法制备了还原氧化石墨烯 (rGO)和介孔TiO2的复合材料rGO/m-TiO2,并对其在紫外光和可见光条件下的制氢性能进行了评价。介孔TiO2和rGO光催化剂之间的协同效应能够有效降低光生电子与空穴的复合率,达到更高的太阳能利用效率,使得TiO2类材料在解决环境污染和能源危机等方面具有更广阔的前景。
1 实验部分
1.1 样品的合成
将 1.64~8.20 g CTAB 溶解在 80~125 mL体积之比为4∶1的去离子水和无水乙醇混合溶液中,搅拌30 min使CTAB充分溶解,再逐滴滴入15 g钛酸四异丙酯(TTIP,95%),得到 nCTAB∶nTiO2∶nH2O=(0.1~0.5)∶1.0∶(90~130)的凝胶,在 20~70 ℃下搅拌 24 h 后,将所得产物用无水乙醇洗涤、分离,在50℃下干燥12 h,得到原粉样品,将原粉样品置于空气气氛下经250~650℃焙烧3 h,得到的样品记为m-TiO2。
取 0.5~4.0 g氧化石墨烯(GO)置于 60 mL体积之比为1∶2的乙醇水溶液中,超声分散1 h后加入0.25 g m-TiO2样品,搅拌30 min后转移到100 mL带有聚四氟内衬的高压反应釜中,于150℃晶化6 h,骤冷后用去离子水洗涤并干燥,得到的复合材料记为rGO/m-TiO2,rGO的复合量以GO和m-TiO2的质量比值(wGO/wTiO2)计。
1.2 样品的结构表征
采用日本理学D/MAX-2400型X射线衍射仪测定样品物相和相对结晶度,以Cu Kα(λ=0.154 nm)为辐射源,管电压40 kV,管电流100 mA。扫描范围2θ=0.6°~80°,步幅 0.02°。 采用美国 FEI公司的场发射透射电子显微镜TF30观察样品的介孔结构,操作电压为200 kV,晶格分辨率为0.10 nm,点分辨率为0.20 nm。采用日本JASCA公司的紫外-可见分光光度计UV-550测定样品的紫外-可见漫反射吸收光谱。测定波长范围为200~900 nm,以固体BaSO4为参比白板。
样品比表面积和孔径分布测定采用Quantachrome公司的NOVA4000型物理吸附仪,测定前的样品于300℃下真空脱气处理2 h。样品的比表面积通过BET方法求得。样品的孔径分布由BJH方法根据氮气物理吸附曲线计算。
1.3 样品的光催化性能评价
紫外光条件下的光催化反应光源为500 W高压汞灯,光线通过循环冷却水,除去红外光部分。可见光条件下的光催化反应光源为500 W氙灯,光线依次通过420 nm滤波片和循环冷却水,除去红外光部分和紫外光部分。光催化反应在40 mL石英试管中进行,采用原位光沉积法对催化剂进行0.5%(w/w)的Pt负载。在石英反应试管中依次加入m-TiO2样品 0.005~0.025 g,25 mL 浓度为 5%~30%(V/V)的甲醇与去离子水的混合溶液,2.32×10-3mol·L-1氯铂酸溶液35μL,然后将石英试管密封,置于光化学反应仪中,搅拌使催化剂保持悬浮状态,于室温、氮气气氛下密闭反应2~5 h,每小时用气袋取气1次。紫外光条件下的光催化反应气相产物用注射器抽取,记录产氢体积。可见光条件下的光催化反应气相产物采用上海天美科学仪器有限公司的GC7900型气相色谱分析,检测器为TCD,色谱柱为TDX-01,以Ar为载气,外标法定量分析。
根据测得的产氢数据及公式(1)计算出样品的光-氢能能量转换效率(η):

其中AR为反应器的受光面积,m2;E为光谱辐射照度,W·m-2;RH2为产氢速率,mol·s-1;△GH2为反应储存的能量,J·mol-1,根据公式(2)计算:

2 结果与讨论
2.1 m-TiO2光催化材料的合成
采用溶胶凝胶法,以CTAB为模板剂,TTIP为钛源,在一定温度下合成了m-TiO2样品。图1(A,B)分别给出了原粉样品的XRD图和TEM照片。由图1(A)可见,在低角区,2θ为 1.9°处出现了一个较宽的衍射峰,d值约为4.65 nm,可以归属为介孔材料的特征峰;而在高角区未出现明显的衍射峰,说明样品的骨架为无定型结构。由图1(B)可以清晰的看到m-TiO2的介孔孔道结构,其孔径大小均匀,表现出典型的虫孔型介孔结构特征。

图 1 m-TiO2原粉样品的 XRD 图 (A)和 TEM图 (B)Fig.1 XRD pattern (A)and TEM image (B)of as-synthesized m-TiO2 sample
图2 给出了经不同温度焙烧后的m-TiO2样品在高角区的XRD图。由图可见,当焙烧温度为250℃时,没有出现明显的衍射峰,说明样品仍为无定型结构;当焙烧温度升高至350℃时,在2θ为25.4°、37.9°和 48.1°处出现锐钛矿相 TiO2的特征衍射峰[28],但其相对结晶度较低;随着焙烧温度的升高,锐钛矿相TiO2的特征峰强度逐渐增大,当焙烧温度为550℃时,其强度达到最高。当焙烧温度继续升高至650℃时,在2θ为27.4°处出现了新相的强衍射峰,可以归属为金红石相TiO2,说明此时样品的大部分结构已由锐钛矿相转变为金红石相。
未焙烧的原粉样品和经350~550℃焙烧后的m-TiO2样品的比表面积(SBET)和孔容(Vp)列于表 1 中,由表1中的数据可见,原粉样品比表面最高、孔容最大,分别为 399 m2·g-1和 0.44 cm3·g-1。经不同温度焙烧后,随着焙烧温度的提高,样品的比表面积和孔容迅速下降,且其孔径分布变宽,这可能是由于焙烧过程中锐钛矿型晶体结构的形成引起的结构变化导致的;当焙烧温度为550℃时,样品的比表面积和孔容分别降至 42 m2·g-1和 0.15 cm3·g-1。

表1 不同焙烧温度下m-TiO2样品的物性参数Table 1 Physical parameters of m-TiO2 samples calcined at different temperatures

图2 经不同温度焙烧后m-TiO2样品的XRD图Fig.2 XRD patterns of m-TiO2 samples calcined at different temperatures
2.2 合成条件对m-TiO2的光催化产氢活性的影响
2.2.1 合成温度的影响
在水量(nH2O/nTiO2)为 100,模板剂用量(nCTAB/nTiO2)为0.2,焙烧温度为450℃的条件下,考察了合成温度对样品在紫外光下的光催化产氢活性的影响,其结果示于图3中。由图可见,当合成温度为20℃时,样品的产氢速率为 156 mmol·g-1·h-1,随着合成温度的升高,样品的光催化活性明显提高;当合成温度为30℃时,样品的光催化产氢速率最高,达170 mmol·g-1·h-1,此时样品的紫外光能量转化效率为5.2%。合成温度继续升高,样品的光催化产氢活性逐渐降低,其原因可能是随着温度的升高,模板剂在乙醇水溶液的合成体系中,难以以一种稳定的胶束形态存在,不利于高表面材料的合成。

图3 不同温度合成的m-TiO2样品的光催化产氢速率Fig.3 Hydrogen production rate of m-TiO2 samples synthesized at different temperatures
2.2.2 模板剂用量(nCTAB/nTiO2)的影响
在水量(nH2O/nTiO2)为 100,焙烧温度为 450 ℃的条件下,考察了模板剂用量(nCTAB/nTiO2)对合成样品的光催化产氢活性的影响,结果示于图4中。由图可见,在同一合成温度条件下,随着模板剂用量的增加,m-TiO2样品的光催化活性呈现出先增大后减小的变化规律。当合成温度为30℃,模板剂用量(nCTAB/nTiO2)为0.2时,样品的光催化活性最高,达170 mmol·g-1·h-1;增加模板剂用量(nCTAB/nTiO2),m-TiO2样品光催化活性大幅下降。其原因可能是CTAB作为模板剂溶解在乙醇水溶液中形成胶束,它和钛源之间会通过静电力相互作用组装成高比表面的介孔二氧化钛。但模板剂用量的增多,会导致其胶束浓度过高,破坏了有机-无机组分之间的电荷匹配等平衡。此外,过量的模板剂在450℃下焙烧也可能存在少量残留的问题。当合成温度为50℃时,模板剂用量(nCTAB/nTiO2)对m-TiO2样品光催化产氢活性的影响与合成温度为30℃时有相同的规律,当模板剂用量(nCTAB/nTiO2)为 0.2 时,样品光催化产氢速率最高(143 mmol·g-1·h-1)。

图4 不同模板剂用量(n/n)合成的m-TiO2样品的光催化产氢速率Fig.4 Hydrogen production rate of m-TiO2 samples synthesized with different n/nratios
2.2.3 水量的影响

图5 不同水量合成的m-TiO2样品的光催化产氢速率Fig.5 Hydrogen production rate of m-TiO2 samples synthesized with different n/nratios
2.2.4 焙烧温度的影响
在合成温度为 30 ℃,水量(nH2O/nTiO2)为 100,模板剂用量(nCTAB/nTiO2)为0.2的条件下,考察了焙烧温度对合成样品的光催化产氢活性的影响,其结果示于图6中。从图中可以看出,样品的光催化活性随着焙烧温度的升高呈现出先升高后降低的趋势。当焙烧温度在250℃时,样品产氢速率仅为36 mmol·g-1·h-1,随着焙烧温度的升高,样品的光催化产氢逐渐增加;当焙烧温度为450℃时,样品的光催化活性最高,达 170 mmol·g-1·h-1。 继续提高焙烧温度,样品的光催化产氢活性大幅降低,当焙烧温度为650℃时,其催化活性已降至31 mmol·g-1·h-1。 通过不同温度焙烧后m-TiO2样品的XRD图和比表面积(图2和表1)可以看出,晶体结构和比表面积对m-TiO2样品光催化产氢活性均有一定的影响,在350℃焙烧后,虽然样品的比表面积较大(213 m2·g-1),但其结构中锐钛矿相TiO2的相对结晶度较低,仅为40%;提高焙烧温度至550℃,虽然锐钛矿相的结晶度最高,但此时比表面积损失较严重(42 m2·g-1);而经 450 ℃焙烧的样品,其比表面积和相对结晶度分别为80 m2·g-1和65%,对催化产氢性能最为有利。

图6 不同温度焙烧的m-TiO2样品的光催化产氢速率Fig.6 Hydrogen production rate of m-TiO2 samples calcined at different temperatures
2.3 反应条件对m-TiO2光催化产氢速率的影响

图7 催化剂用量对m-TiO2光催化产氢速率的影响Fig.7 Hydrogen production rate over different amounts of m-TiO2 samples
以500 W高压汞灯为光源,在合成温度为30℃,水量(nH2O/nTiO2)为 100,模板剂用量(nCTAB/nTiO2)为0.2,焙烧温度为450℃的条件下合成的m-TiO2样品为催化剂,甲醇浓度为20%(V/V)的条件下,考察了催化剂用量对样品光催化产氢速率的影响,结果如图7所示。由图可见,反应开始的最初1 h内,m-TiO2样品的产氢速率较低,这是由于反应开始1 h内样品处于反应的诱导期;反应时间达2 h后,样品产氢速率趋于稳定且在5 h内催化剂没有失活的现象。不同催化剂用量下,样品的产氢速率差别较大,当催化剂用量为0.2 g·L-1时,单位体积反应溶液中催化剂量较少,能参与反应的活性位点也较少,反应时间为 2 h 时,其产氢速率仅为 112 mmol·g-1·h-1;当催化剂用量增加至0.4 g·L-1时,样品反应2 h后的产氢速率明显提高,达 170 mmol·g-1·h-1;继续增加催化剂用量,m-TiO2样品催化产氢速率大幅下降,这主要是由于光催化产氢反应仪是采用单边照射的方式,当反应体系中催化剂用量较大时,悬浮体系的二氧化钛粒子阻碍了光的透射性,体系的透光率变差,使得大部分二氧化钛粒子没有参与到催化反应中,导致样品光催化反应速率急剧降低。图8给出了当催化剂用量为0.4 g·L-1时,甲醇浓度对m-TiO2光催化产氢速率的影响。由图可见,随着甲醇浓度的增大,样品在紫外光下的产氢速率呈先增加后趋于稳定的变化规律。当甲醇浓度为5%(V/V)时,m-TiO2样品的光催化产氢速率为98 mmol·g-1·h-1; 继续增加甲醇浓度至20%(V/V)时,样品产氢速率提高至170 mmol·g-1·h-1;此后继续提高甲醇浓度,样品的产氢速率变化不大。这是由于甲醇极性远小于水,随着甲醇浓度的增加,催化剂的表面张力降低;此外反应体系极性的减小,有利于催化剂更好的分散于反应体系中,更充分的接受光照,以获得更高的产氢效率。

图8 甲醇的浓度对光催化产氢活性的影响Fig.8 Effect of methanol concentration on hydrogen production rate
2.4 水热法合成r GO/m-TiO2及其光催化制氢性能研究
石墨烯(Graphene)是一种二维碳原子晶体,以其优良的化学稳定性和导电性能成为研究热点[29]。石墨烯中电子传输速度可以达到光速的1/300,远远超过了电子在其他导体中的传输速度,其室温下的电子迁移速率可达 15 000 cm2·V-1·s-1[30]。 由于石墨烯独特的结构,使其应用非常广泛,已成为比较优良的载体材料,石墨烯与半导体光催化材料复合后,可以大大提高半导体材料的光催化性能[31]。以GO和m-TiO2为原料,在水热条件下制备了还原氧化石墨烯/介孔 TiO2复合材料(rGO/m-TiO2),并考察了其在紫外光和可见光下的光催化产氢活性。
图9和图10分别给出了氧化石墨烯在水热处理前后及不同rGO复合量的rGO/m-TiO2样品的XRD 图。 由图可见,氧化石墨烯(图 9(a)在 2θ=13°附近有明显的特征衍射峰,同时在2θ=43.12°附近出现1个强度较小的衍射峰,这可能是其制备原料中的的杂质引起的。 经 150 ℃水热还原后(图 9(b),氧化石墨烯的特征衍射峰消失,而在2θ=24.8°出现了1个较宽的衍射峰,可以归属为还原氧化石墨烯的特征衍射峰,说明GO在水热过程中被还原成了rGO。由图10可见,rGO/m-TiO2样品的结构均为锐钛矿相,其衍射峰的位置没有明显的变化,也没有出现rGO的特征衍射峰,但rGO/m-TiO2样品位于2θ=25.2°处的(101)晶面对应的衍射峰的强度与m-TiO2相比均有不同程度的减弱,说明复合后样品的结晶度略有下降。

图 9 GO 在水热处理前 (a)后 (b)的 XRD 图Fig.9 XRD patterns of GO sample before (a)and after(b)hydrothermal treatment
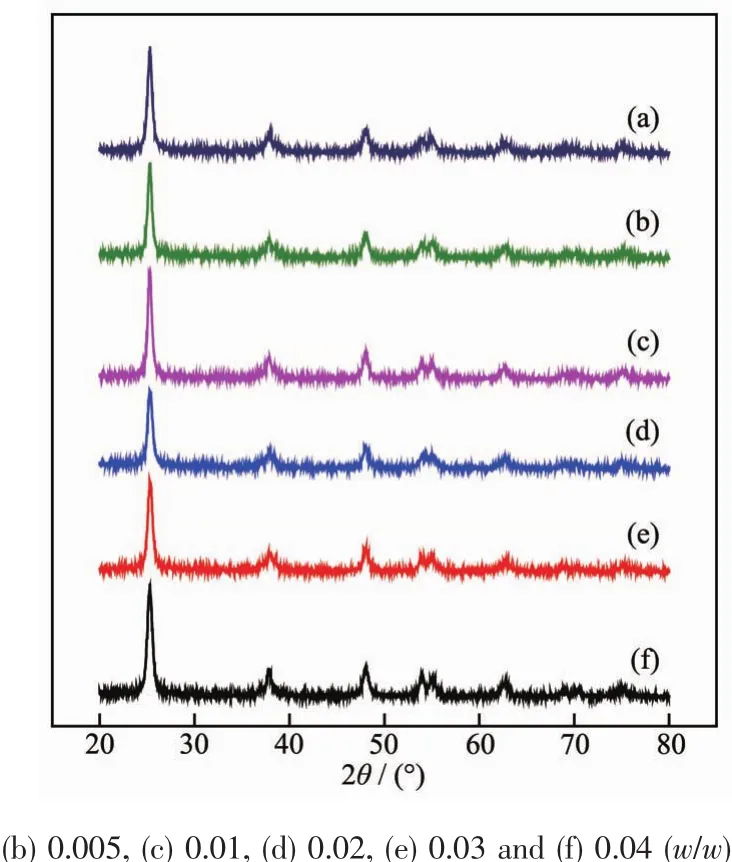
图 10 m-TiO2 (a)和 rGO/m-TiO2 样品 (b~f)的 XRD 图Fig.10 XRD patterns of m-TiO2 (a)and rGO/m-TiO2 samples (b~f)synthesized with different w GO/w ratios

图11 不同rGO复合量的rGO/m-TiO2样品在紫外光 (A)和可见光 (B)下的产氢活性Fig.11 Hydrogen production rate of rGO/m-TiO2 samples synthesized with different w GO/wratios under UV (A)and visible (B)light irradiation
图11 给出了rGO/m-TiO2样品在紫外光(A)和可见光(B)下的光催化产氢活性(甲醇浓度为20%(V/V),催化剂用量为 0.4 g·L-1)。 由图 11(A)可见,在紫外光条件下,rGO/m-TiO2样品的光催化产氢活性与未复合样品相比均有大幅度提高,当rGO的复合量为 0.01时, 样品的产氢活性高达 241 mmol·g-1·h-1,能量转化效率达7.4%,较m-TiO2样品提高了42.3%。由图11(B)可见,在可见光条件下,当rGO的复合量为0.01时,rGO/m-TiO2样品的产氢活性最高,达 9 mmol·g-1·h-1。 由复合前后样品的紫外可见光谱图(图12)可以看出,在紫外光区,与 m-TiO2样品相比,rGO/m-TiO2样品的吸收有明显增加;在可见光区,m-TiO2样品几乎没有吸收,而rGO/m-TiO2样品的吸收则大幅增强,说明复合样品在紫外光区和可见光区的光子吸收率都有明显提高[32-33]。由此可见,rGO/m-TiO2样品产氢活性的提高,一方面是由于样品中的石墨烯作为光生电子的快速运输通道,使被光激发生成的光生电子快速扩散至样品表面,有效抑制了光生电子和空穴对的复合[33];另一方面是因为复合石墨烯后样品对光的吸收波长向可见光区移动,在可见光下的吸收能力增强,从而提高了光催化产氢活性。当rGO复合量高于0.01后,rGO/m-TiO2样品在紫外光区和可见光区的光催化产氢活性均呈下降趋势,这是由于rGO复合量增大时,样品的颜色逐渐加深,影响了光的吸收,只有部分样品表面能被光照射到,光激发生成的光生电子数量大幅降低;此外,rGO复合量的增加也使催化剂的分散性变差,在反应液中不能完全分散,催化剂表面积减少,产氢活性位点减少,导致光催化产氢活性的降低。

图 12 m-TiO2 (a)和 rGO/m-TiO2样品 (b)的 UV-Vis 谱图Fig.12 UV-Vis adsorption spectra of m-TiO2 (a)and rGO/m-TiO2 sample (b)
3 结 论
(1)采用溶胶凝胶法,以TTIP为钛源,CTAB为模板剂合成了介孔二氧化钛m-TiO2。结果表明,在350℃下焙烧后,样品由无定形结构转变为锐钛矿相,随着焙烧温度的提高,锐钛矿相结构产物的结晶度提高,当焙烧温度超过550℃后,样品大部分转变为金红石相。
(2)合成条件研究结果表明,当合成温度为30℃,水量(nH2O/nTiO2)为 100,模板剂用量(nCTAB/n)为0.2时,经450℃焙烧的m-TiO2样品在紫外光条件下光催化产氢活性最高。当催化剂用量为0.4 g·L-1,反应体系中甲醇浓度达20%以上时,反应2 h后m-TiO2样品的光催化产氢活性达 170 mmol·g-1·h-1,此后产氢速率逐渐趋于稳定。
(3)采用水热法合成的rGO/m-TiO2样品,其晶相结构为锐钛矿相。当rGO复合量为0.01时,样品在紫外光下的产氢活性为 241 mmol·g-1·h-1,能量转化效率达7.4%,较m-TiO2样品提高了42.3%;在可见光条件下,其产氢活性达 9 mmol·g-1·h-1。
