静脉留置针中MDl溶出测定及安全性评价
2018-12-10王景春严志宏王昊
王景春 严志宏 王昊
1 江西丰临医用器械有限公司 (江西 抚州 344100)
2 江西中医药大学,大型精密仪器共享服务中心 (江西 南昌 330004)
3 江西丰临医疗科技股份有限公司 (江西 宜春 331100)
内容提要: 建立了液质联用法测定静脉留置针中聚氨酯材质组件浸提液中二苯甲烷二异氰酸酯(MDI)含量的方法。该方法采用极限浸提法,以无水甲醇为浸提介质和衍生剂,将MDI完全衍生为二苯甲烷二氨基甲酸甲酯(MDC),通过检测MDC的量反推MDI的量。结果显示该方法在0.0177~1.772ng/mL范围内线性关系良好,R=0.9982,回收率为103%~114.7%,RSD为4.2%,表明该方法准确度较高,重复性好。最后,通过推导建立了MDI的允许限量,对留置针进行安全评估,结果发现留置针中溶出的MDI量在允许限量范围内。
静脉留置针作为一种静脉输液工具,在临床上被广泛大量使用。目前市场上一次性使用静脉留置针的延长管路使用的主要材料为聚氯乙烯(PVC),但已有研究表明,PVC输液器对某些药物会产生吸附作用,同时PVC材料中的增塑剂邻苯二甲酸二辛酯(DEHP)会被一些脂溶性或醇溶性药物溶出,这种相互作用大大制约了带有PVC材质管路留置针的应用范围,同时也造成了给药风险[1,2]。此外,留置针的导管材料也经历了从普通塑料到TEFLON再到聚氨酯的变革。聚氨酯材料的应用能在最大程度上满足临床应用,经过循证证实,其相对Teflon材质能减少并发症,增加留置时间,减少不必要的额外费用支出[3]。
MDI是聚氨酯合成中的一种重要原料,对眼睛和呼吸道黏膜有强烈的刺激作用,可引起鼻塞、呕吐、咳嗽、呼吸短促、发热、皮疹等症状[4]。鉴于MDI的毒性,考虑到使用留置针输液治疗过程中可能存在MDI随着药液进入人体,有必要对源至留置针中的MDI进行测试及安全评价。MDI检测方法通常采用衍生化来进行测试MDI的量,衍生用的溶剂有很多种,如无水甲醇、l-(2-甲氧苯基)哌嗪、二正丁胺、9-甲氨甲基蒽等[5-8]。本实验采用无水甲醇对MDI进行衍生化,采用液质联用来测试MDI的含量。
1.MDl溶出量测定
1.1 仪器与试剂
AB Sciex TRIPLE QUAD 5500质谱(美国,AB Sciex公司);岛津LC-30A液相(日本,岛津公司);Spectrum two红外仪(美国,Perkin Elmer公司);HH-6数显恒温水浴锅(中国,上海梅香仪器有限公司);无水甲醇(中国,西陇科学,分析纯);MDI标准品(阿拉丁,纯度98%);一次性使用防针刺留置针(江西丰临医用器械有限公司,批号:20131219)。
1.2 样品制备
1.2.1 标准品的衍生化
取1.8mg的MDI标准品加入到10mL无水甲醇中,于60˚C水浴加热45min。蒸出多余的甲醇后,用无水甲醇补足损失的重量,得到MDC的标准溶液。通过计算得到标准液浓度为226.08μg/mL,采用0.22μm微孔滤膜过滤,待用。
1.2.2 样品的衍生化
称量剪碎的留置针上的聚氨酯(含延长管和导管)1g,加入10mL无水甲醇中,于37˚C下浸泡72h。后于60˚C水浴加热45min。蒸出多余的甲醇后,用无水甲醇补足损失的重量,得到样品的衍生化溶液,采用0.22μm微孔滤膜过滤,待用。
1.2.3 空白制备
取10mL无水甲醇,按照上述方法进行处理,得到空白样品。
1.2.4 加标样品制备
称取已知含量的样品1g,加入10mL无水甲醇中,于37˚C下浸泡72h。再加入衍生化得到的标准品溶液,于60˚C水浴加热45min。蒸出多余的甲醇后,用无水甲醇补足损失的重量,得到加标样品的衍生化溶液,采用0.22μm微孔滤膜过滤,待用。
1.3 分析方法
1.3.1 质谱条件
电离模式(离子源):ESI源;扫描方式:正离子扫描;检测方式:多反应检测(MRM);离子源电压(IS):5500V;离子源温度(TEM):600˚C;气帘气(CUR):35psi;雾化气(GS1):50psi;辅助加热气(GS2):50psi。定量离子对:

母离子 子离子 去簇电势(DP) 碰撞能量(CE)315.1 164.0 160V 17eV 315.1 282.9 160V 13eV
1.3.2 色谱条件
流动相:乙腈-水;柱温:40˚C;色谱柱:Agilent Poroshell 120 Ec-C18,2.7μm,4.6×100mm;流速:0.5mL/min;进样量:5μL;流动相比例:0~5min,乙腈比例60%;5~6min,乙腈比例100%;6~8min,乙腈比例60%。
1.3.3 测试图谱
MDI衍生化后生成的MDC的质谱全扫图如图1~3所示,其中315.1、332.1和337.1分别是MDC的[M+H]+、[M+NH4]+、[M+Na]+分子离子峰,表明已成功衍生化。
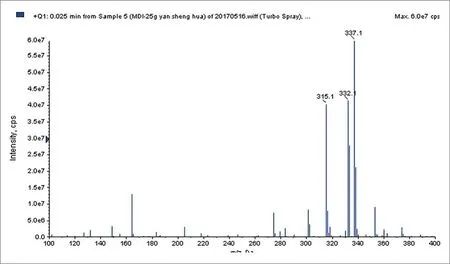
图1.MDC的质谱全扫图
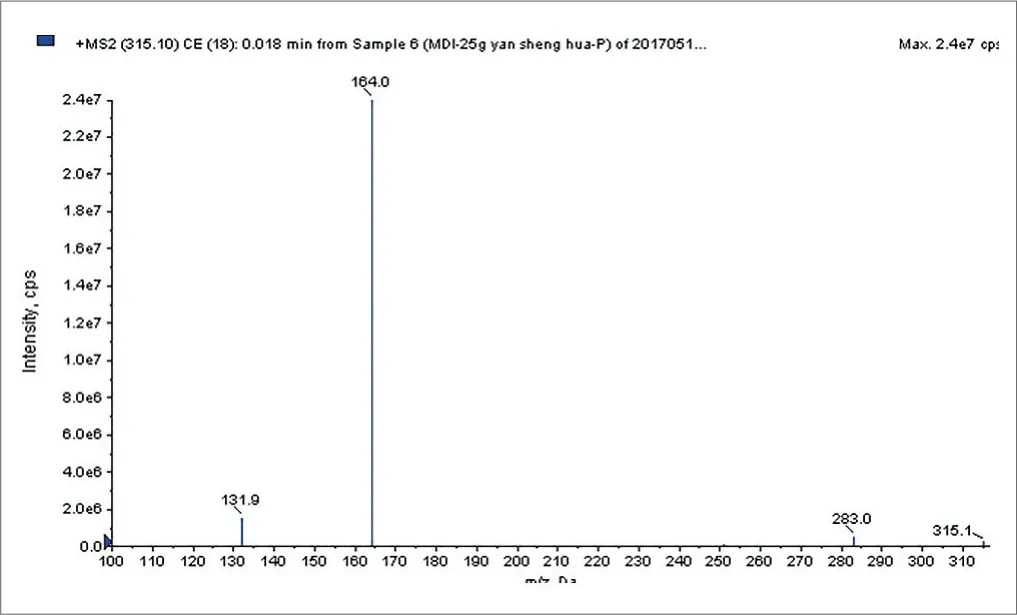
图2.MDC二级碎片图
图3.空白总离子流图
1.3.4 检测限、定量限
在上述色谱条件下,取MDC标准溶液逐级稀释,进样测定,以4.5倍信噪比测得MDC的检测限为0.00885ng/mL,以9.7倍信噪比测得MDC的定量限为0.0177ng/mL。
1.3.5 标准曲线
取1.3.1制备的标准品溶液,用无水甲醇进行稀释,分别得到浓度为0.0177ng/mL、0.02215ng/mL、0.0443ng/mL、0.0886ng/mL、0.1772ng/mL、0.886ng/mL、1.772ng/mL的标准品,按液质条件进样,以峰面积为纵坐标,浓度为横坐标,得到标曲Y=4.42×106x+8.65×104(r=0.9982,1/x2),证明在0.0177~1.772ng/mL范围内,MDC具有良好的线性关系。
1.3.6 精密度
取同一浓度的样品测定6次的结果进行精密度评价,测定结果相对标准偏差为4.2%。
1.3.7 回收率
取已知溶度样品,加入一定量的MDI标准品,进行加标回收试验。结果表明,平均回收率为103%~114.7%。

图4.MDI红外图谱及衍生物MDC红外图谱
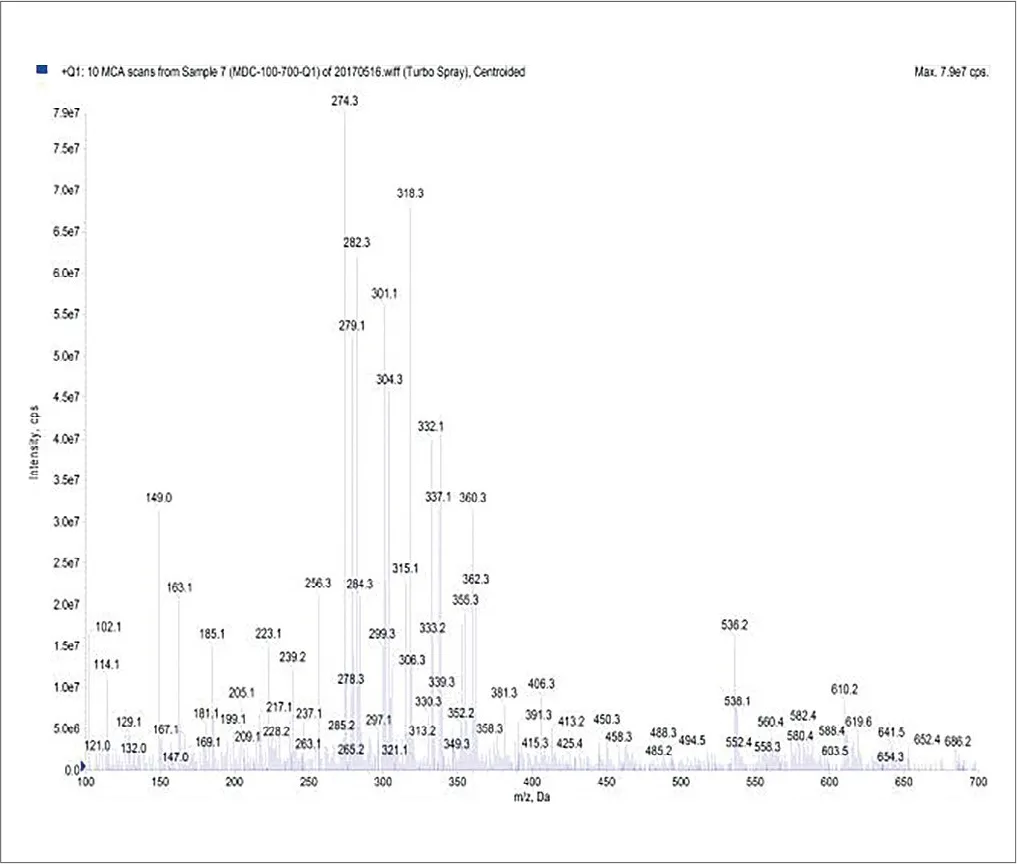
图5.反应产物的质谱全扫描
1.4 衍生物鉴定
取衍生得到的标准液,加入大量超纯水,有白色针状结晶出现,抽滤得到白色物,50˚C真空干燥过夜。取产物进行红外表征,结果MDI的特征峰2270cm-1(NCO吸收峰)完全消失,MDC的1706cm-1(C=O吸收峰)和1231cm-1(C-O吸收峰)出现(见图4)。对衍生标准液进行质谱全扫描,也未发现MDI和水结合的产物(分子离子为475/492和497),证明MDI完全衍生为了MDC(见图5)。
1.5 测试结果
根据样品留置针中所测MDC的最大含量为0.0909ng/mL,得到留置针中MDC含量为0.909ng/g,再由相同摩尔数推算出MDI含量为1.142ng/g。由于单支留置针所用聚氨酯材料总重量约为0.35g左右,从而可知,单支留置针析出的MDI总量最大不超过0.3997ng。
2.MDl允许限量推导(AL)
根据MDI欧盟风险评价报告[9]中毒理数据综述,无充分的MDI静脉注射毒性数据,暂无MDI的注射途径的无可见不良反应水平(NOAEL)或最低可见不良反应水平(LOAEL)研究数据。MDI的毒性主要是吸入毒性,报告中认同大鼠试验MDI的吸入重复剂量毒性是最大的,其NOAEL为0.0576mg/kgbw/day(经吸入途径NOAEL0.2mg/m3换算而来)。另外,根据报告可知,没有充分的人体数据能够表明MDI存在致癌性。MDI允许限量依据《GB/T 16886.17-2005医疗器械生物学评价 第17部分:可沥滤物允许限量的建立》进行推导。
2.1 可耐受摄入量(TI)
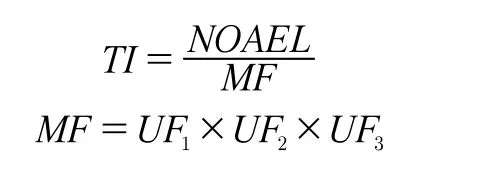
UF1——表示人体间的个体差异,根据动物对毒性试剂的安全评估,选用缺省值10;
UF2——表示从替代物种数据的推导而不是人类数据,参考FDA推导DEHP时的值3;
UF3——表示实验数据的定性和相关性,本试验有缺乏支持性研究、终点评估中不适当动物模型的使用以及不适当的接触途径等不确定因子,因此设定为100;

2.2 MDI可耐受限量(TE)

m——医疗器械接触群体的体质量,成人默认值为70kg,婴幼儿默认为3.5kg;
CEF——多器械接触因子,取缺省值0.2;
PET——比例接触因子,取缺省值1。
成人TE值为:
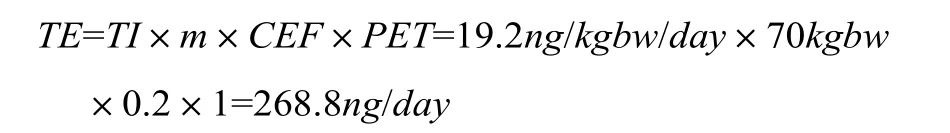
婴幼儿TE值为:

2.3 MDI允许限量的确立
允许限量即可沥滤物通过医疗器械接触进入人体时,认为每天可接受的最大量,即判断MDI的每天能接受的最大量。
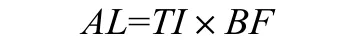
BF——为受益因子,因留置针中MDI的溶出量在技术和经济上都是可行的,因此不进行受益评价,受益因子设为1。
成人每天能接受MDI的最大量为:
AL=TE×BF=268.8ng/day×1=268.8ng/day
婴幼儿每天能接受MDI的最大量为:
AL=TE×BF=13.44ng/day×1=13.44ng/day
鉴于本次研究留置针预期使用时间不超过72h,为长期使用器械,使用人群包含婴幼儿,因此,选用婴幼儿的AL值推导器械使用期间允许MDI的总析出量,根据公式可推导出单支器械最大允许MDI的析出量m。
m=AL×3=13.44ng/day×3day=40.32ng
3.结论
本研究采用液质联用法建立了留置针中聚氨酯浸提液中MDI检测方法,为残留MDI检测提供了可靠、有效的方法。样品经测试其最大溶出量为0.3997ng,远远小于单支留置针的MDI允许限量40.32ng。
