我国医疗器械技术审评机构考核和评估指标体系研究
2018-12-10李非梁文石莉丁军张华
李非 梁文 石莉 丁军 张华
1 辽宁省药械审评与监测中心 (辽宁 沈阳 110003)
2 天津市医疗器械技术审评中心 (天津 300000)
3 国家药品监督管理局 (北京 100053)
内容提要: 目的:研究我国医疗器械技术审评机构考核和评估指标体系。方法:对美国FDA、欧盟和IMDRF地区和组织的医疗器械审评机构考核评估要求进行文献研究。基于评价学理论,构建医疗器械审评机构考核评估指标集。采用同行评议法,对39份专家和机构问卷调研结果进行统计分析,对指标集进行筛选和确定。结果与结论:本研究首次以欧盟、FDA、IMDRF等先进管理经验为参考,以我国技术审评机构建设要求为基础,制订了我国医疗器械技术审评机构考核评估指标体系,包括一级指标10个、二级指标29个、三级指标76个。同时,建议开展实证研究和设立指标动态调整机制,进一步完善医疗器械技术审评能力机构考核和评估指标体系。
2017年,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确了进一步深化改革的思路。改革的目的之一就是管理系统与产业结构、产业竞争力和公众临床需要更好地适应[1]。在提升技术支撑能力方面,明确提出“建立审评为主导、检查检验为支撑的技术审评体系,统一第二类医疗器械审评标准,逐步实现国家统一审评”。为推动落实该改革要求,促进省级医疗器械技术审评能力切实得到提高,迫切需要构建对审评机构的考核评估体系。
目前,我国尚未有相关研究对医疗器械技术审评机构建设和能力水平进行评价。本研究旨在以我国医疗器械技术审评机构为研究对象,构建省级医疗器械技术审评机构考核和评估指标体系,以促进我国医疗器械注册技术审评机构的建设。
1.对象与方法
1.1 研究对象
本研究的目标是构建省级医疗器械技术审评能力考核和评估指标体系,因此研究对象主要为31个省市医疗器械技术审评机构。
1.2 研究方法
专家和机构同行评议。
本研究采用文献分析法和同行评议法。
根据评估学理论、文献研究结合审评机构工作经验,起草《省级医疗器械技术审评能力考核和评估指标体系专家讨论表》,确定我国“省级医疗器械技术审评能力考核和评估指标体系”的维度和指标;然后设计了《省级医疗器械技术审评能力考核和评估指标体系咨询问卷》开展专家和机构调查。调查分两个部分,第一部分是对全国已组建的医疗器械注册审评机构进行问卷调查,第二部分是对国家食品药品监督管理总局和省市局疗器械注册管理专家进行问卷调查。
2.指标集构建
2.1 理论基础
根据《评价学》,评价是将研究对象作为一个系统进行分析,对结果加以综合、评估,这样反复直到能有效实现预定目标为止。评价指标体系是反映评价对象的一系列完整、相关之间有关联的评价指标。其主要作用有3个方面[2]:①指标体系是评价对象活动的标准和尺度;②指标体系可以反映评价对象的系统性信息;③指标体系是指导评价对象发展的指挥棒。
一般而言,评价指标体系的构建过程主要有构建一般指标体系、指标体系初选、专家调查、评价体系完善等阶段。本研究采用的指标体系构建过程主要分为三个过程:一般指标集K1、指标集筛选K2和指标集确定K3,如图1。
图1.指标体系构建过程
2.2 指标集构建依据
本研究中指标集的构建主要依据4个方面:
2.2.1 我国要求
国家食品药品监督管理总局在2013年10月发布了《关于加强医疗器械技术审评能力建设的指导意见》,其中规定医疗器械技术审评能力应重点考虑以下方面:技术审评的相关职责、医疗器械技术审评队伍、与其审评工作任务和人员数量相适应的办公用房和办公设施、医疗器械技术审评制度、信息化建设、人才选用、考评激励和培训[3]。
2.2.2 美国食品药品管理局(FDA)要求
FDA《用以指导工作人员,企业和第三方的基于FDA1997年现代法案下实施第三方项目的最终导则》对第三方的要求主要有:①资料严谨性要求:保证上报信息能够准确反应被审查的数据;②保密性要求:将所收到的信息、记录、报告和建议视为专利信息对待;③投诉处理要求:及时反应并解决从事被授权活动时遇到的投诉;④公开合格审查员要求:每年向公众公开遵守利益冲突原则的被授权方、办公人员和雇员[4]。
2.2.3 欧盟要求
欧盟《关于医疗器械的欧盟指令的框架内对公告机构的委任和监督》中对公告机构(相当于我国的审评机构)要求主要有9个方面:一般性要求、独立性要求、公正性要求、能力要求、内部程序和设施要求、保密要求、责任保险要求、分包要求和质量体系要求[5]。
2.2.4 国际医疗器械监管者论坛(IMDRF)要求
IMDRF《对接受监管机构认可的医疗器械检查机构的要求》中对医疗器械检查机构要求主要有6个方面:一般要求、结构要求、资源要求、信息要求、过程要求和管理体系的要求[6-9]。
2.3 一般指标集构建
本研究采用层次分析法构建一般指标体系。层次分析法的构建方法见图2[10]。

图2.层次分析法构建指标集
在一般指标体系构建过程中,主要考虑2个方面:①国外成熟的考核评估指标,如IMDRF对医疗器械检查机构的要求和评级。②总局在发布的《关于加强医疗器械技术审评能力建设的指导意见》中提出的具体原则。
因此,从通用要求、组织机构要求、资源要求、信息要求、过程要求、质量管理体系要求6个维度出发,初步整理出一般评价指标集K1。其中通用要求包括法律地位、职责和权利2个二级指标;组织机构要求包括组织机构、领导层、行为守则、岗位人员、独立性、持续改进6个二级指标;资源要求是重点考核评估内容,直接影响医疗器械注册审评能力,按内容分为人员能力、专业、分工、职责、数量、考核机制、培训、现场实践、人员激励、外部专家、硬件资源11个二级指标;信息要求包括信息公开、信息保密、信息辅助决策、信息交换、办公能力5个二级指标;过程要求包括审查活动、决定、时限、质量、相对人事务、相对人档案6个二级指标;管理质量体系要求包括符合ISO9001系列标准、管理评审、内审3个二级指标。综上,形成了包括6个一级指标、33个二级指标和58个三级指标的指标体系。
2.4 指标集初选
在一般指标集K1构建后,结合国内31个医疗器械审评机构的实际情况进行了调整,形成了一套包括3章、一级指标10个、二级指标38个、三级指标84个的初始指标集K2,详见表1。
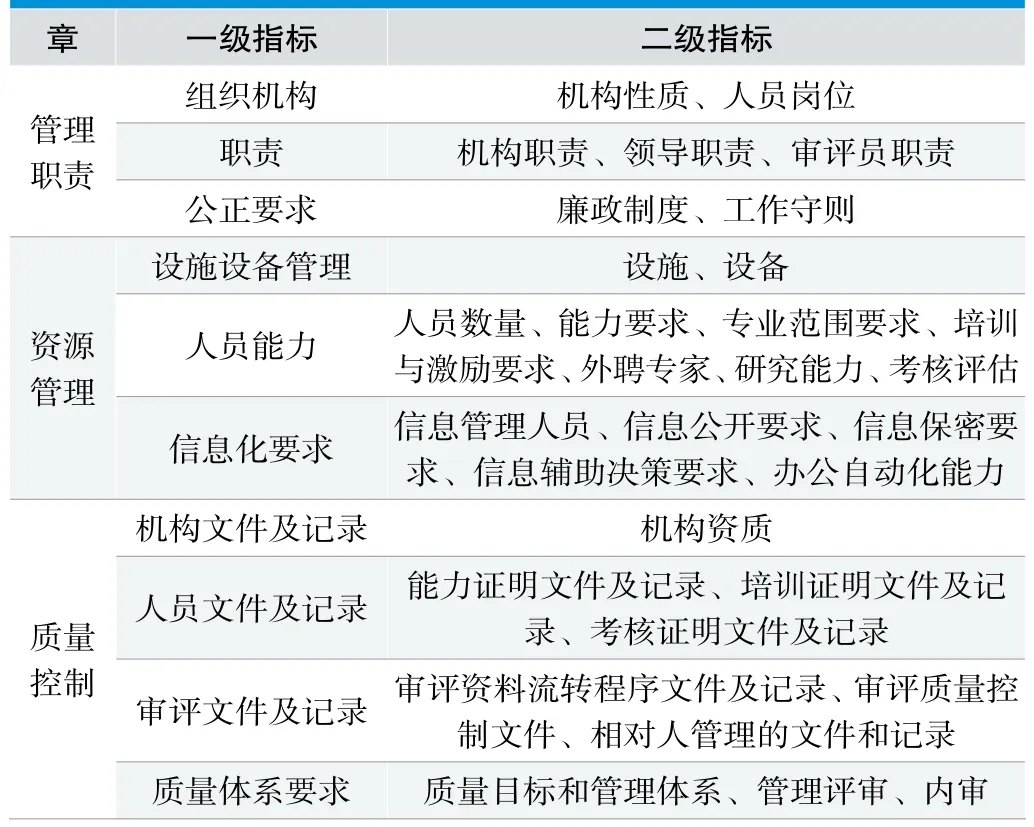
表1.初始指标集K2
3.专家和同行评议
3.1 方案及问卷设计
分别以同行审评机构和专家为对象,编制了问卷。问卷调查内容主要有两个方面:是否同意、是否有建议。
本次研究在2014年12月对专家和省级审评机构行了调查,发放电子版专家问卷10份,纸版审评机构问卷29份,共计发放问卷39份,回收问卷31份,回收率为80%,有效问卷30份,有效率为96.77%,其中湖南省审评机构A1.2.4-A3.2.3、B2.1.2-B2.4.3指标未填写,按缺失值处理,其余指标正常进行分析。
专家和机构的同行评议调查结果反映了两部分信息。第一部分是每个指标的统计结果;第二部分是对指标集K2的总体意见和逐条具体意见。
3.2 统计分析及结果
对调查结果的统计分析包括每条指标的同意人数、同意人数构成比、建议人数、建议人数构成比,部分结果见表2。
经过对调查表中的84个三级指标进行分析发现,各指标同意人数为26~31人,同意人数构成比为86.7%~100%。其中同意人数最少的一项为1.2.4(管理机构-组织机构-人员岗位设置-审评质量控制岗),同意人数为26人,同意人数构成比为86.7%。

表2.调查数据(部分)
对指标提出建议人数范围为0~6,建议人数构成比范围为0~19.4%,其中提出最多建议的一条为B1.1.(资源管理-设施设备管理-设施),建议人数为6人,建议人数构成比为19.4%。见图3。
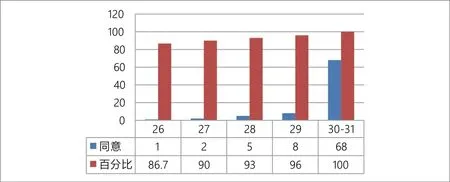
图3.调查总体结果
从总体统计结果看,83/84的指标设计得到了90%及以上调查对象的同意,说明指标集设计总体是客观可行的。另外,研究也对问卷进行了分组分析。第一种分组将问卷分为审评机构和专家,统计结果如下,见表3。
从统计结果看,专家对指标集的同意百分率较低,建议较多。
第二种分组将问卷分为西北地区和普通地区,统计结果如下,见表4。
从统计结果看,西北地区对指标集的同意百分率与普通地区无明显差异,建议较少。
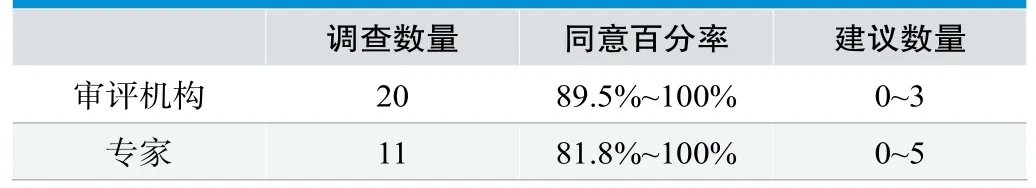
表3.专家和机构分组结果
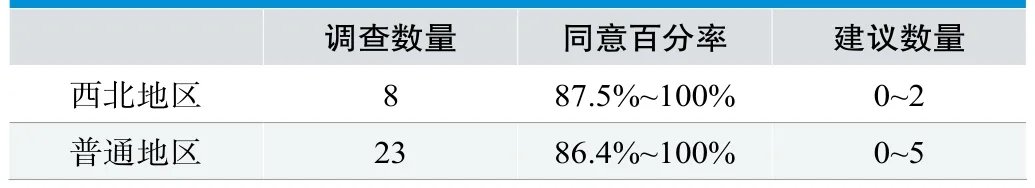
表4.西北和普通地区分组结果
3.3 总体意见分析
根据总体意见的分析,可以得出以下结论:①13条意见认为指标体系设置合理,较为符合我国实际情况和医疗器械审评机构的发展需求。②5条意见认为部分指标如质量控制、信息化等内容要求较高,建议划分为加分项。③4条意见认为指标体系对新建机构或者欠发达地区较为严格,建议划分区域进行设置。④4条意见认为指标应有侧重,并给予不同的权重。⑤3条意见认为可增设指标如技术审评职称数等。⑥2条意见认为应结合目前各省市具体情况修改该意见,不要以局部或特殊情况为依据强行修改岗位或增加考核要求;按照目前的审评现状,设置专职的审评质量控制人员不如设置双人复核比较可行。
3.4 评价指标集的确定
综合同行评议的统计分析结果和总体意见分析,构建省级医疗器械技术审评机构考核评估指标集K3。K3共分为3章。设置一级指标10个、二级指标29个、三级指标76个,详见表5。
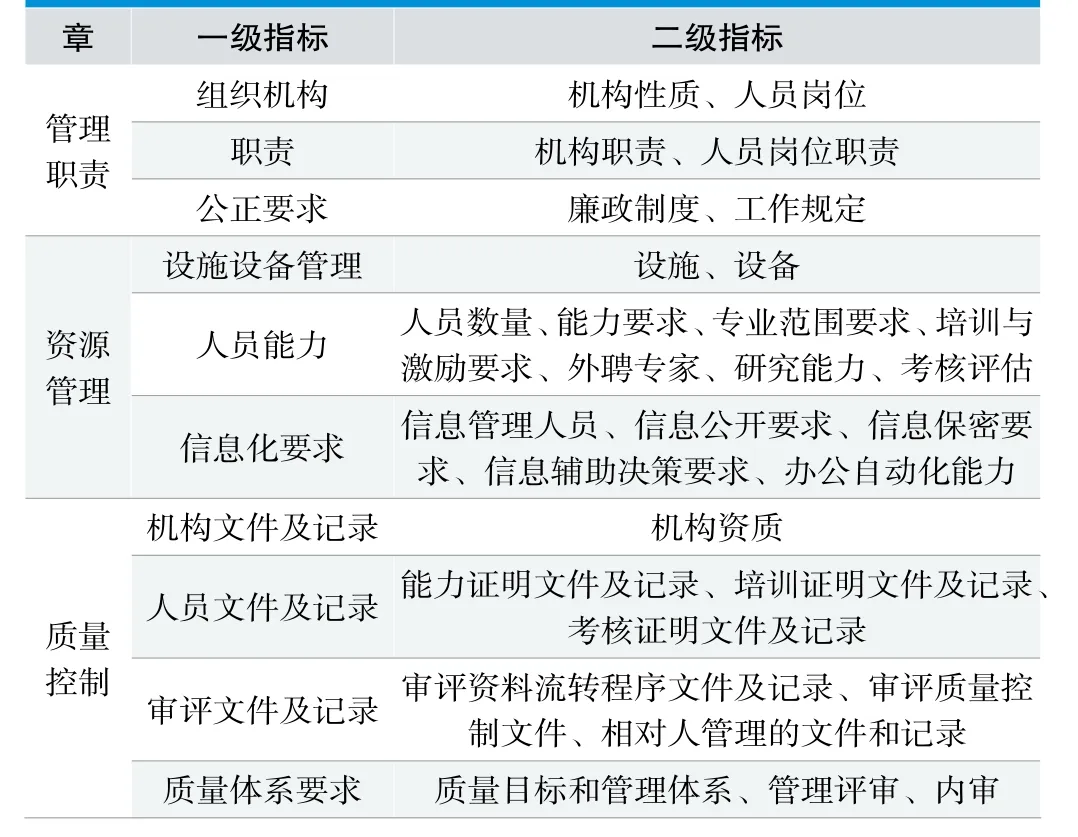
表5.完善指标集K3
4.结论与建议
4.1 结论
因我国省级医疗器械审评机构建设起步较晚,与发达国家和组织的要求有两点显著不足[11]。第一,我国医疗器械审评人员能力尚待提高,主要体现在人员数量、培训教育、专业配置、考核激励、信息化支持等方面;第二,我国医疗器械审评机构的质量控制尚需加强,主要体现在文件记录、管理质量体系等方面。本研究通过查阅国内外医疗器械注册审评机构研究和文献资料,结合专家访谈,提出了评价初始指标集,并经过权威专家和全范围机构咨询,最终构建了我国省级医疗器械审评能力考核评估指标体系。
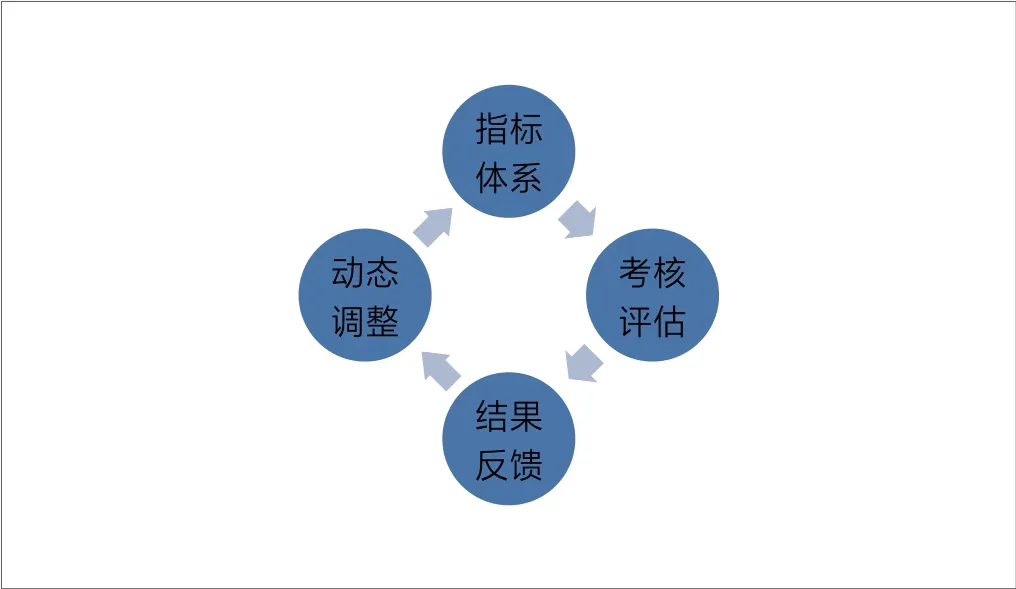
图4.指标体系的动态调整机制
4.2 建议组织实证研究,进一步完善指标体系
指标体系的最终目的是用于考核评估省级医疗器械审评机构,因此建议抽取多家代表性的医疗器械审评机构进行实证研究,研究对象应包括独立审评中心和综合审评中心,新建立的审评中心和长期发展的审评中心,发达地区的审评中心和欠发达地区的审评中心。运用本研究的评价指标体系,通过实证研究验证指标体系的科学性和可行性。
4.3 建议设立动态调整机制,发挥指标体系的指挥棒作用
本研究构建的指标体系,是基于总局对各省医疗器械审评机构现状的调查,也是基于当前研究结果和统计数据。可以预期,随着考核评估工作的开展,各省医疗器械审评机构建设和能力水平可以得到提高。因此,指标体系还应该根据省级医疗器械审评机构的发展情况及时动态调整,以保持指标体系在引导我国审评体系改革中起到的指挥棒作用[12]。如图4,可以形成持续改进的省级医疗器械审评能力考核评估系统。
