4-芳硫基吡喃酮类化合物的合成研究
2018-12-07庄瑜瑜马养民邹坤岐王敏祺
张 金,庄瑜瑜,马养民,邹坤岐,王敏祺
(1.陕西科技大学 化学与化工学院,陕西 西安 710021;2.陕西科技大学 陕西省轻化工助剂重点实验室,陕西 西安 710021)
0 引言
吡喃酮是一类重要的六元含氧芳香杂环化合物,具有抗凝血、抗菌、抗炎、抗艾滋病毒(HIV)及增强免疫、抗氧化、清除体内过多的氧自由基并保护肝细胞等多种生物活性[1-3],因此具有良好的临床应用价值,主要原因是它能够抑制钠、钙等离子的通道,从而控制细胞内钠、钙的浓度,调节粘附分子,细胞因子和酶蛋白在人体内的表达,与DNA结合从而抑制DNA的合成,防止脂质过氧化反应,去除氧自由基.同时,其分子内含有C=C双键、C=O双键,使得该类化合物具有很强的光学性能,可以广泛应用于荧光探针,荧光增白剂,激光染料及非线性光学材料等方面[4-6].
近年来,为了提高吡喃酮的应用范围和价值,化学工作者对吡喃酮进行多种官能团修饰.包括硝化[7]、卤化[8]、芳甲酰化[9]、磺酰化[10]、烷基化[11]和芳硫基化[12]等.其中吡喃酮化合物经过芳硫基化后,生物活性及光学性能都有明显的提高,因此开发一种简洁、高效合成芳硫基吡喃酮类化合物的方法是十分必要的.
通过碳氧键断裂对化合物进行修饰是当前研究的焦点和热点之一.其中,利用过渡金属催化进行交叉偶联反应报道较多,如钌、镍、钯等金属.2008年,Ackermann等[13]提出了一种在钌催化条件下,对甲基苯磺酰氯为磺酰化试剂、碳酸钾为碱,苯酚和苯在高温下反应生成联苯化合物的方法,如图1 (a)所示;2014年,Chen等[14]采用在磷酸钾的1,4二氧六环溶液中,苯酚的惰性碳氧键经过镍催化活化后与苯硼酸偶联生成联苯化合物,如图1(b)所示;2015年,Dikova等[15]利用催化剂二氯化钯将1,3-二羰基化合物的碳氧键活化后与苯硼酸反应,生成烯酮类化合物,如图1 (c)所示.该类反应具有条件苛刻,底物范围窄,反应收率低等缺点,其中过渡金属催化剂的成本、毒性和对环境的影响等因素严重阻碍了金属催化的发展、应用和规模化生产.因此探究出一种无需过渡金属催化,使吡喃酮得到修饰的高效方法是非常重要的,特别是底物适用性强,试剂成本低,反应条件温和,操作简便的合成过程.
基于前期本课题组关于含硫杂环化合物的合成研究[16,17],提出了一种以4-羟基吡喃酮和苯硫酚为底物,三乙胺为碱,在二氯甲烷溶剂中25 ℃反应6小时,合成4-芳硫基吡喃酮类化合物简单高效的方法,如图1(d)所示.
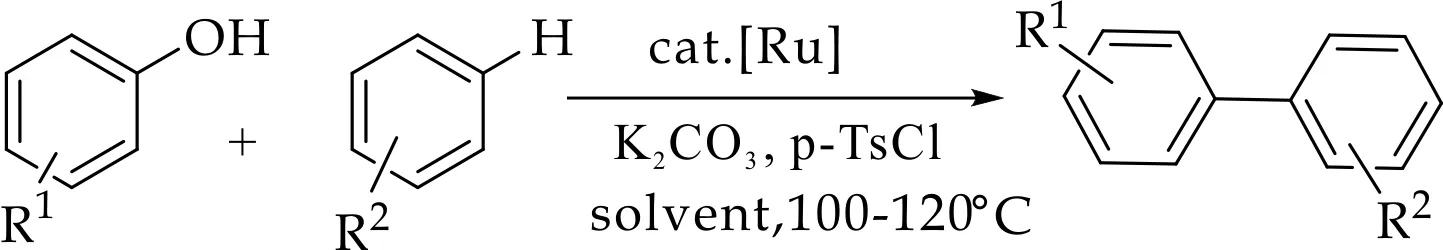
(a)钌催化碳氧键断裂
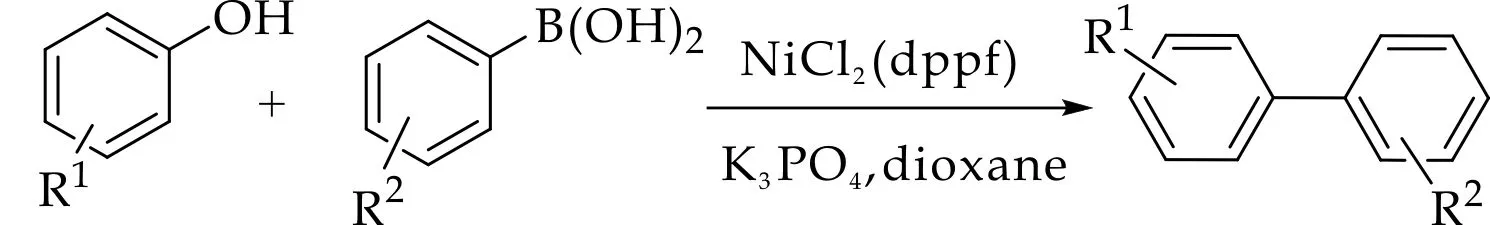
(b)镍催化碳氧键断裂

(c)钯催化碳氧键断裂

(d)本文所用方法图1 通过碳氧键断裂合成化合物
1 实验部分
1.1 试剂和仪器
(1)主要试剂:6-甲基-4-羟基吡喃酮,萨恩化学技术有限公司;4-羟基香豆素,萨恩化学技术有限公司;4-甲基苯磺酰氯,萨恩化学技术有限公司;取代苯硫酚,萨恩化学技术有限公司;二氯甲烷,天津市河东区红岩试剂厂,以上试剂均为分析纯.
(2)主要仪器:旋转蒸发仪,上海亚荣科技有限公司;DF-101S集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司;AVANCE III 400 MHz 核磁共振仪(TMS内标)、Impact HDQ-TOF高分辨质谱仪、Bruker Smart APEX-II CCD X-射线单晶衍射仪,德国 Bruker公司.
1.2 4-芳硫基吡喃酮合成与表征
以合成6-甲基-4-(4-甲基苯硫基)-2H-吡喃-2-酮为例,向50 mL的圆底烧瓶依次加入6-甲基-4-羟基吡喃酮(10.0 mmol),对甲苯磺酰氯(10.4 mmol),三乙胺(11.0 mmol),二氯甲烷(30 mL),室温搅拌,薄层色谱(TLC)监测反应进程,待反应完成,向混合溶液中加入4-甲基苯硫酚(12.0 mmol),TLC监测直至原料消失,停止反应.利用柱层析(乙酸乙酯和石油醚不同梯度洗脱)对产物分离纯化,粗品进一步重结晶得到纯净的化合物.
6-甲基-4-(4-甲基苯硫基)-2H-吡喃-2-酮(3a):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.41(d,J=8.1 Hz,2H),7.28(d,J=8.0 Hz,2H),5.87(s,1H),5.45(s,1H),2.42(s,3H),2.21(s,3H);13C-NMR(101 MHz,CDCl3)δ:164.2,162.4,159.6,155.4,136.7,126.2,120.8,120.2,111.7,103.7,96.0,21.8,20.5;HRMS calcd for:C13H12O2S [M+H]+=233.063 1,found=233.062 9.
6-甲基-4-(4-甲氧基苯硫基)-2H-吡喃-2-酮(3b):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.45(d,J=6.7 Hz,2H),6.99(d,J=8.8 Hz,2H),5.86(s,1H),5.42(s,1H),3.87(s,3H),2.21(s,3H),13C-NMR(101 MHz,CDCl3)δ:164.0,161.7,159.6,159.2,156.1,121.5,115.9,113.0,103.8,96.8,95.9,55.8,20.5;HRMS calcd for:C13H12O3S [M+H]+=249.050 8,found=249.050 2.
6-甲基-4-(4-氟苯硫基)-2H-吡喃-2-酮(3c):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.34-7.18(m,4H) 5.87(s,1H),5.60(s,1H),2.19(s,3H);13C-NMR(101 MHz,CDCl3)δ:165.5,162.6,160.8,160.6(d,JC-F=246.2 Hz)148.8(d,JC-F=3.3 Hz),122.6(d,JC-F=9.5 Hz),117.2(d,JC-F=24.0 Hz),97.5,91.1,20.4;HRMS calcd for:C12H9FO2S [M+H]+=237.038 0,found=237.037 5.
6-甲基-4-(4-氯苯硫基)-2H-吡喃-2-酮(3d):白色粉末,1H-NMR(400 MHz,CDCl3)δ:7.45-7.36(m,2H),7.07-7.02(m,2H),5.82(s,1H),5.61(s,1H),2.18(s,3H);13C-NMR(101 MHz,CDCl3)δ:162.5,160.7,151.4,132.0,130.4,122.2,97.4,91.4,20.0;HRMS calcd for:C12H9O2S [M+H]+=253.008 5,found=253.008 2.
6-甲基-4-(4-溴苯硫基)-2H-吡喃-2-酮(3e):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.48-7.42(m,2H),7.11-7.07(m,2H),5.75(s,1H),5.64(s,1H),2.17(s,3H);13C-NMR(101 MHz,CDCl3)δ:161.2,160.3,152.4,133.4,130.5,123.2,98.4,92.4,20.8;HRMS calcd for:C12H9BrO2S [M+H]+=296.957 9,found=296.957 4.
6-甲基-4-(2-氟苯硫基)-2H-吡喃-2-酮(3f):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.47(m,2H),7.20(m,2H),5.87(s,1H),5.39(s,1H),2.12(s,3H);13C-NMR(101 MHz,CDCl3)δ:165.2,162.5,160.8,154.0(d,JC-F=251.0 Hz),140.1(d,JC-F=12.3 Hz),128.0(d,JC-F=7.6 Hz),125.3(d,JC-F=4.2 Hz),123.3,117.6(d,JC-F=18.3 Hz),96.7,90.6,20.0;HRMS calcd for:C12H9FO2S [M+H]+=237.038 0,found=237.037 4.
6-甲基-4-(2-氯苯硫基)-2H-吡喃-2-酮(3g):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.36-7.18(m,4H)5.78(s,1H),5.59(s,1H),2.18(s,3H);13C-NMR(101 MHz,CDCl3)δ:160.7,153.2,152.5,151.4,145.1,132.0,130.4,127.3,122.2,97.4,91.4,20.0;HRMS calcd for:C12H9ClO2S [M+H]+=253.008 5,found=253.008 2.
6-甲基-4-(2-溴苯硫基)-2H-吡喃-2-酮(3h):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.39-7.35(m,4H),5.83(s,1H),5.56(s,1H),2.23(s,3H);13C-NMR(101 MHz,CDCl3)δ:163.25,159.57,152.37,150.56,136.93,133.76,128.32,127.85,120.96,116.25,114.82,98.79,21.4;HRMS calcd for:C12H9BrO2S [M+H]+=296.957 9,found=296.957 4.
4-(4-甲氧基苯硫基)-2H-苯并吡喃-2-酮(3i):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.87(d,J=8.0 Hz,1H),7.59(t,J=7.8 Hz,1H),7.51(d,J=8.8 Hz,2H),7.35(t,J=8.8 Hz,2H),7.05(d,J=8.8 Hz,2H),5.63(s,1H),3.87(s,3H);13C-NMR(101 MHz,CDCl3)δ:160.2,157.9,153.3,150.8,150.5,136.9,132.8,125.0,116.2,113.1,103.1,101.5,55.4;HRMS calcd for:C16H12O3S [M+H]+=285.058 0,found=285.057 5.
4-(4-氟苯硫基)-2H-苯并吡喃-2-酮(3j):白色晶体,1H-NMR(400 MHz,CDCl3)δ:7.67(d,J=8.0 Hz,1H),7.57(dd,J=12.4 ,5.3 Hz,1H),7.55(q,J=8.4 Hz,4H),7.43-7.36(m,2H),5.76(s,1H);13C-NMR(101 MHz,CDCl3)δ:163.6(d,JC-F=249.2 Hz),160.4(d,JC-F=2.3 Hz),157.8,155.6(d,JC-F=14.3 Hz),132.0,153.5,124.8,122.4(d,JC-F= 10.0 Hz),121.7,119.7(d,JC-F=2.3 Hz),117.5,113.5(d,JC-F=25.0 Hz),112.5,105.7,100.0(d,JC-F=26.5 Hz);HRMS calcd for:C15H9FO2S [M+H]+=273.038 0,found=273.037 6.
2 结果与讨论
2.1 反应条件优化
为了得到最佳反应条件,首先选用6-甲基-4-羟基吡喃酮和4-甲基苯硫酚为模型反应进行探索,主要考察不同溶剂、添加碱、反应时间对该反应的影响,实验结果如表1所示.

表1 反应条件优化
首先选择极性质子溶剂乙醇作为溶剂,产物收率仅有5%(序号1),之后尝试乙腈,N,N-二甲基甲酰胺(DMF),乙酸乙酯(EtOAc)和二氯甲烷(DCM)溶剂进行反应(序号2~5),其中在二氯甲烷中,产物收率达到45%,主要原因是反应底物在二氯甲烷中溶解性比较好,使得反应顺利进行;以二氯甲烷为溶剂,进一步考察添加碱,实验结果表明,当加入无机碱K2CO3和有机强碱1,8-二氮杂二环十一碳-7-烯(DBU)时,反应结果不理想,而N,N-二异丙基乙胺(i-Pr2EtN)和三乙胺(Et3N)对反应的促进作用较好(序号5-8),这主要由于无机碱在有机溶剂中溶解性较差,有机碱的溶解度较好且碱性较为合适,因此选择更为廉价Et3N作为反应的添加碱;随后,考察反应时间对反应的影响.在相同条件下,反应时间从3小时依次增加到6小时、9小时(序号8~10).实验结果表明,反应搅拌3小时,通过薄层色谱分析发现原料没有消耗完全,当反应时间增加到9小时,时间过长,所得目标产物较少,所以6小时为最佳反应时间,得到85%的6-甲基-4-(4-甲基苯硫基)吡喃酮;当反应体系不加碱时,收率明显下降(序号11),说明添加碱对反应起着不可或缺的作用.将反应温度升至35 ℃,反应产率并无大幅度增加(序号12).
综上所述,确定最佳反应条件是以三乙胺为碱,二氯甲烷为溶剂,在25 ℃下反应6小时.
2.2 底物范围研究
在最佳条件基础上,为进一步考察反应底物的适用范围,选择以4-羟基吡喃酮与含有不同取代基的苯硫酚进行反应,以中等优良的收率合成了10种4-芳硫基吡喃酮类化合物3a~3j,如表2所示.

表2 底物范围
当苯硫酚的4位分别引入给电子基团(-Me,-OMe)和吸电子基团(-F,-Cl,-Br)时,实验结果表明,连有给电子基团比吸电子基团能获得更高的收率(3a~3e),说明反应受电子效应的影响.同时,在苯硫酚的2号位分别引入氟、氯、溴基团(3f~3h),与4号位相比,收率有所下降,这可能是空间位阻的原因.进一步考察反应底物的适用性,以4-羟基香豆素与苯硫酚反应,均获得高收率产物(3i~3j).结果表明,在一定反应条件下,反应底物具有较好的普适性.
2.3 机理猜想
在反应实验结果与相关文献报道基础上[18,19],提出了一种可能的反应机理,如图2所示.6-甲基-4-羟基吡喃酮在三乙胺的作用下,脱去质子,之后与对甲基苯磺酰氯形成中间体6-甲基-4-对甲苯磺酰吡喃酮酯(经过分离提纯,利用X-射线单晶衍射对其结构表征,其结构如图3所示),进而与硫酚反应生成4-芳硫基吡喃酮.猜测反应过程中硫酚对α,β的共轭体系进行1,4-共轭加成后,之后发生1,4-消除反应,最终得到4-芳硫基吡喃酮类衍生物.

图2 可能的反应机理
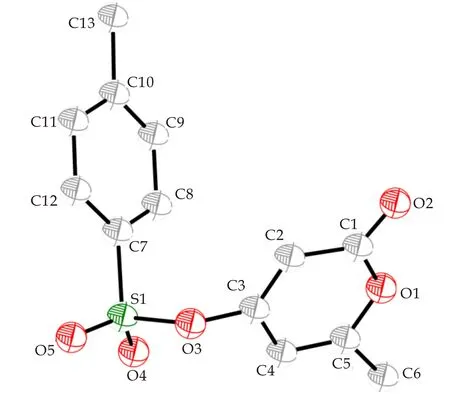
图3 中间体6-甲基-4-对甲苯磺酰吡喃酮酯结构图
3 结论
本文发展了一种操作简单,原子利用率高的合成4-芳硫基吡喃酮类衍生物的方法.研究结果表明,通过以廉价的4-羟基吡喃酮和苯硫酚为反应原料,三乙胺作为碱,在二氯甲烷溶剂中,25 ℃下搅拌反应6小时,经过碳氧键断裂,以65%~88%的收率获得一系列4-芳硫基吡喃酮类化合物.该方法具有广泛的底物适用性、较高的原子经济性等优点,为高效合成含有芳硫基杂环类化合物提供一条新的途径.
