经静脉桥血管逆向行经皮冠状动脉介入治疗右冠状动脉慢性完全闭塞病变1例
2018-12-07应良红龚晓璇范远生王春玲张俊龚伟郑进民陈波陶正贤李春坚
应良红 龚晓璇 范远生 王春玲 张俊 龚伟 郑进民 陈波 陶正贤 李春坚
1 临床资料
患者 男,56岁。因“劳力性胸痛10年,加重3个月”住入南京医科大学第一附属医院。患者10年前始出现活动性胸痛,位于胸骨中后方、呈压榨样、渐加重,于2010年行冠状动脉造影(CAG)示:左主干(LM)正常,左前降支(LAD)近段闭塞,第一对角支(D1)开口80%狭窄,左回旋支(LCX)中段99%狭窄,右冠状动脉(RCA)近段70%狭窄、中段90%狭窄。患者因此接受了冠状动脉旁路移植术(CABG):左内乳动脉(LIMA)-LAD、主动脉(AO)-大隐静脉(SVG)-D1-钝圆支(OM)、AO-SVG-后降支(PDA),术后临床症状好转。近3个月患者劳累时再次发作胸痛,故入院。既往有糖尿病史7年。入院查体无异常。辅助检查示:血清肌钙蛋白I阴性,血清N末端B型脑钠肽前体(NT-proBNP)正常。心电图正常。超声心动图示:各房室腔大小正常,左心室舒张功能减退。入院诊断:(1)冠状动脉粥样硬化性心脏病、CABG术后、不稳定型心绞痛、NYHA心功能分级Ⅰ级;(2)2型糖尿病。
入院后行CAG示:LM末段40%狭窄;LAD近段80%~90%狭窄,中段闭塞;LCX近段闭塞(图1 A);RCA开口60%狭窄,近段80%狭窄,中段90%狭窄,第二转折后闭塞(图1 B);LIMA桥血管末段细小(图1 C);AO-SVG-PDA桥血管通畅,PDA开口处狭窄90%,PDA向后侧支(PLB)逆向供血(图1 D);AO-SVG-D1-OM桥血管通畅(图1 E和F)。心肌核素显像检查示:左心室下壁、下侧壁轻中度心肌缺血(图2)。考虑缺血相关血管为RCA 慢性完全闭塞(CTO)病变,拟采取经皮冠状动脉介入治疗(PCI)。
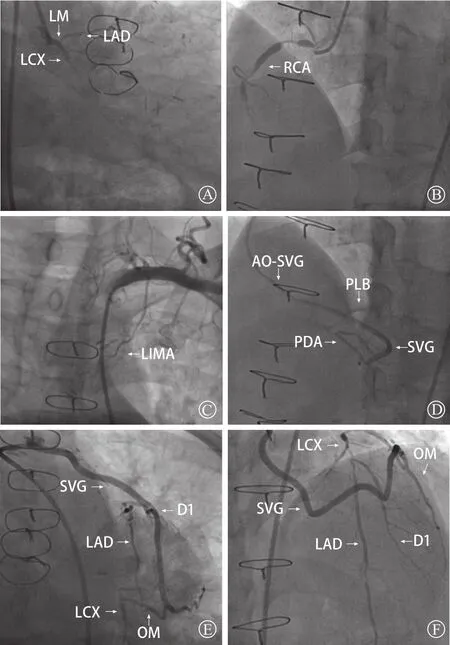
图1 冠状动脉造影 A.LM末段40%狭窄,LAD近段80%~90%狭窄、中段闭塞,LCX近段闭塞;B.RCA开口60%狭窄、近段80%狭窄、中段90%狭窄、第二转折后闭塞;C.LIMA桥血管末段细小;D.AO-SVGPDA桥血管通畅,PDA开口处狭窄90%,PDA向PLB逆向供血;E、F.AO-SVG-D1-OM桥血管通畅
经右桡动脉入径送7 F SAL 1.0指引导管至RCA开口,经右股动脉入径送7 F JR 4.0指引导管至SVG开口。先尝试正向PCI:在Corsair 135微导管支撑下Fielder XT导丝未能正向通过闭塞病变。遂启动逆向PCI:在Corsair 150微导管支撑下Sion导丝通过PDA至RCA闭塞远段,先后使用Fielder XT、UB 3、Miracle 6导丝均未能逆向通过闭塞段。正、逆向结合PCI:正向分别用Miracle 6、Gaia 2导丝对吻逆向导丝,但正、逆向导丝相距较远。逆向Gaia 2导丝对吻正向导丝亦未能直接通过CTO病变段。先后将正向导丝改为Gaia 3、逆向导丝改为Conquest Pro(CP),相互对吻使正、逆向导丝距离靠近,然后分别用Corsair 150微导管、Sprinter 2.0 mm×20.0 mm球囊、2.5 mm×20.0 mm球囊行反向控制性正向和逆向内膜下寻径技术(Reverse CART),但均未成功。试图正向行血管内超声(IVUS)检查确认正、逆向导丝关系,但因RCA第一转折后钙化严重,虽经Sprinter 3.0 mm×15.0 mm球囊扩张,但IVUS导管仍未能通过钙化节段。在球囊锚定基础上,经正向指引导管送入5 F延长导管(Guidezilla),逆向分别选用Fielder XT 导丝(Knuckle)、 UB 3导丝行Reverse CART,亦未成功。逆向送入CP导丝至RCA中段,行Reverse CART,最终逆向CP导丝从Guidezilla延长导管侧面进入血管真腔(有明显突破感)(图3 A),回撤Guidezilla延长导管后将CP导丝送入Guidezilla延长导管内(图3 B)。锚定CP导丝后将逆向Corsair 150微导管送入Guidezilla延长导管,用RG 3导丝完成体外化。球囊扩张RCA后经Guidezilla延长导管行IVUS检查示:逆向导丝进入Guidezilla延长导管前短节段位于内膜下(图4 A),CTO节段内钙化Ⅱ级[1](图4 B)。用Sprinter 3.0 mm×15.0 mm球囊扩张RCA后,在Guidezilla延长导管辅助下由远至近串联置入EXCEL3.0 mm×36.0 mm、EXCEL 3.5 mm×36.0 mm、EXCEL 3.5 mm×36.0 mm 3枚支架,经充分后扩张,复查造影示RCA-PLB、SVG-PDA血流通畅(图5 A和B),手术结束。
2 讨论
CTO病变在CAG发现的动脉粥样硬化病变中占15%~30%[2]。CTO病变介入治疗难度大,单纯正向PCI的成功率通常在50%~70%[3]。近年来,随着术者经验的提高、新器械和先进技术的应用,CTO行PCI成功率可提高至90%以上[4]。CABG术后患者再发心绞痛可能原因为桥血管病变、自身血管病变加重或桥血管未能实现完全血运重建,再次行CABG难度大、并发症发生率高,而行PCI难度相对较小、创伤小、恢复快,为国内、外冠状动脉血运重建指南所推荐[5-7]。

图3 Guidezilla延长导管辅助下逆向CP导丝穿刺进入血管真腔A.逆向导丝从Guidezilla延长导管侧面穿刺进入血管真腔;B.回撤Guidezilla延长导管后将CP导丝送入Guidezilla延长导管内

图4 将逆向Corsair 150微导管送入Guidezilla延长导管,用RG 3导丝体外化后,球囊扩张右冠张动脉行血管内超声检查 A.右冠状动脉内短节段导丝进入内膜下;B.闭塞病变节段内钙化Ⅱ级

图2 心肌核素显像提示左心室下壁、下侧壁轻、中度心肌缺血
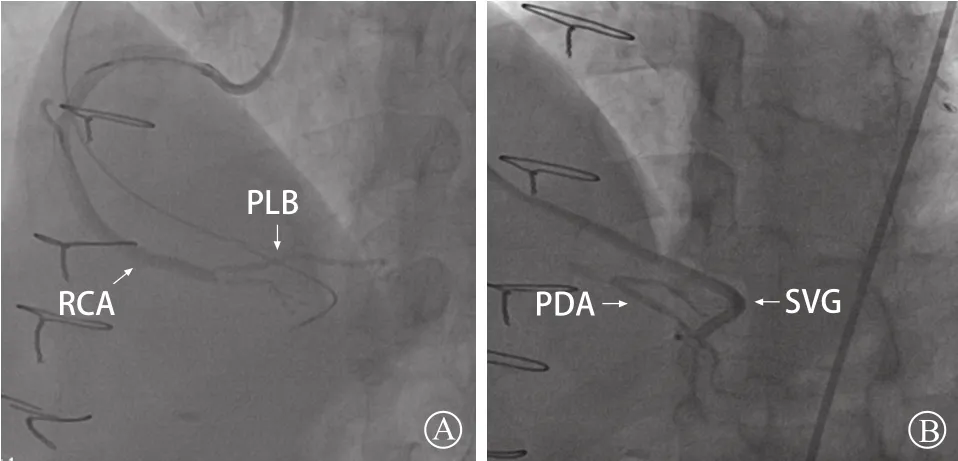
图 5 术后冠状动脉造影 A.RCA-PLB血流通畅;B.SVG-PDA血流通畅
本例患者CAG示冠状动脉三支血管均闭塞,AOSVG-D1-OM序贯桥通畅,D1向LAD、OM向LCX经SVG桥逆行供血;虽D1-LAD、OM-LCX分叉处均有狭窄,但心肌核素显像未显示前壁缺血;而AO-SVG-PDA桥血管虽通畅,但PDA开口重度狭窄,PDA-PLB逆向供血受限,心肌核素显像亦显示左心室下壁、下侧壁心肌缺血,故考虑RCA为主要罪犯血管,因而对RCA行PCI。本例患者RCA CTO入口处有分支血管、闭塞段>20 mm、钙化、CTO节段内存在成角,其日本CTO(J-CTO)评分≥3分,正向开通非常困难 ,而LAD和LCX均闭塞,逆向治疗无理想自身侧支。令人欣喜的是,患者CABG术后SVG-PDA桥血管通畅,可利用SVG为逆向侧支对RCA进行逆向治疗。因此,此例患者术前的PCI策略为:首先行前向PCI,若前向治疗失败,则经静脉桥行逆向PCI。
对RCA行PCI亦可考虑经静脉桥置入支架至PDARCA远段。对本例患者未进行如此操作,原因为:(1)经PDA-RCA远段置入支架可能影响PLB的开口,而PLB开口成角难于保护;(2)支架通过桥血管吻合口可能出现困难;(3)RCA近段至中段管腔是开通的,但存在重度节段性狭窄,在开通RCA CTO的同时对近段狭窄性病变进行处理将改善RCA全程血流,可能达到比单纯改善PLB血流更好的效果。
在PCI过程中多次采用Reverse CART未能成功,前向IVUS导管未通过钙化节段,故未能对Reverse CART起到指导作用。最终前向送入Guidezilla延长导管,逆向送CP导丝从Guidezilla延长导管侧面进入血管真腔。术者认为Guidezilla延长导管可起到对血管内膜的内衬和支撑作用,使得在逆向导丝穿刺时内膜无退缩空间,使逆向导丝更易穿透内膜,从内膜下进入到血管真腔,因此Guidezilla延长导管实际起到类似Reverse CART中球囊的作用。
目前,国外有少数经静脉桥血管逆向开通自身CTO病变的报道[8],但国内尚未见个案报道。由于竞争血流的影响,CABG术后自身冠状动脉轻、中度狭窄的桥血管较严重狭窄的桥血管再闭塞率增高[9]。本例患者PDA开口病变是否需要处理值得讨论:如果在PDA开口前向置入支架,必然使RCA与静脉桥形成竞争血流,有增加静脉桥血管闭塞的风险,因而未对PDA开口病变进行干预。最终此病变将两路血流自然分隔开,术后RCA血流供应PLB,而静脉桥血流供应PDA。因此,减轻或避免竞争血流可能有利于减少未来自身血管再狭窄或静脉桥血管闭塞的发生,但尚需进一步随访和研究。
