由竞赛磨课活动引发的深度思考——以2015年高考新课标理综 Ⅰ 卷第13题、2018年浙江省化学竞赛第3题为例
2018-12-06湖南李银秀
湖南 李银秀
2018年4月,我校启动了“评选35岁以下青年教师教坛新秀”的活动,本教研组有位教师确定选择《关于电解质溶液的数形结合专题》作为高考化学二轮复习的赛课主题。笔者想到了2015年高考新课标理综Ⅰ卷第13题,在高考真题中该题图象首次以pH-对数图的形式呈现,不难发现该题图象与2017年高考新课标理综Ⅰ卷第13题有相似之处,也有耐人寻味的不同细节信息。由该题引发的对考点分析、能力考查、细节的深度思考等无不令人感叹命题者的智慧与严谨。2018年浙江省竞赛第3题通过运用高考真题中的假设法化难为易,直击问题本质。本文就这两题进行分析,与各位老师分享。
一、高考原题

( )

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等

二、高考试题分析
1.基本分析
该题涉及的内容是化学平衡的延伸和应用,考查学生对于弱碱电离平衡知识的掌握程度,该内容既是中学化学的基础知识,也是高考考查点分布较多的内容之一。该题通过图象提供有关信息,考查学生对弱碱电离平衡、溶液中离子浓度的变化等知识的掌握程度,以及推导一些极端情况变化规律的思维能力。要求学生不仅要掌握弱电解质的电离平衡规律,还要有较好的识图能力、科学的思维方式。充分体现了《考试大纲》中对考生“接受、吸收、整合化学信息能力”的要求,确保试题具有较好的选拔性。
选项A:提供了一个重要信息:0.10 mol·L-1的MOH溶液pH=13,即c(OH-)=0.10 mol·L-1,说明MOH在水中全部电离,为强碱;ROH溶液的pH=11.3左右,说明ROH在水中部分电离,为弱碱。所以选项A正确。

若作定量分析
起始浓度(mol·L-1)c0 0
平衡浓度(mol·L-1)c-c(OH-)c(OH-)c(OH-)
定量分析与定性分析相比,表面上耗时、走了弯路,但这种较为严谨的推断在教学中可以帮助学生深刻理解弱电解质溶液的Kb、α与溶液初始浓度的关系,有助于提升证据推理与模型认知能力;而且当学生遇到更陌生的问题时,学会将复杂问题分解为几个相对简单的问题,不要轻易放弃,有利于培养学生坚韧的学习品质。
选项C:对弱电解质溶液稀释程度与电离程度的进一步考查,对学生思维方式的考查进一步提高。在研究很多问题时,往往要进行极限假设,尽管极限值实际不一定能完全达到,但这种研究问题的策略可简化复杂问题。无限稀释是一种极端假设。若两溶液无限稀释,MOH和ROH都将完全电离,当其浓度小于1×10-7mol·L-1时,完全电离,所电离产生的c(OH-)也都将小于作为溶剂的水本身电离出的c(OH-),此时两种溶液中的c(OH-)都与水相近,或者说,此时两种溶液中的c(OH-)都趋近于1×10-7mol·L-1,可以看成相等,所以选项C正确。
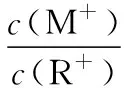
2.图象分析

现将分析过程推导如下:
将④式两边取负对数,得
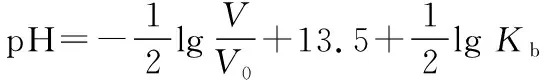

若无限稀释,不能忽略水的电离,较为真实的图象如何?为此将问题转化为下列案例分析。

以ROH溶液为例分析如下:

n(ROH)始=0.1 mol ⑦
根据电荷守恒:c(H+)+c(R+)=c(OH-),可知10-y+c(R+)=Kw/10-y⑧

联立⑥⑦⑧⑨⑩,消元得函数关系并利用Wolfram Mathematica 应用平台,键入代码,得如图1所示:

图1 强碱、弱碱溶液被水稀释后的关系
与上述处理强碱、弱碱溶液的稀释类似,同样可得强酸、弱酸溶液被水稀释后的pH变化关系图2所示。
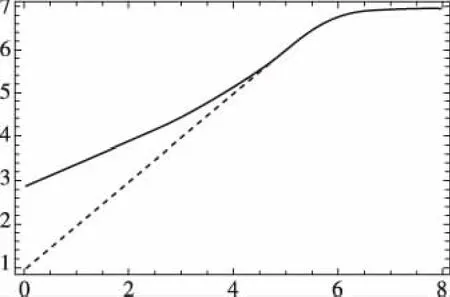
图2 强酸、弱酸溶液被水稀释后的关系
为了培养学生的深度思维和举一反三的能力,教学中可以在学生掌握基本知识的情况下,进行变式训练,如:

2018年4月14日,浙江省进行了化学竞赛预赛,其中第3题在教研活动中多次被教师们提到。该题若巧用假设思想,正如前文所述的高考真题,则能另辟蹊径、直击问题本质,达到快捷解题的目的,很好地训练学生思维的多样性、深刻性、敏捷性;若用常规方法较耗时,但学生容易接受;若在讲评时两者结合起来,则更能让学生信服。
三、竞赛原题
(2018年浙江省化学竞赛·第3题)固体硝酸盐加热分解产物较复杂。某兴趣小组对NH4NO3的热分解产物提出如下4种猜想:
甲:N2、HNO3、H2O 乙:N2O、NO2、H2O
丙:NH3、N2、H2O 丁:N2、NO2、H2O
你认为猜想有科学性不正确的是
( )
A.甲和乙 B.乙和丁
C.乙和丙 D.丙和丁
四、竞赛试题分析

1.假设分析

2.常规方法



解得x=1y=0
即生成N2O时,不可能同时生成NO2,乙组产物不可能。

令NH4NO3的化学计量数为1,则据O元素守恒,H2O的化学计量数为3;据H元素守恒,NH3的化学计量数为负数。即生成N2时,不可能同时生成NH3,丙组产物不可能。
五、教学启示

