常用化学计量重要考点探讨
2018-12-06广东雷范军李作清
广东 雷范军 李作清
常用化学计量是每年高考化学必考内容,代表了化学学科的主要特征。《普通高中化学课程标准(2017年版)》对该部分的要求是“了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用;能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。”常用化学计量主要包含物质的量、阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度的含义及应用,根据物质的量与微粒或共价键数目、物质质量、气体体积、溶液体积之间的相互关系进行有关计算, 阿伏加德罗定律、稀释公式、化学方程式或关系式的含义及其应用、配制一定物质的量浓度溶液等内容。下面根据教材内容和最新“考纲”及其说明的要求提炼该部分常见的重要考点,并精选典型例题探讨其在近年高考的考查方式、类型、解答过程与方法。
一、计算物质组成、结构和变化中的某微粒或共价键数目
该考点通常考查一定质量或体积的某物质中所含分子数、原子数、质子数、中子数、电子数、共价键数,一定体积一定物质的量浓度的某溶液中所含离子数,一定量的某物质完全反应后转移电子数(得到电子数或失去电子数)、生成某分子的数目。通常涉及的内容有摩尔质量、气体摩尔体积的含义及其应用,物质组成、结构和变化关系式或方程式的含义及其应用、元素化合物的主要性质、氧化还原反应、可逆反应、化学平衡、电离、水解等。
例1.(2018全国Ⅱ,11)NA代表阿伏加德罗常数的值。下列说法正确的是
( )
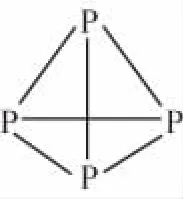
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
C.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D.密闭容器中,2 mol SO2和 1 mol O2催化反应后分子总数为2NA
答案:C
二、“给定”情景的计算
“给定”情景的计算问题也称为新情景或新信息下与计算相关的问题(如与物理、生物、数学的结合点),可能涉及常规计算未涉及的新概念,如残留量、化学需氧量、碘值、溶解氧、有效氯等。这类综合计算题要求学生能够以信息为证据进行推理,对考生的现场自学能力要求较高。
例2.(2018全国Ⅱ,28节选)已知K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)受热完全分解后的残留固体物含有FeO和Fe2O3,以该残留物为样品可以测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为 _____________。
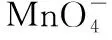
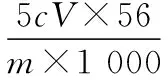
技巧点拨:“给定”情景的计算经常涉及陌生的测定原理和复杂的操作步骤,通常以文字信息(如“有效氯”含量)、单位信息等形式给出。明确实验需要测定的物理量,找到已知物理量和未知物理量之间的定量关系,描述该测定过程,并指出测定过程中各个步骤的意义,要忽略题中所给的多余信息,这些是审题的关键。此类计算题的一般解题程序如下:一是依据题意,明晰概念,根据给定情景写出有关计算表达式;二是细读方案,根据计算表达式,确定需根据实验求解的物理量,并从方案中确定实验直接测定的物理量,建立需求解物理量和直接测定物理量的定量关系;三是代入数据,得出答案。
三、配制一定物质的量浓度的溶液
该考点经常考查托盘天平或分析天平、容量瓶、玻璃棒、胶头滴管、烧杯、量筒等仪器的使用方法,物质的溶解或稀释方法,定容的方法,计算配制一定体积一定物质的量浓度溶液所需固体(含结晶水化合物)药品的质量或浓溶液的体积,配液操作对实验结果的影响规律等形式。主要涉及仪器的使用、药品的取用或称量、配液操作、根据物质的量浓度和溶液的体积计算溶质的物质的量、根据溶质和原料的关系式计算物质的质量、误差分析等。
例3.下列说法正确的是 _____________。
②用标准盐酸溶液滴定可以测定NaOH溶液浓度,在配制标准盐酸溶液过程中,烧杯中的盐酸溶液有少量溅出,使测定结果偏高。
③容量瓶和滴定管使用前均需要检漏,洗净的锥形瓶和容量瓶必须放进烘箱中烘干。
④为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线。
⑤邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小。
⑥称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度,配制浓度为0.010 mol·L-1的KMnO4溶液。
⑦用量筒量取20 mL 0.500 0 mol·L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.100 0 mol·L-1H2SO4溶液。
⑧用量筒量取5.00 mL 1.00 mol·L-1盐酸于50 mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸。

答案:②④
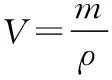
四、有关物质或产品纯度的实验和计算
有关物质成分或化工产品中纯度的计算是近年高考的热点,主要涉及定量实验所用仪器的使用、实验原理和现象、物质的量浓度的计算、物质的量在化学或离子方程式等计算中的应用、质量分数的计算等。
例4.(2018全国Ⅲ,26节选)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂,利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至________。
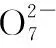
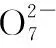
答案:①烧杯 容量瓶 刻度 ②95.0

