水疱性口炎病毒免提取核酸荧光定量PCR鉴别检测方法的建立
2018-12-05张彩虹林彦星杨俊兴曹琛福吕建强黄超华祁振强林庆燕花群义
张彩虹,林彦星,杨俊兴,曹琛福,吕建强,黄超华,祁振强,林庆燕,花群义*
(1.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518045;2.深圳市宝舜泰生物医药股份有限公司,广东深圳 518101)
水疱性口炎(Vesicular stomatitis,VS)是由水疱性口炎病毒(Vesicular stomatitis virus,VSV)引起的一种重要的人畜共患传染病,在我国进境动物检疫疫病名录中列为二类传染病[1-2]。马、牛和猪是易感动物,绵羊、山羊和其他野生动物也可被感染。易感动物染病后临床症状与口蹄疫、猪水疱性皮疹以及猪水疱病很难区分,因而实验室诊断需要对这几种传染病进行鉴别诊断[3]。VSV分为2个血清型,即印第安纳型(VSV-IND)和新泽西型(VSV-NJ)。VSV为单股负链RNA病毒,基因组全长约11 kb,依次排列着N、NS、M、G和L 5个基因,分别编码核蛋白、磷蛋白、糖基化蛋白、糖蛋白和RNA聚合酶蛋白。水疱性口炎的存在与流行直接影响人类及动物健康,造成重大经济损失。随着我国进口动物及动物产品贸易量的不断增长,水疱性口炎传入我国的风险不容忽视,一旦传入将会给我国的养殖业造成重大损失,因此建立快速高效的鉴别诊断方法对防止该病传入具有重要的现实意义。
荧光定量PCR方法是将PCR与荧光检测结合起来,具有高度的特异性、敏感性和准确性,已经广泛应用于动物疫病诊断领域。直扩荧光定量PCR方法是利用一类经过基因工程改造的高耐受的TaqDNA聚合酶,这类酶可以直接以全血、血清、尿液、水疱液、粪便、牛奶、动物组织等材料为模板,无需经过核酸提取的步骤,经一步PCR扩增到目的基因,从而显著简化检测流程,节省时间和成本,提高检测效率。目前国内外已经建立了多种检测VSV核酸的PCR或荧光定量PCR方法[4-12],本研究团队也建立了一种可同时鉴别检测VSV-IND和VSV-NJ的二重荧光定量PCR方法[13]。但目前还没有检测VSV直扩荧光定量PCR方法的报道,本研究以VSV两种血清型编码病毒RNA聚合酶的L基因为靶序列,分别设计特异性的引物和探针,通过对反应条件的优化,建立了一种鉴别检测水疱性口炎病毒印第安纳型和新泽西型的直扩荧光定量PCR方法。
1 材料与方法
1.1 材料
1.1.1 病毒株 水疱性口炎病毒IND型和NJ型灭活抗原从美国国家兽医服务实验室(NVSL)引进,由深圳出入境检验检疫局动检实验室保存;FMDV O型疫苗株从云南保山疫苗厂引进;猪水疱病病毒(SVDV)、蓝舌病病毒(BTV)、鹿流行性出血病病毒(EHDV)、小反刍兽疫病毒(PPRV)、牛病毒性腹泻病毒(BVDV)和猪瘟病毒(CSFV)的灭活抗原均由深圳出入境检验检疫局动检实验室保存。
1.1.2 试剂 病毒RNA抽提试剂盒MagMAXTM-96 Viral RNA Isolation Kit (AM1836)购自美国ABI公司;Direct One-Step S/P qPCR Taqprobe Kit购自美国VitaNavi公司。
1.2 方法
1.2.1 引物和探针 本文中所用到的引物和探针序列引用于本研究团队林彦星等所建立的鉴别检测VSV-IND和VSV-NJ的荧光定量PCR方法[13],特异性扩增水疱性口炎病毒编码病毒RNA聚合酶的L基因,引物与探针均由生工生物工程(上海)股份有限公司合成。
1.2.2 直扩荧光定量PCR反应体系的建立 采用直扩荧光定量PCR试剂盒,在25 μL反应体系中包含以下成分:2×S/P qPCR mix、25×S/P qPCR Polymerases、模板、VSV-IND引物和探针(10 μmol/L)或VSV-NJ引物和探针(10 μmol/L)、Rox Reference Dye、DEPC水。应用矩阵法对引物和探针的使用浓度进行筛选,以获得最佳的扩增效果。

表1 VSV-IND和VSV-NJ L基因的引物和探针序列
本试验在ABI 7500荧光PCR仪上进行,反应结束后,根据扩增曲线和CT值判定结果。VSV-NJ的反应结果在FAM通道检测,VSV-IND的检测结果在HEX通道检测。
1.2.3 直扩荧光定量PCR方法的特异性试验 采用直扩荧光定量PCR方法,按照优化后的反应体系和最佳反应条件,分别以VSV-IND、VSV-NJ、FMDV、SVDV、BTV、EHDV、PPRV、BVDV和CSFV的灭活抗原和BHK-21细胞培养液为模板,对该方法的特异性进行评估。
1.2.4 直扩荧光定量PCR方法的敏感性试验 将VSV-IND和VSV-NJ的灭活抗原进行10倍系列稀释,采用已优化的直扩荧光定量PCR进行扩增,对该方法的敏感性进行评估,同时与常规的荧光定量PCR[13]进行比较。
1.2.5 直扩荧光定量PCR方法的重复性试验 分别采用等量的4份不同浓度梯度的模板进行直扩荧光定量PCR试验,每份模板每个浓度做3个重复,以确定该方法的组内差异。在不同的时间段对4份不同浓度梯度的模板进行3次直扩荧光定量PCR试验,以确定该方法的组间差异。
1.2.6 临床样品的检测 采用本研究所建立的方法,对本室保存的200份临床样品进行检测,并分别以VSV-IND和VSV-NJ灭活抗原为阳性对照,同时用本室建立的双重荧光PCR方法[13]进行检测,并对检测结果进行比对。
2 结果
2.1 直扩荧光定量PCR方法的建立
通过对VSV-IND和VSV-NJ引物和探针浓度的优化,最终确定25 μL反应体系,2×S/P qPCR mix 12.5 μL,25×S/P qPCR Polymerases 1 μL,正反向引物各1 μL,探针0.5 μL,模板5 μL,Rox Reference Dye 0.5 μL,DEPC水 3.5 μL。荧光定量PCR循环条件为:55℃ 30 min,95℃ 5 min,然后94℃ 20 s,60℃ 40 s,进行40个循环,VSV-NJ在FAM通道进行结果分析,VSV-IND在HEX通道进行结果分析。结果显示,以VSV-IND和VSV-NJ灭活抗原为模板进行检测时分别在HEX和FAM通道出现典型的S型扩增曲线,BHK-21细胞培养液、空白对照无扩增,且VSV的两个血清型之间无交叉反应,即HEX通道只有VSV-IND灭活抗原出现典型的S型扩增曲线;FAM通道只有VSV-NJ灭活抗原出现典型的S型扩增曲线(图1)。
2.2 直扩荧光定量PCR 的特异性试验
采用已优化的直扩荧光定量PCR反应体系,分别以VSV-IND、VSV-NJ、FMDV、SVDV、BTV、EHDV、PPRV、BVDV和CSFV的灭活抗原和BHK-21细胞培养液为模板,进行直扩荧光定量PCR扩增。结果显示,在FAM通道,只有VSV-NJ样品呈典型的阳性扩增反应;在HEX通道,只有VSV-IND样品呈阳性扩增反应,其他病毒对照和BHK细胞对照均呈阴性反应(图2),表明所建立的方法特异性好,能准确鉴别检测VSV-IND和VSV-NJ,且与其他能引起相似症状的病毒样品无交叉反应。
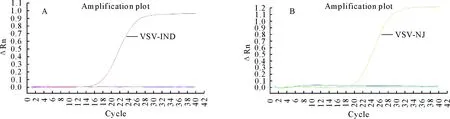
A.VSV-IND扩增曲线图(HEX);B.VSV-NJ扩增曲线图(FAM)A.Amplification curve of VSV-IND (HEX); B.Amplification curve of VSV-NJ (FAM)

A.VSV-IND特异性结果(HEX);B.VSV-NJ特异性结果(FAM)A.Specificity result of VSV-IND (HEX); B.Specificity result of VSV-NJ (FAM)
2.3 直扩荧光定量PCR 的敏感性试验
结果显示,建立的直扩荧光定量PCR方法对VSV-IND和VSV-NJ灭活抗原的检测灵敏度均为10-5(图3),而常规的荧光PCR对同一份样品的检测灵敏性也为10-5,该方法的检测灵敏性与传统的先提核酸再进行荧光定量PCR[13]的灵敏性相当,说明所建立的方法具有良好的检测灵敏度。
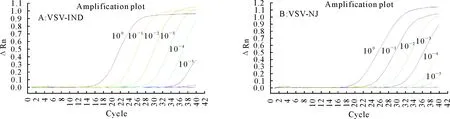
A.VSV-IND敏感性结果(HEX);B.VSV-NJ敏感性结果(FAM)A.Sensitivity result of VSV-IND (HEX); B.Sensitivity result of VSV-NJ (FAM)
2.4 直扩荧光定量PCR的重复性试验
VSV-IND和VSV-NJ分别选取4个稀释度的灭活抗原进行直扩荧光定量PCR,每个稀释度做3个重复,根据Ct值计算变异系数(CV)。组内变异试验结果显示,VSV-IND检测的变异系数为0.29%~1.14%,VSV-NJ检测的变异系数为0.24%~1.83%;组间变异试验结果显示,VSV-IND检测的变异系数为1.62%~2.12%,VSV-NJ检测的变异系数为0.85%~1.92%,表明该方法重复性好(表2和图4)。

表2 检测VSV-IND和VSV-NJ的直扩荧光定量PCR重复性试验结果
2.5 临床样品的检测
分别用建立的直扩荧光定量PCR方法和常规的二重荧光PCR方法对200份猪血临床样品进行检测,结果显示,直扩荧光定量PCR方法仅阳性对照出现典型的扩增曲线,200份临床样品均无特异性扩增曲线,该结果与常规二重荧光PCR结果一致。
3 讨论
本研究采用一种新型的TaqDNA聚合酶,建立了一种无需提取核酸,直接从样品中进行目的基因扩增的可快速鉴别检测VSV-IND和VSV-NJ的直扩荧光定量PCR方法。
在传统的荧光定量PCR方法中,由于其DNA聚合酶的活性受各种各样样品(如血液、动植物组织、饲料、食物)中抑制因子(如血红蛋白、高铁血红素、乳铁蛋白等)的影响,在进行检测时,必须先从待测样本中分离纯化核酸。目前虽然有多家公司推出了自动或半自动的核酸提取工作站,显著节省了人力成本,但核酸提取的费用显著增加,尤其是很多基层检测实验室难以配备价格昂贵的全自动核酸提取仪。而直扩荧光定量PCR法则避免了这一难题,该技术的优势是采用高耐受性的DNA聚合酶,无需提取核酸,可直接从样品中扩增目的基因,从而简化了PCR的步骤,克服了传统荧光定量PCR中存在的成本高、效率低、易造成交叉污染等问题。目前该方法已经应用于动物疫病病原的检测[14-15]。
特异性、敏感性和检测速度是考查荧光定量PCR的3项重要指标,本研究设计的引物和探针特异性良好,不仅可以鉴别检测2种血清型的VSV,而且与其他能引起相似症状的病毒无交叉反应。就检测的敏感性来说,本方法的敏感性与传统的荧光定量PCR相当,对10倍系列稀释的VSV-IND和VSV-NJ的灭活抗原检测的敏感性均为10-5。在保证了方法的特异性和敏感性的前提下,本方法无需提取核酸,比传统的荧光定量PCR节省了提取核酸的时间、人力和物力,在检测速度方面明显略胜一筹,而且避免了核酸提取过程中可能发生的污染问题。水疱性口炎为一种外来动物疫病,目前国内还未见该病发生的报道,因此用该方法对200份临床样品进行检测时,结果均为阴性,与常规荧光定量PCR检测结果一致。本研究建立的鉴别检测VSV-NJ和VSV-IND的直扩荧光定量PCR方法,具有良好的特异性、敏感性和重复性,为VSV的检测、检疫、食品安全检验和VSV分子生物学研究提供了一种新的方法,也为在同一管内对VSV的2个血清型进行直扩荧光定量PCR鉴别检测研究奠定了基础。
