表达猪瘟病毒E2和猪繁殖与呼吸综合征病毒GP5蛋白重组腺病毒动物免疫保护试验
2018-12-05华思红熊贝佳樊钰莹孙永科杨玉艾
华思红,熊贝佳,樊钰莹,孙永科,杨玉艾
(云南农业大学动物医学院,云南昆明 650201)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种急性、热性、致死性疾病,给世界养猪业造成极大的损失[1]。E2蛋白是猪瘟病毒的主要保护性抗原,能诱导机体产生高水平的特异性中和抗体,保护猪抵抗致死量CSFV的攻击,在新型疫苗的研发上发挥着重要作用[2]。以CSFV E2基因为靶基因的基因工程疫苗的研究取得了良好的进展,如Sun Yuan等用CSFV E2基因构建的腺病毒/甲病毒复制子嵌合载体猪瘟疫苗rAdV-CSFV-E2免疫试验兔和猪,均可产生较高的CSFV特异性中和抗体,提供完全保护[3]。Wu Chi-ming等将E2基因与杆状病毒重组,并在昆虫细胞中表达的E2可以保护接种猪免受强毒的攻击[4]。郭抗抗等用猪瘟病毒Shimen株E2基因构建的“自杀性” DNA疫苗重组质粒pSCA1-E2免疫小鼠后能产生较高水平的淋巴细胞刺激指数,免疫猪可检测到抗CSFV特异性血清抗体[5]。
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)俗称“猪蓝耳病”,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种高度接触性传染病,感染PRRSV可引起大批妊娠母猪流产和仔猪的高死亡率,严重威胁着我国养猪业的健康发展[6]。PRRSV的结构蛋白分别为GP2、GP3、GP4、GP5、M蛋白以及N蛋白,分别由病毒基因组ORF2~7编码[7]。GP5蛋白由ORF5基因编码,是PRRSV的主要结构蛋白,可以诱导机体产生中和抗体和诱导细胞凋亡,在病毒的吸附和穿入、生物合成与组装和诱发T细胞的增殖应答过程中都发挥着重要作用,对于研制重组亚单位疫苗及核酸疫苗有重要意义[8]。曹亮等通过重组病毒分别表达GP3、GP5及共表达GP3-GP5蛋白,免疫小鼠后显示出良好的免疫原性[9]。许信刚等用PRRSV主要保护性抗原基因ORF5构建的重组疫苗菌株X4550(pYA3341-ORF5)免疫小鼠和猪体后,能够诱发特异性细胞免疫和体液免疫反应[10]。
本研究将CSFV E2和PRRSV GP5基因串联,克隆到腺病毒穿梭载体上,经转染获得了表达E2和GP5蛋白的重组腺病毒rAd-E2-GP5。通过猪体免疫保护试验,从临床症状、抗体水平、免疫攻毒保护水平及病理学变化等方面综合评价rAd-E2-GP5的免疫保护效果,以期为CSFV和PRRSV联合疫苗的研发提供基础。
1 材料与方法
1.1 材料
1.1.1 疫苗 表达CSFV E2和PRRSV GP5基因重组腺病毒rAd-E2-GP5为云南农业大学动物医学院分子生物学实验室前期构建;PRRSV减毒活疫苗(TJM-F92株,瑞兰安)购自硕腾(上海)企业管理有限公司(批号:1504004,1504019),有效期1年;猪瘟兔化弱毒疫苗(猪瘟脾淋苗)由青岛易邦生物工程有限公司惠赠(批号:201607,201608),有效期1年。
1.1.2 毒株 攻毒用猪瘟病毒强毒为云南农业大学动物医学院分子生物学实验室保存血毒,猪繁殖与呼吸综合征病毒强毒由云南农业大学动物医学院预防实验室尹格芬老师惠赠。
1.1.3 主要试剂 ExTaqDNA聚合酶、DNA Marker(DL1000、DL2000)均购自宝生物工程(大连)有限公司;反转录试剂盒(Transcriptor First Strand cDNA Synthesis Kit)购自罗氏公司;琼脂糖购自Biotopped公司;Trizol、氯仿、异丙醇、无水乙醇、丙烯酰胺(SDS)购自西陇化工股份有限公司。
1.1.4 试剂盒 猪瘟ELISA抗体检测试剂盒和猪繁殖与呼吸综合征ELISA抗体检测试剂盒购自武汉科前生物股份有限公司。
1.1.5 试验用动物 35头34日龄~38日龄的健康断奶仔猪,购自云南玉溪某猪场,该猪场近2年未出现PRRS和CSF疫情,所挑选试验猪未经PRRS和CSF疫苗免疫,试验前采集血样进行PRRSV和CSFV ELISA抗体及RT-PCR抗原检测,均为阴性。试验地点为云南农业大学动物医学院动物房。
1.2 方法
1.2.1 试验设计 将35头未免疫阴性猪随机分为7组(表1),每组5头,1、2、3组每头接种2 mL剂量为1×108TCID50的rAd-E2-GP5,4、5、6组接种PRRS、CSF、PRRS+CSF商品苗,使用按说明书进行,7组接种DMEM,所有组试验猪免疫途径均为颈部肌肉注射,均在一免后21 d以相同的途径和剂量再次免疫,二免后21 d攻毒,1、4组和7组中2头攻3×105.5TCID50PRRSV强毒,攻毒方式为每头鼻滴2 mL,肌肉注射1 mL;2、5组和7组中2头攻4×103TCID50CSFV强毒,攻毒方式为每头鼻滴2 mL,肌肉注射2 mL;3、6组和7组中1头攻3×105.5TCID50PRRSV+4×103TCID50CSFV强毒。
1.2.2 体温检测及临床观察 攻毒后每天早上用温度计测量所有猪直肠温度,绘制体温曲线;每日观察各组猪的精神、采食、饮水、粪便和发病情况,记录临床症状。
1.2.3 体重测量 免疫接种后每周测量体重,观察各组之间体重增长情况。
1.2.4 猪血清抗体的检测 在一免第0、7、14、21天、二免后第7、14、21天及攻毒后第7、14天于猪前腔静脉采集每头猪血液,按常规方法无菌分离血清,采用科前的CSFV抗体ELISA检测试剂盒和PRRSV抗体ELISA检测试剂盒分别检测CSFV和PRRSV抗体,具体操作和结果判定按试剂盒说明书进行。猪繁殖与呼吸综合征KQ≥20判为阳性,KQ<20判为阴性;猪瘟阻断率≤30%判为阴性,≥40%判为阳性,在30%~40%判为可疑。
1.2.5 引物设计和组织中病毒核酸检测 根据CSFV E2基因和PRRSV GP5基因的序列,使用分子生物学软件Primer Premier 5设计引物。CSFV上游引物为:5′-GAATCTGGTGGGTCCCTC-3′,CSFV下游引物为:5′-GTTACCCTCACCTCCTTGG-3′,扩增长度294bp;PRRSV上游引物为:5′-CCATTCTGTTGGCAATTTGA-3′,PRRSV下游引物为:5′-GGCATATATCATCACTGGCG-3′,扩增长度716 bp,引物由生工生物工程(上海)股份有限公司合成,使用浓度为50 μmol/L。
无菌采集试验过程中病死猪以及试验结束时处死猪的淋巴结、脾脏、肺脏、肾脏、肝脏、心脏于自封袋中,用生理盐水配300 mL/L甘油浸泡保存,用Gibico公司的Trizol Reagent试剂提取其总RNA,用以上引物进行RT-PCR检测组织中CSFV和PRRSV的有无情况。
1.2.6 剖检记录 对试验致死猪剖检并记录病理变化,攻毒后15 d处死所有存活试验猪,剖检并记录。
1.2.7 攻毒保护率 攻毒后主要从有无猪瘟和猪繁殖与呼吸综合征临床症状、体温反应、剖检病理变化、存活率等方面进行评价,统计攻毒保护率。
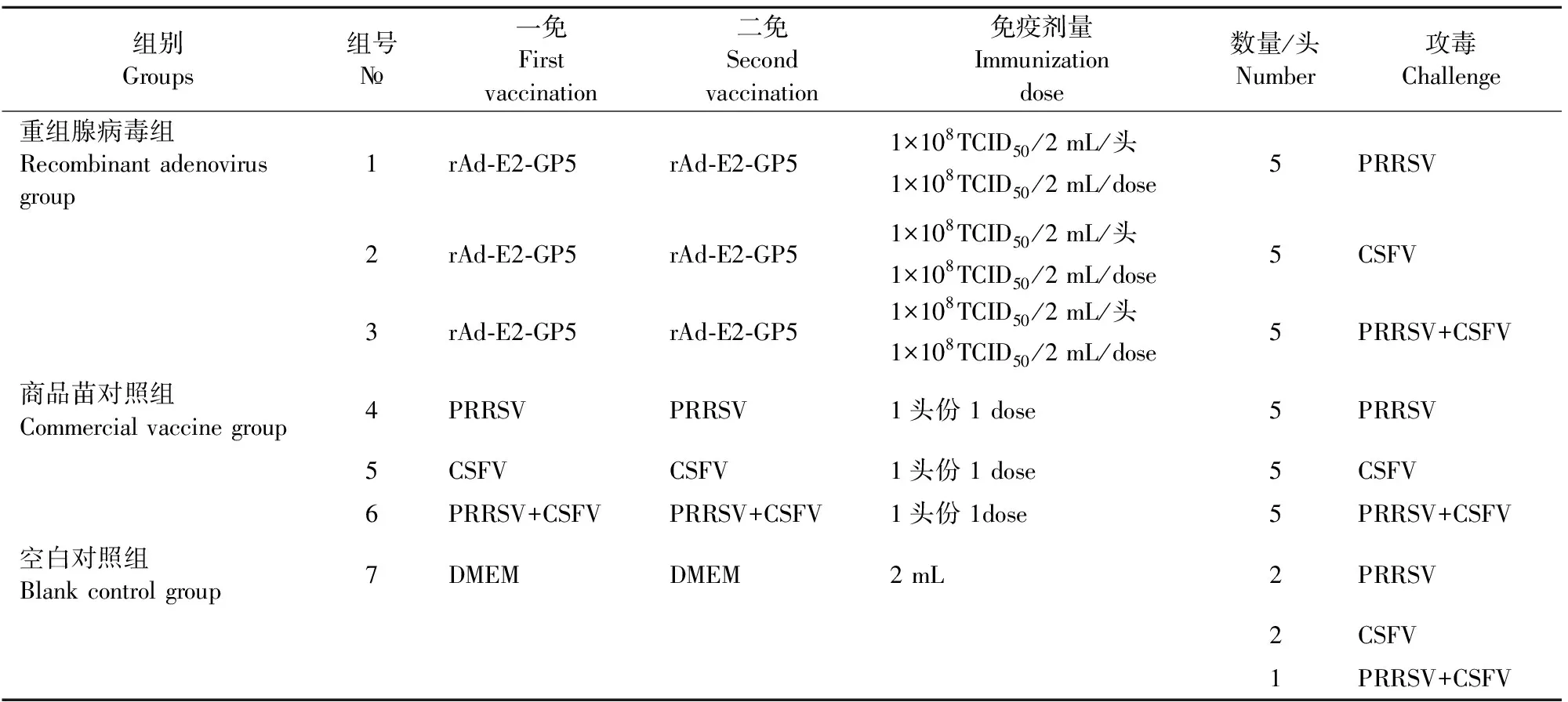
表1 试验设计
2 结果
2.1 临床症状
1组(rAd-E2-GP5 1组)和3组(rAd-E2-GP5 3组)攻毒后均有4头临床发病,攻毒后第2天体温升高至41℃以上,精神沉郁,食欲减退甚至废绝,被毛无光泽,消瘦,全身发红,出现结膜炎,全身发红,气喘,部分猪有咳嗽、耳尖发绀、后肢站立不稳,在攻毒后第11~14天开始体温下降。每组均有1头精神状态良好,无临床表现。
2组(rAd-E2-GP5 2组)和5组(猪瘟脾淋苗组)整体试验猪精神状态良好,未出现异常。
4组(PRRSV减毒活疫苗免疫组)和6组(PRRSV减毒活疫苗+猪瘟脾淋苗免疫组)攻毒后均有1头临床发病,攻毒后第3天体温升高,超过41℃,精神沉郁,食欲减退,持续6 d~10 d后体温逐渐下降,后期呼吸困难、体表发红、精神萎靡。每组中的另外4头精神状态良好,无临床表现。
7组(空白对照组)高热稽留,出现典型的CSF和PRRS症状,攻毒后6 d~8 d全部死亡。
2.2 体温检测结果
攻毒后,商品苗对照组和重组腺病毒猪瘟攻毒组体温均在正常范围内,无显著差异(P>0.05);重组腺病毒猪蓝耳病攻毒组和同时攻猪瘟、猪蓝耳病组与商品苗对照组在攻毒后1 d体温升高至40℃以上,稽留不下,于攻毒后13 d降至正常值,但明显好于空白对照组,直肠温度变化见图1。
2.3 体重变化
免疫期间所有试验猪体重均成稳定上升趋势,无显著差异(P>0.05),攻毒后,重组腺病毒组单独攻CSFV组和脾淋苗对照组仍稳定上升,PRRSV减毒活疫苗组、PRRSV减毒活疫苗+猪瘟脾淋苗免疫组无差异,重组腺病毒PRRSV攻毒组、CSFV+PRRSV攻毒组和空白对照组体重下降(图2)。

图2 体重变化曲线
2.4 疫苗免疫和攻毒后猪抗体水平变化
从图3和图4可看出,商品苗对照组PRRSV特异性抗体在二免后21 d快速上升,攻毒后KQ值高达101.74;而重组腺病毒组在免疫期间PRRSV特异性抗体值为阴性,攻毒后稍有上升。重组腺病毒组一免后14 d、商品苗对照组一免后21 d,CSFV特异性抗体呈现逐渐上升趋势;而空白对照组均未检出抗PRRSV特异性抗体和抗CSFV特异性抗体。提示rAd-E2-GP5具有激发免疫猪产生针对CSFV的特异性抗体的作用,但不具有激发免疫猪产生针对PRRSV的特异性抗体的作用。
2.5 攻毒后组织PRRSV和CSFV核酸检测
结果表明,重组腺病毒组和商品苗对照组各组织中均未检测到CSFV,空白对照组攻CSFV的所有试验猪中检测到了CSFV。重组腺病毒组PRRSV、CSFV+PRRSV攻毒组4/5检测出PRRSV,PRRSV减毒活疫苗组和猪瘟脾淋苗+PRRSV减毒活疫苗免疫攻毒组1/5检测出PRRSV,空白对照组攻PRRSV的所有试验猪中检测到了PRRSV(表2、表3)。

图3 ELISA检测PRRSV抗体水平
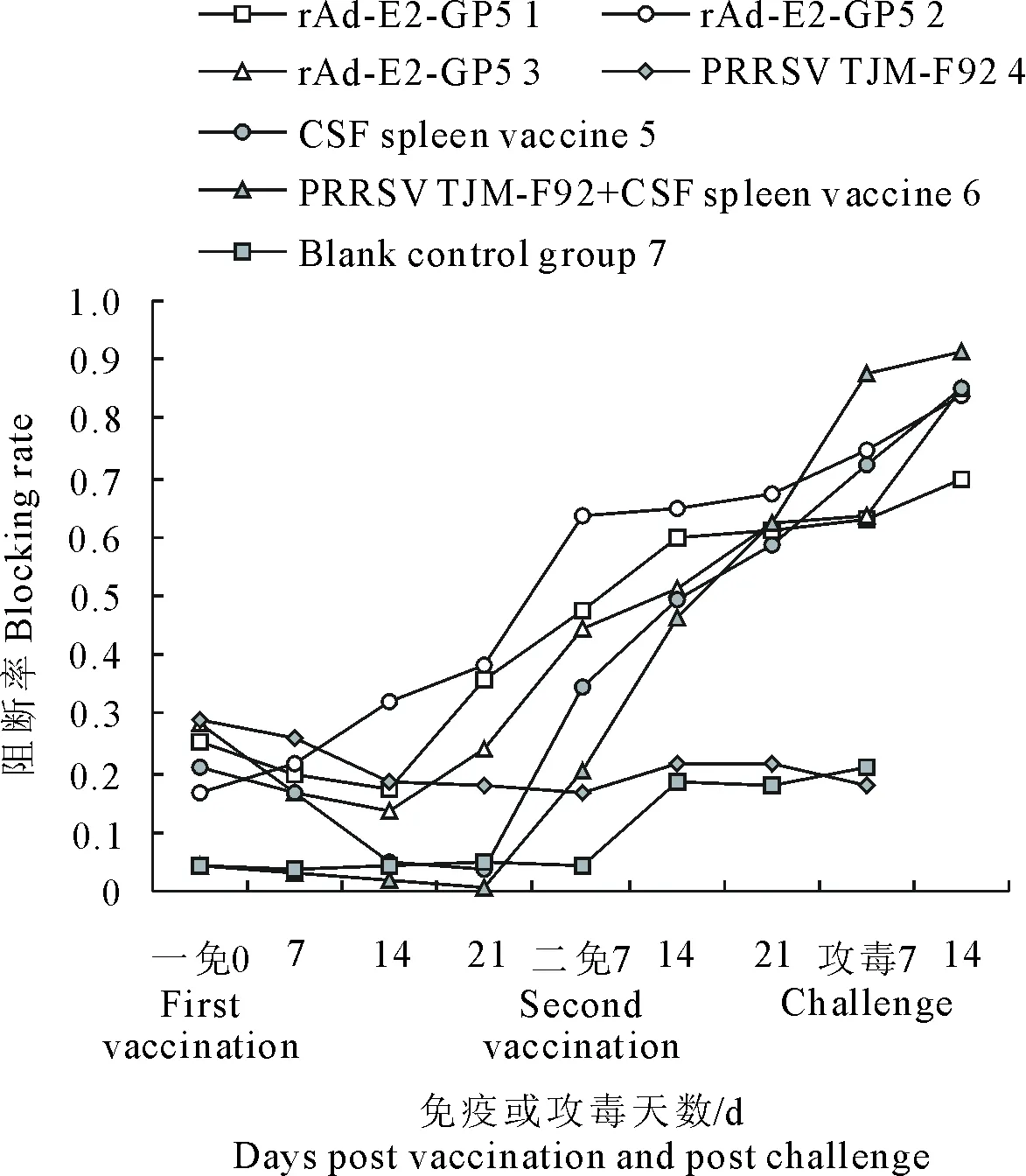
图4 ELISA检测CSFV抗体水平
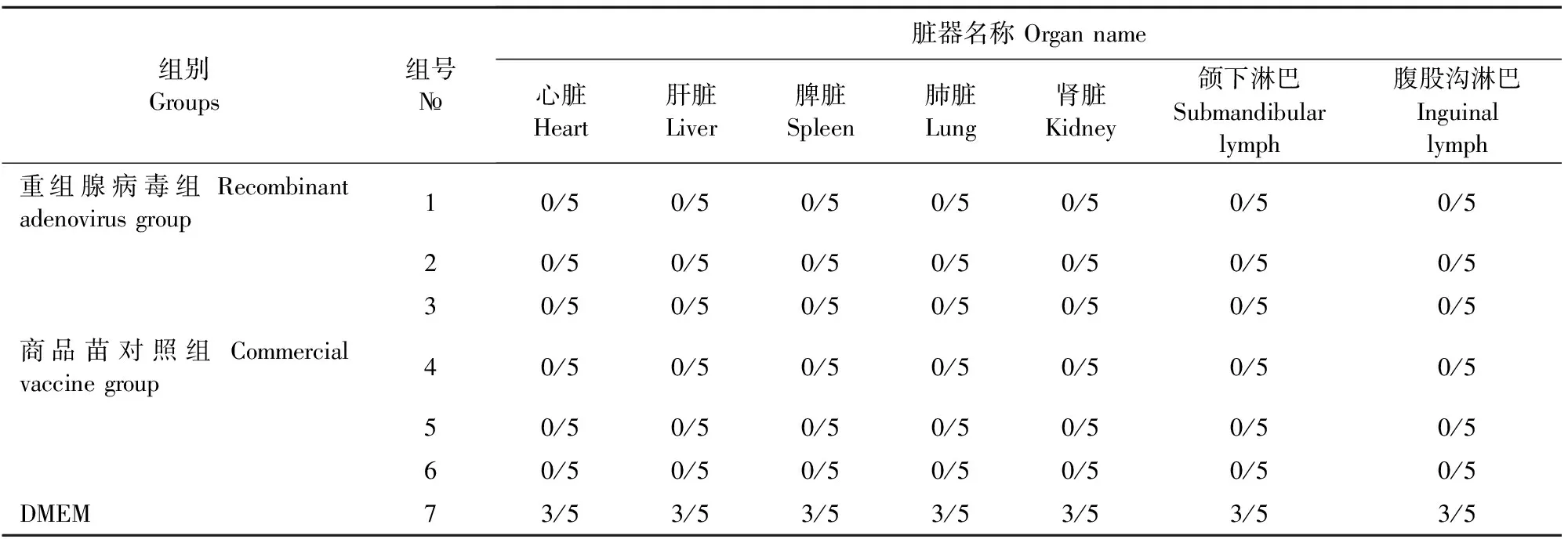
组别Groups组号№脏器名称 Organ name心脏Heart肝脏Liver脾脏Spleen肺脏Lung肾脏Kidney颌下淋巴Submandibular lymph腹股沟淋巴Inguinallymph重组腺病毒组 Recombinant adenovirus group10/50/50/50/50/50/50/520/50/50/50/50/50/50/530/50/50/50/50/50/50/5商品苗对照组 Commercial vaccine group40/50/50/50/50/50/50/550/50/50/50/50/50/50/560/50/50/50/50/50/50/5DMEM73/53/53/53/53/53/53/5
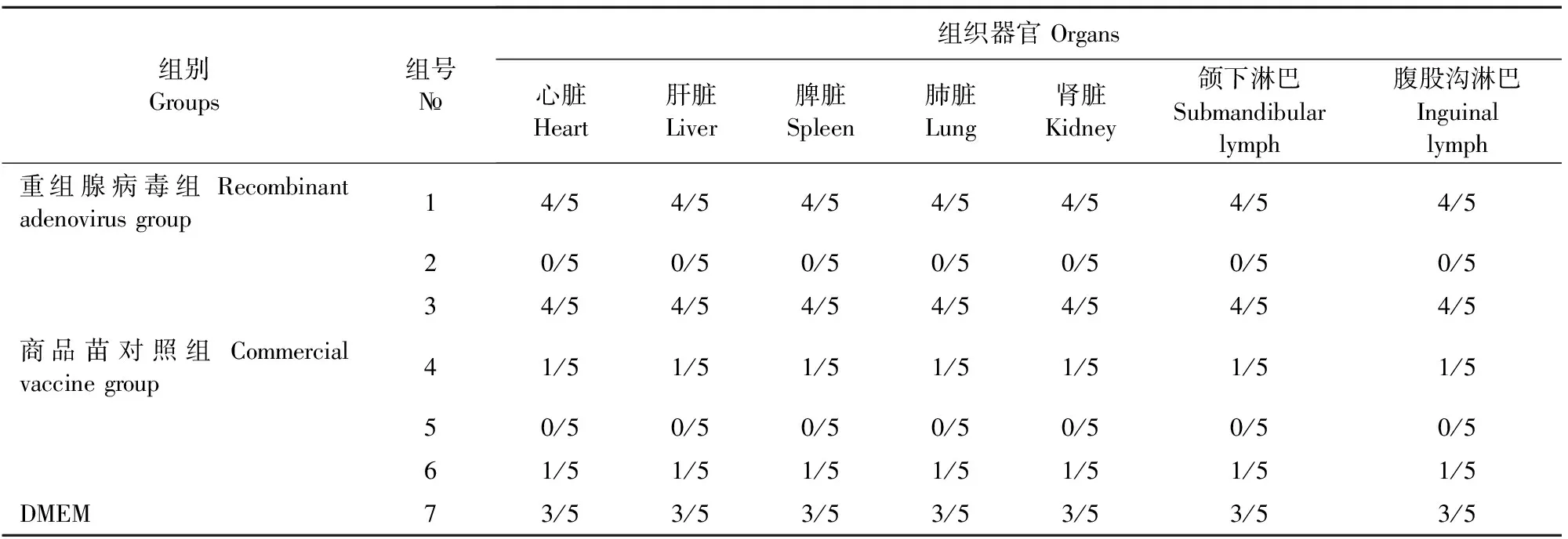
表3 猪繁殖与呼吸综合征病毒在各器官中RT-PCR的检测结果
2.6 病理剖检结果
1组(rAd-E2-GP5 1组)和3组(rAd-E2-GP5 3组)攻毒后5头均出现眼观病变:脾脏肿大,呈暗紫色,有出血点,边缘有梗死;肾脏有大小不一弥散性出血点,剖开肾乳头和肾盂有明显出血点;肺脏肿大,有淤血,呈肉变;淋巴结肿大;膀胱和胃有出血点。2组(rAd-E2-GP5 2组)2头、5组(猪瘟脾淋苗免疫组)3头,淋巴结肿大,膀胱、胃和脾脏边缘有出血点。其余未见异常。4组(PRRSV减毒活疫苗免疫组)3头、6组(PRRSV减毒活疫苗+猪瘟脾淋苗免疫组)4头有眼观病变,淋巴结肿大有出血点;肾脏有出血点;肺脏肿大,有出血点,有轻微炎性变化,少数有斑块状实变区。其余未见异常。7组(空白对照组)所有试验猪表现出典型的PRRS和CSF病理变化。
2.7 疫苗保护率
空白对照组在攻毒后6 d~8 d全部死亡,期间体温高热稽留,表现典型的PRRS和CFS症状,剖检组织病变严重;重组腺病毒组CSFV攻毒组和猪瘟脾淋苗对照组临床上均得到5/5保护,剖检分别2/5头、3/5头有眼观病变;重组腺病毒组PRRSV、PRRSV+CSFV攻毒组临床上1/5保护,剖检5/5头有眼观病变;商品苗对照组PRRSV、PRRSV+CSFV攻毒组临床上4/5保护,剖检分别4/5头、3/5头有眼观病变(表4)。
3 讨论
猪瘟和高致病性猪繁殖与呼吸综合征发病率和病死率都非常高,是危害我国养猪业的两大主要烈性传染病,均给养猪业造成极大的经济损失,疫苗免疫是控制这两种疫病的主要措施[11]。好的疫苗可以降低疫病的发生和疫病风险,保证养猪业正常健康的发展。但PRRSV和CSFV的免疫抑制性,多次抓猪引起的应激反应等原因都会影响疫苗的免疫效果,导致免疫失败[12]。联苗的使用在动物疫病防控中越来越受到人们的重视。硕腾(上海)企业管理有限公司研发的高致病性猪繁殖与呼吸综合征、猪瘟二联活疫苗(TJM-F92株+C株)2016年在中国上市,实验室报告结合临床试验表明该疫苗安全性和保护性都较好[13]。

表4 攻毒保护率统计结果
高飞等基于高致病性PRRSV细胞致弱株HuN4-F112的反向遗传操作平台,将CSFV强毒株的E2基因插入PRRSV基因组ORF1b和ORF2之间,构建的重组病毒rPRRSV-E2免疫仔猪后无临床表现,能够诱导机体产生针对PRRSV的抗体和高水平的CSFV的中和抗体[14]。研究表明,联苗的使用可以突破临床上两种病毒疫苗同时使用所造成的相互影响,减少免疫次数,达到“一针防两病”的效果。
本研究结合前人研究的载体基础[15],将CSFV和PRRSV的主要保护性基因串联,构建了重组腺病毒rAd-E2-GP5。本试验的猪体免疫攻毒保护试验结果显示,重组腺病毒组CSFV攻毒组和脾淋苗对照组攻毒后体重稳定上升,体温正常,无临床表现,剖检后组织中未检测到CSFV核酸,说明rAd-E2-GP5在猪免疫攻毒保护试验中起到保护作用(5/5)。重组腺病毒组PRRSV、PRRSV+CSFV攻毒组攻毒后出现高热(4/5),对应猪表现临床症状(4/5),用RT-PCR检测到对应猪PRRSV阳性(4/5),说明rAd-E2-GP5在猪免疫攻毒保护试验中起到一定的保护作用(1/5)。ELISA检测抗体水平,重组腺病毒组在免疫期间PRRSV抗体值为阴性,在攻毒后才上升,与商品苗对照组有明显差异(P<0.05),CSFV抗体一免后14 d开始稳定上升,与脾淋苗对照组无显著差异(P>0.05),说明重组腺病毒免疫猪体后能高效诱导机体产生CSFV特异性体液免疫应答,但不能有效诱导PRRSV特异性体液免疫应答。在剖检中发现部分未表现临床症状的猪只内脏器官也出现了轻微眼观病变,这可能是攻毒剂量太大和攻毒力太强导致的。从本试验结果来看,rAd-E2-GP5能保护致死量的CSFV、PRRSV、CSFV+PRRSV强毒的攻击,但大部分猪有临床症状和病理变化,在后续研究中,还需进一步加强重组疫苗对PRRS保护效果的研究,以期能研制出更好的CSFV、PRRSV重组二联苗。
