禽流感病毒H7亚型RT-exoRPA检测方法的建立
2018-12-05曹琛福黄超华林彦星花群义贾伟新
王 潇,曹琛福,黄超华,林彦星,花群义,贾伟新
(1.华南农业大学兽医学院,广东广州 510642;2.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518045)
禽流感是由禽流感病毒引起的一种急性、高度接触性的传染病。不同年龄、品种的家禽感染禽流感病毒后,会表现出不同的临床症状[1-2]。根据禽流感病毒毒力强度的不同可分为高致病性禽流感病毒和低致病性禽流感病毒,禽流感病毒H7亚型属于高致病性禽流感病毒。2013年,一种新的可感染人的禽流感病毒H7N9在我国长江三角洲地区暴发。自禽流感病毒H7N9暴发以来,禽流病毒感染导致人死亡的案例越来越多,对我国养禽业的发展和社会的安定造成了极大的危害[3]。2017年,我国因感染禽流感病毒H7N9死亡的人数又急剧上升,再次引起了大家的关注。因此,建立一种快速检测禽流感病毒H7亚型的方法对我国养禽业及公共卫生事业具有重要意义。
目前常用病毒分离法和PCR方法检测禽流感病毒H7亚型,但是这些方法无法运用于现场检测,同时操作复杂,且耗时长。2006年,Piepenburg O等[4-6]报道了重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术,该技术操作简单且快速,在37℃~42℃恒温条件下,20 min即能完成核酸的扩增,得到检测结果。英国TwistDx公司开发出了商品化试剂盒,反应酶是以冻干粉形式储存,促进了重组酶聚合酶扩增技术进一步发展,实现现场快速检测。本试验通过选取禽流感病毒H7亚型的HA基因保守序列为靶标,建立检测禽流感病毒H7亚型的RT-exoRPA检测方法。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂 荧光定量PCR仪,ABI公司产品;超微量核酸蛋白浓度分析仪,BioDrop公司产品;磁珠法核酸提取纯化系统,病毒RNA抽提试剂盒MagMAX-96 Viral RNA Isolation Kit(AM1836),Thermo Fisher Scientific公司产品;T16-ISO等温扩增荧光检测仪,TwistAmpTM EXO试剂盒,TwistDx公司产品;实时荧光PCR反应母液,Ambion公司产品。
1.1.2 样品 禽流感病毒H1亚型、H3亚型、H4亚型、H5亚型、H7亚型、H9亚型和H11亚型,新城疫病毒均为灭活病毒,35份临床样品均来自华南农业大学兽医学院禽病研究室。
1.2 方法
1.2.1 引物探针的设计与合成 选用最近流行的禽流感病毒H7亚型毒株的HA基因保守序列,根据RPA要求设计多对引物和探针,在HA基因保守区段自主设计多对引物及探针,并经与NCBI数据库BLAST验证其特异性,由生工生物工程(上海)股份有限公司合成与标记,其中在IVP-exoRPA探针上需要作如下标记:第32个碱基修饰BHQ1-dT,第36个碱基修饰6-FAM-dT,第34个碱基替换为dSpacer,3′端修饰C3 Spacer。
1.2.2 病毒RNA的提取及浓度测定 按Thermo病毒RNA抽提试剂盒(MagMAX-96 Viral RNA Isolation Kit,AM1836)说明于全自动磁珠提取纯化系统上提取禽流感病毒H1亚型、H3亚型、H4亚型、H5亚型、H7亚型、H9亚型和H11亚型、新城疫病毒的核酸,利用超微量核酸蛋白浓度分析仪测定核酸浓度。
1.2.3 RT-exoRPA反应体系及反应条件 将29.5 μL溶解缓冲液(rehydration buffer),2.1 μL 10 μmol 的上、下游引物,0.6 μL 10 μmol的探针,13.2 μL模板及DEPC水,混匀后,加入TwistAmpTMexo试剂盒中装有白色固体冻干混合酶颗粒的RPA反应管中,最后再加入2.5 μL 280 mmol醋酸镁,共50 μL体系。将配置好的反应体系置于T16-ISO仪器中,在37℃~42℃反应5 min后,取出混匀后,重新放入T16-ISO仪器中继续反应15 min。同时在整个反应过程中收集FAM荧光。
1.2.4 最佳反应体系和反应条件的确定
1.2.4.1 最佳引物及探针的筛选 将多对上、下游引物及探针进行配对组合,配置反应体系,加入模板为同一禽流感病毒H7亚型核酸,进行特异性试验和灵敏性试验,筛选出最佳组合。
1.2.4.2 最佳反应温度的确定 将反应温度分别设置为37℃、38℃、39℃、40℃、41℃、42℃共6个不同温度进行试验,筛选出最佳的反应温度。
1.2.5 检测禽流感病毒H7亚型RT-exoRPA方法的特异性试验 按优化好的条件,以禽流感病毒H1亚型、H3亚型、H4亚型、H5亚型、H7亚型、H9亚型、H11亚型、新城疫病毒为模板,进行特异性扩增,检测其特异性。
1.2.6 检测禽流感病毒H7亚型RT-exoRPA方法的灵敏性试验 将禽流感病毒H7亚型核酸10倍倍比稀释后,用RT-exoRPA方法进行灵敏性试验并与实时荧光定量PCR方法进行比较,以新城疫病毒核酸为阴性对照。实时荧光定量PCR方法反应体系包括:2×RT-PCR buffer 12.5 μL,5×RT-PCR酶1 μL,上、下引物各1 μL,探针0.4 μL,最后加DEP水及模板至25 μL。引物及探针为采用国家标准《禽流感H7亚型荧光RT-PCR检测方法》(GB/T 19438.3-2004)推荐的核苷酸序列。反应程序:45℃ 10 min,1个循环;95℃ 10 min,1个循环;95℃ 15 s,60℃ 45 s(收集荧光FAM),40个循环。
1.2.7 临床试验 利用本文所建立检测方法对采自某家禽交易市场35份咽拭子样品进行检测,以H7亚型禽流感病毒核酸为阳性对照,新城疫病毒核酸为阴性对照,同时,用实时荧光RT-RPA方法对该批样品进行检测,比较两者的符合性。
2 结果
2.1 最佳反应体系和反应条件的确定
通过灵敏性试验和特异性试验对引物及探针进行筛选,最终确定最佳引物探针的核酸序列见表1。表格中IVP-exoRPA 探针修饰标记为:①第32个碱基修饰BHQ1-dT;②第36个碱基修饰6-FAM-dT;③第34个碱基替换为dSpacer;④3′端修饰C3 Spacer。用同一禽流感病毒H7亚型核酸作为模板进行试验,筛选最佳反应温度。试验结果表明将反应温度设置为40℃时,其荧光吸收值增长率最高,因此40℃为最佳反应温度。

表1 RT-exoRPA方法最佳引物及探针核苷酸序列
2.2 RT-exoRPA方法灵敏性结果
将禽流感病毒H7亚型进行10倍倍比稀释,即其核酸浓度为0.24 μg/mL至0.24×10-5μg/mL,分别用实时荧光定量PCR和RT-exoRPA两种检测方法进行灵敏性试验。 实时荧光定量PCR灵敏性试验检测结果显示(图1),有6条标准“S”曲线出现,其禽流感病毒H5亚型核酸浓度分别为:0.24、0.24×10-1、0.24×10-2、0.24×10-3、0.24×10-4、0.24×10-5μg/mL,对应的CT值分别为:19.2、23.0、27.2、30.2、34.0、37.3 。根据试剂盒中阴阳性判定标准:当CT<35,并出现标准“S”曲线时判为阳性,当CT≥35时判为阴性。因此在本次试验中实时荧光定量PCR方法最低可检测到核酸浓度为0.24×10-4μg/mL。RT-exoRPA灵敏性试验检测结果显示(图2),样品浓度为0.24、0.24×10-1、0.24×10-2、0.24×10-3μg/m时,出现核酸扩增曲线,因此,在本次试验中RT-exoRPA方法最低可检测到核酸浓度为0.24×10-3μg/mL。结果表明RT-exoRPA方法灵敏性比实时荧光定量PCR方法低一个数量级。但RT-exoRPA方法检测时间只需要20 min,在5 min可观察到扩增曲线,而实时荧光定量PCR方法检测时间为88 min,因此RT-exoRPA方法更为快速。
2.3 RT-exoRPA方法特异性结果
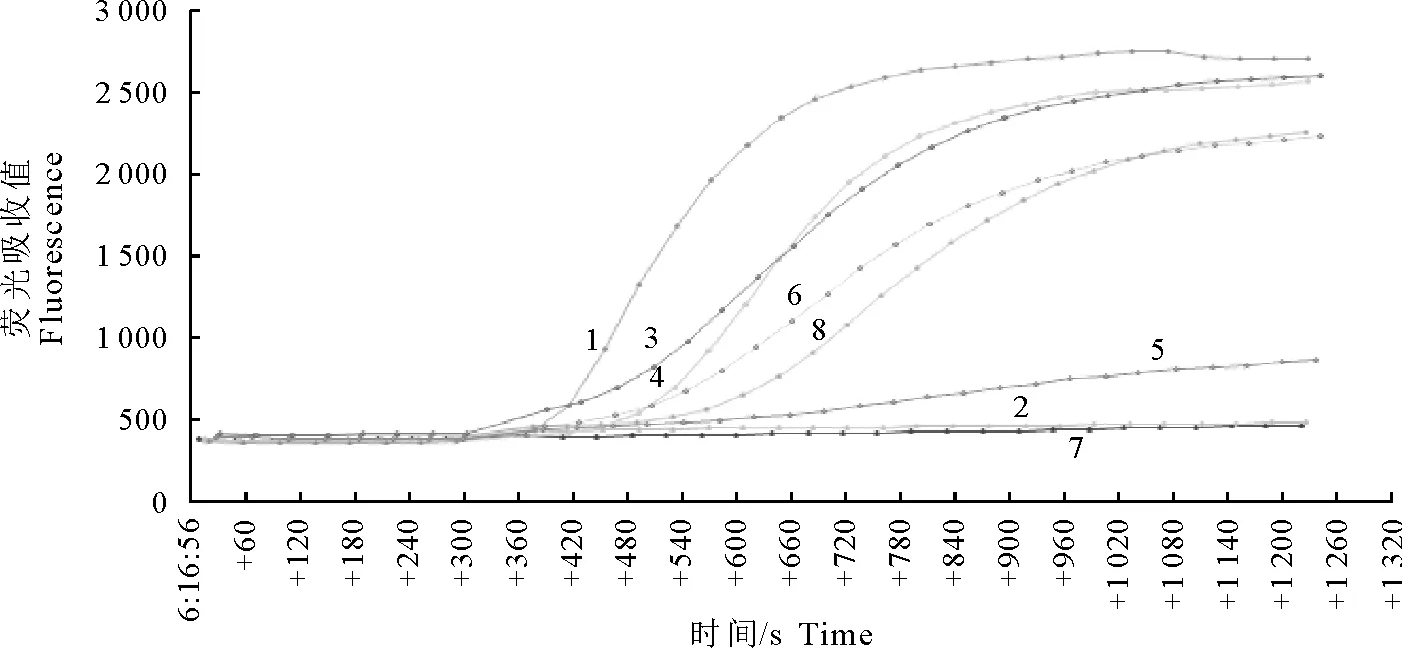
按优化好的条件,验证该方法的特异性。结果显示(图3),只有禽流感病毒H7亚型样品出现扩增曲线,而其样品均无扩增曲线。因此本文建立的检测禽流感病毒H7亚型RT-exoRPA检测方法特异性强。
2.4 临床样品检测结果
将35份田间样品提取核酸后,按本文建立的RT-exoRPA检测方法和实时荧光定量PCR方法分别进行检测,RT-exoRPA方法检测结果(图4~图9)显示,有10份样品为阳性,其余25份样品为阴性,与实时荧光定量PCR方法检测结果一致,表明两种方法符合率100%。

1~6.禽流感病毒H7亚型核酸浓度分别为0.24、0.24×10-1、0.24×10-2、0.24×10-3、0.24×10-4、0.24×10-5μg/mL;7.阴性对照
1-6.H7 subtype avian influenza virus nucleic acid concentrations 0.24,0.24×10-1,0.24×10-2,0.24×10-3,0.24×10-4,0.24×10-5μg/mL;7.Negative control
图1实时荧光定量PCR方法检测结果
Fig.1 Detection results of real-time PCR method

1~6.禽流感病毒H7亚型核酸浓度分别为 0.24、0.24×10-1、0.24×10-2、0.24×10-3、0.24×10-4、0.24×10-5μg/mL;7.阴性对照
1-6.H7 subtype avian influenza virus nucleic acid concentrations:0.24,0.24×10-1,0.24×10-2,0.24×10-3,0.24×10-4,0.24×10-5μg/mL;7.Negative control
图2 RT-exoRPA方法检测结果
Fig.2 Detection results of RT-exoRPA method
3 讨论
禽流感一直威胁着我国养禽业的发展,特别是高致病性禽流感更是造成我国大批家禽死亡,如今部分禽流感亚型甚至已经威胁到了人类的健康,影响到了社会的安定。当前我国H7亚型禽流感流行毒株复杂多样,给我国养禽业疫病的防控带来了挑战[7]。若能做到早发现、早诊断、早控制,则可有效阻止疫病的传播以及减少经济损失。

1.禽流感病毒H1亚型;2.禽流感病毒H3亚型;3.禽流感病毒H4亚型;4.禽流感病毒H5亚型;5.禽流感病毒H7亚型;6.禽流感病毒H9亚型;7.禽流感病毒H11亚型;8.新城疫病毒
1.H1 subtype avian influenza virus;2.H3 subtype avian influenza virus;3.H4 subtype avian influenza virus;4.H5 subtype avian influenza virus;5.H7 subtype avian influenza virus;6.H9 subtype avian influenza virus;7.H11 subtype avian influenza virus;8.Newcastle disease virus
图3 RT-exoRPA检测特异性结果
Fig.3 Specificity detection results of RT-exoRPA method

1~6.待检样品1号~6号;7.阴性对照;8.阳性对照1-6.Samples 1-6;7.Negative control;8.Positive control
1~6.待检样品7号~12号;7.阴性对照;8.阳性对照1-6.Samples 7-12;7.Negative control;8.Positive control

1~6.待检样品13号~18号;7.阴性对照;8.阳性对照1-6.Samples 13-18;7.Negative control;8.Positive control

1~6.待检样品19号~24号;7.阴性对照;8.阳性对照1-6.Samples 19 -24;7.Negative control;8.Positive control

1~6.待检样品25号~30号;7.阴性对照;8.阳性对照1-6.Samples 25-30;7.Negative control;8.Positive control
目前诊断禽流感病毒H7亚型的方法很多,实验室常用病毒分离法诊断禽流感病毒H7亚型,但是该方法耗时长;普通RT-PCR方法和实时荧光定量PCR方法,依赖温度变化才能扩增,不适合现场诊断[8];RT-PLAMP方法,虽在恒温条件下即可扩增,但该方法引物设计复杂,且需要多对[9]。因此,建立一种简单、快速检测禽流感病毒H7亚型的方法具有重要的公共卫生学意义。
RPA一种新型的恒温扩展核酸检测方法,其工作原理是模仿机体内核酸复制机制,通过一些特殊的重组蛋白(酶),让DNA双螺旋解链后,又通过帮助聚合酶复制DNA达到扩增的目的[10]。

1~5.待检样品31号~35号;6.阴性对照;7.阳性对照1-5.Samples 31-35;6.Negative control;7.Positive control
由于RPA技术克服了实时荧光定量PCR依赖变温才能得到扩增的特点以及具有操作简单、反应快速,且反应酶可以干粉形式保存[9]等特点。自2006年,RPA技术问世以来,该技术先已广泛应用于各个领域[12-15]。
本文根据禽流感病毒H7亚型HA基因保守序列,设计多对引物探针,通过筛选后构建了快速检测禽流感病毒H7亚型RT-exoRPA方法,并对其特异性和灵敏性也进行了验证,结果表明,该方法具有简便、快速、特异、灵敏等特点。在灵敏性试验中,RT-exoRPA方法的灵敏性比实时荧光定量PCR方法相差一个数量级,可能与RT-exoRPA在扩增体系中一些蛋白酶的干扰所产生[16],也可能与设计的引物探针不够灵敏有关。相信在RPA检测技术的不断研究中,这些问题能得到改善,将RPA检测方法更好地运用于现场快速检测中。
