利用本土资源 提升学科价值
——以“氯化钠的制取和用途”为例
2018-12-05韦艳蓉
□韦艳蓉
(常州市金坛区华罗庚实验学校,江苏金坛 213200)
工业流程题由于其体现了真实有用的化学,在近年的中考中成了一道靓丽的风景线;又由于其情境新、融合大、考查广等特点成了广大学生的心头之痛,而教师们普遍采取一遍又一遍做题讲题的方法来应对。
全市公开课上,笔者精心设计,以“氯化钠的制取和用途”为线索,带领学生进行了化工流程题的专题复习。听课老师感慨化工流程题除了做、讲,竟然可以这样化难为易!现整理出来与同行共同学习。
一、主要教学环节
(一)氯化钠的制取
引入:国家4A级景区“东方盐湖城”,因“亚州最大盐都”——金坛盐矿而得名,这里的盐就是“氯化钠”。
介绍:我国食盐来源广泛、蕴藏丰富,按来源可分为海盐、井盐、湖盐和矿盐四种。
问题:如何从海水中获得NaCl?
展示:海水制盐视频
问题:通过海水晾晒可得粗盐,2018年5月18日,常州市进行了中考化学实验操作考查。其中有一个考查项目就是“粗盐的提纯”,请将主要操作填在图1中。学生顺利填图如图2。

图1 粗盐的提纯流程图

图2 学生“粗盐的提纯”流程图
分析:得到的精盐还不是纯净物,里面还含有可溶性的杂质。
【制取1】海盐制取
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有 MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图3。

图3 制备精盐实验方案
(1)第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________。
(2)第②步操作的目的是除去粗盐中的___________(填化学式,下同)。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、__________。
(4)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是___________。
(5)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒?_______,理由是___________。
(6)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是__________。
解析:找出流程图中与我们所填图的不同之处并圈出来,写出化学方程式。学生圈出②③④⑥并写出各化学方程式。
②BaCl2+Na2SO4=BaSO4↓+2NaCl
③2NaOH+MgCl2=Mg(OH)2↓+2NaCl
④Na2CO3+CaCl2=CaCO3↓ +2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl
⑥2HCl+Na2CO3=2NaCl+H2O+CO2↑;HCl+NaOH=NaCl+H2O
写出主要反应后,其余的①⑤⑦即实验操作考查中的物理处理步骤,问题轻松解决。
答案:(1)搅拌,加速溶解;(2)Na2SO4;(3)CaCO3、BaCO3;(4)除去过量的 Na2CO3、NaOH;(5)不可以,若颠倒则不能除去过量的BaCl2;(6)会生成新的杂质KCl。
整理与归纳:解读流程题需理解并认识元素化合物的性质,写出重要步骤的化学反应方程式。
【制取2】矿盐制取
金坛区地下盐矿储量丰富,被誉为“亚洲最大盐都”的金坛岩盐矿位于境内西北部直溪、茅麓、薛埠3个镇范围内的丘陵地区,盐矿总面积达60.5平方公里,矿石储量为162.42亿吨,相当于两个半太湖的水重量,矿体品位高,厚度大,夹层少,全矿平均氯化钠含量达85%左右。同时埋藏深度在808.6~1236.84米之间,比较适中,岩盐层稳定厚度为143.66~237.32米,最大单层厚度为52.91米。作为公认的东部地区条件最好、综合指标最佳的大型岩盐矿床,金坛盐矿目前年开采量为60多万吨。开采食盐的方法是先在地上钻孔至盐层,再把高压水打进盐层,便能得到饱和食盐水。日产量可供200万人吃上一个月。开采过的矿井留下了硕大的封闭性好、能耐高压的穴腔。国家已将其作为“西气东输”工程的调峰储气库,这个储气库的日储气量将达到6.7×108m3。
矿盐制取的流程可简单表示如图4。

图4 矿盐制取流程
整理与归纳:化工流程题需关注流程中的基本操作。
【制取3】湖盐制取
(2013济南中考改编)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线图(如图5),说出这句谚语的原理是什么?

图5 Na2CO3和NaCl溶解度曲线图
盐湖获得的NaCl中含有少量Na2CO3,某兴趣小组的同学开展了测定湖盐中NaCl质量分数的探究实验,如图6。

图6 测定湖盐中NaCl质量分数
(1)操作1的名称是___________,M中溶质是___________(填化学式)。
(2)滴加CaCl2溶液应“过量”,否则会使测定的结果___________(填“偏大”或“偏小”)。
(3)该混合物中NaCl质量分数是多少?(写出解题过程,计算精确到0.1%)
解析:因为Na2CO3的溶解度随温度升高而增大,而NaCl的溶解度受温度影响较小;冬天气温较低温差较大,故析出的是Na2CO3晶体;而夏天气温高,当蒸发溶剂时,析出的主要是NaCl。
(1)过滤,NaCl和CaCl2。(2)偏大。(3)89.4%
整理与归纳:化工流程题既有定性问题,也有定量问题。
(二)氯化钠的用途
【用途1】氯碱工业
(2011无锡中考改编)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量 MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如图7,该流程中可以循环利用的物质是什么?
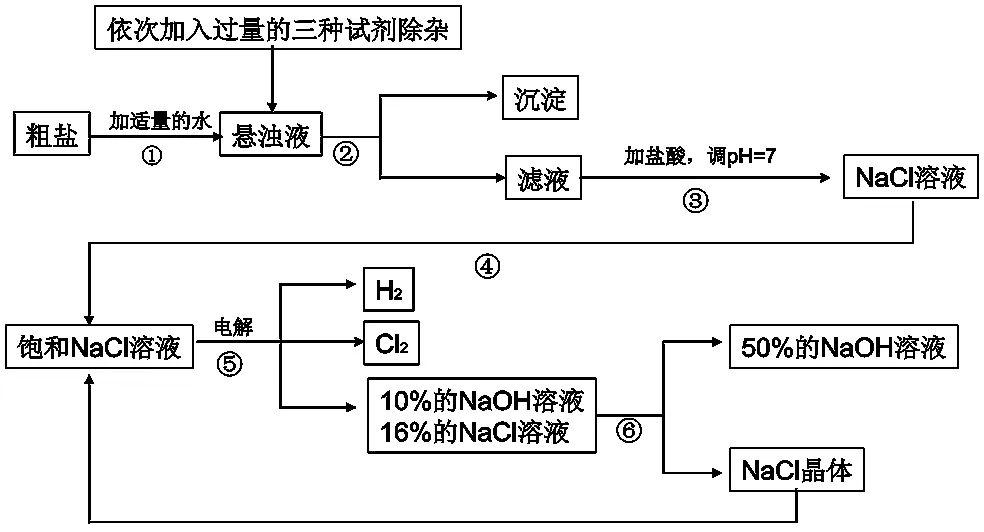
图7 “氯碱工业”流程
解析:“氯碱工业”流程看起来比较复杂,其实可以看作两部分,其中一部分是对原料“氯化钠”的提纯。见图8。余下的部分类似于一道简单的框图转化题。

图8 对原料“氯化钠”的提纯
流程图中箭头指向的是生成物(包括主产物和副产物),返回的箭头一般是被“循环利用的物质”,该流程中可以循环利用的物质是NaCl。
【用途2】制取金属钠
【用途3】侯氏制碱法
1926年,我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱。图9是海水“制碱”的部分简单流程。根据信息回答下列问题。
资料:2NH4Cl+X=2NH3↑+CaCl2+2H2O

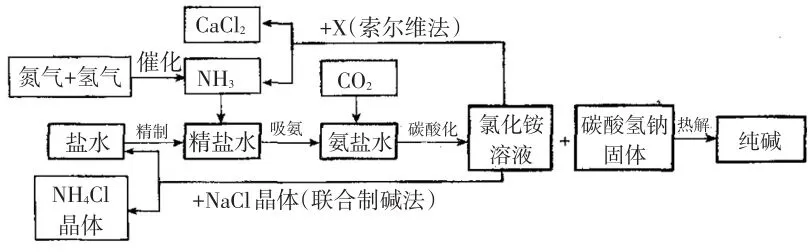
图9 海水“制碱”的部分简单流程
(1)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”.即在氯化铵溶液中加入物质X________,产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体,降低了氯化铵的________,使氯化铵晶体单独析出得到另一种产品——氮肥.氯化钠溶液则可以循环利用,
(2)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?答:__________。
(3)海水制碳酸氢钠反应的化学方程式为:__________________________。
(4)制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为___________________。
(5)试从绿色化学的角度简述侯氏制碱法的优点________________________。
解析:纯碱由碳酸氢钠热解制得,碳酸氢钠是中间产物。圈出本流程最核心的反应,如图10,即NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,NH4Cl是副产物。核心反应的其余部分就是对氯化铵溶液的两种处理工艺。

图10 对原料“氯化钠”的提纯
答案:(1)Ca(OH)2、溶解度;(2)防止氯化铵受热分解;(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(4)氨气通入水中形成碱性溶液有利于二氧化碳的吸收;(5)副产物氯化铵可以循环利用,节约资源。
整理与归纳:书写核心反应要考虑质量守恒定律,注意定量问题。
二、认识化工流程题
化学工业流程题就是模拟、简化真实工业流程形成简洁的流程图形式,根据化学课程标准和考试说明要求,设计出符合学生认知的系列化学问题的一类试题[1]。
化学工艺流程一般可划分为前期的原料预处理、中期的核心反应和后期的产品分离提纯三个阶段,整个流程都需要控制反应条件为获取产品服务。分析流程图的规律是:主线主产品,分支副产品,回头为循环(如图11所示)[2]。

图11 流程图的规律
工业流程题常见考点:①生产的目的、设计的原理、生产流程的作用等;②化学反应条件控制的原理;③实验基本操作;④资源的回收和利用;⑤“绿色化学”生产、环境保护等。
学习建议:对于元素化合物及其转化内容的学习,一要重视应用化学反应原理去理解认识元素化合物的性质及应用;二要认识实现物质转化的反应和条件;三要将物质的转化与应用的知识与新情境问题相结合,做好以下几方面:(1)学会获取信息,如物质转化流程、图表等提供的信息,理解物质转化的全过程;(2)将已有知识与新情境知识相融合;(3)分析在特定情境条件下物质转化的原理和方法;(4)用规范的化学语言表示结果。
三、评价教学设计
(一)素材真,体现情境之美
开发本土化学教学资源,让学生真切体会到化学就在身边。从风景怡人的“东方盐湖城”入手展开对氯化钠制备和用途的研究。
工业流程如何选题?命题者以真实的化学工业生产为背景,从一个物质出发,以氯化钠为主线,以氯化钠的制备、用途分别设计工业流程。从三种制备方法说起,到氯化钠的三种应用。制备应用流程虽然复杂,但精选与初中知识紧密联系部分。通过对该工业流程背景的简化,再进行简约表述,编制成适合学生阅读的化学问题。充分体现了化学知识的应用性,让学生体会学有所用,充分认识“化学与人类的生产和生活密切相关,化学也正以其特有的价值影响或改变着人类的生产、生活和生存环境”。
(二)问题巧,体现探究之美
在工业流程专题上从学生角度出发进行了深入思考,将工业流程与学生实验考查的内容相结合,让学生在既有知识的基础上,对工业流程题有了更深的解读。从课堂状态观察,有了老师对工业流程题的解法指导,学生们对这类题目不再一头雾水,毫无头绪,而是有了质的提高和升华。
(三)活动实,体现思辨之美
如何写出核心的化学反应?它不仅是学习内容上的深度,而且能引发学生进行深度的思维,促进了学生的“深度学习”。
(四)构建好,体现逻辑之美
知识重构,迁移运用。氯化钠是本节课的明线,在深层次上还有一条解决化工流程题的思想方法上的暗线贯穿始终。几个例题下来在学生脑中形成了清晰完整的知识网络,构建思维导图,如图12所示。

图12 构建流程思维导图
(五)感悟多,体现创造之美
通过以氯化钠为线索,以源自生产生活的事实为背景的教学,既有主题的分析和拓展,又有题型的归纳和方法的提炼。在不知不觉中让学生正确理解到知识与社会发展的关系,感受到了化学工艺的魅力,感悟化学工艺在提高人们美好生活方面的价值[3]。
化学学习不是纸上谈兵,让学生认识“化学致力于利用自然资源、服务于生产和生活”的学科价值,以真实的工业生产作为背景的化工流程题是中考考试的趋势和必然。这对缺乏生活经验的学生而言,陌生度大,难度较大,但是只要我们能够探究命题特点,把握复习方向,精心设计,努力以教法引导学生学法的改变,定能化难为易。
