植物线粒体抗氧化应激效应影响的研究进展
2018-12-05曾德永关双红刘梦瑶孙野青卢卫红
曾德永, 崔 杰, 张 萌, 关双红, 高 鑫, 山 珊, 刘梦瑶, 孙野青, 卢卫红
(1.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨 150000; 2.大连海事大学环境科学与工程学院,辽宁大连 116026; 3.哈尔滨工业大学生命科学与技术学院,黑龙江哈尔滨 150000)
线粒体是真核细胞重要的细胞器,在细胞的能量代谢[1]、生物合成和细胞死亡[2](包括细胞凋亡和细胞程序性坏死)等过程中起关键的调控作用。此外,线粒体还参与三羧酸循环、交替氧化、脂肪酸和氨基酸氧化、钙离子稳态调节等重要的生理过程[3]。线粒体在维持生命稳态中发挥重要作用,因而当机体受到生物胁迫和非生物胁迫时代谢调控网络会发生改变,例如三羧酸循环、交替氧化、氧化磷酸化途径等,并伴随有活性氧(ROS)生成。本文主要讨论当植物受到外界胁迫时,线粒体所表现出来的功能障碍和抗氧化应激的主要途径。
1 线粒体
1.1 线粒体结构
线粒体为细胞提供了90%的能量,在植物细胞中,约有1%线粒体耗费的氧气用于ROS的合成[4]。线粒体具有双层膜结构,因此线粒体中有3个空间:线粒体膜外、膜间隙和膜内。内膜向内突出形成嵴,在脂双层膜上,大量呼吸作用相关的酶和蛋白分子都存在于内膜和基质中,而物质转运的蛋白质载体和通道则在外膜上。线粒体主要进行能量合成、物质代谢,是整个细胞乃至生命体进行生命活动的核心枢纽。此外,线粒体还参与细胞信号传导[5]。线粒体的这些生理功能主要是通过调节能量代谢和ROS的生成来实现,线粒体通过操纵生物能学、氧化还原平衡、通透性转换(MPT)等因素来调控细胞的生死[6]。
电子传递链是线粒体中不可缺少的组成部分,是一系列电子载体按对电子亲和力逐渐升高的顺序组成的电子传递系统。所有组成成分位于线粒体内膜上,而且按顺序分段组成分离的复合物,在复合物内各载体成分的物理排列也符合电子流动的方向。其中线粒体中的电子传递链伴随着营养物质的氧化放能,又称作呼吸链,主要由5个部分组成,分别为复合物Ⅰ泛醌氧化还原酶(NADH:ubiquinone oxidoreductase)、复合物Ⅱ称琥珀酸泛醌氧化还原酶(SDH:ubiquinone oxidoreductase))、复合物Ⅲ细胞色素c氧化还原酶(Cyt:cytochrome C-oxidoreductas)、复合物Ⅳ细胞色素氧化酶(Cox:cytochrome oxidase)构成。这些大分子复合物中包含许多参与线粒体功能的小分子蛋白,当受到外界条件胁迫时,其功能很容易受到损伤。在动物中抑制NADH基因会使动物致死,但在植物中抑制NADH基因不会使植物致死,通过改变植物中线粒体编码复合物Ⅰ亚基的基因表达,植物会表现出如发芽缺陷,生长迟缓,发育缺陷以及对激素或胁迫的反应改变[7-9]。植物复合物Ⅰ突变体已被广泛用于研究复杂的Ⅰ结构、呼吸可塑性和代谢适应等[10-11]。复合Ⅱ耗竭增加植物中配子体致死率[12],而复合物Ⅲ和Ⅳ的缺失则会使植物致死[13]。已有研究表明,线粒体复合物Ⅱ的功能紊乱与受辐射细胞的后代基因组不稳定现象密切相关[14]。
植物线粒体内除了细胞色素主路外还有抗氰交替途径支路存在。抗氰呼吸(交替途径)指的是对氰化物不敏感的一条呼吸途径。主要调节植物在逆环境中的生长发育,使植物适应环境胁迫[15]。
1.2 不同组织植物线粒体组成的变化
为了响应植物细胞代谢和能量需求的变化,线粒体通常通过改变呼吸链中关键蛋白质的组成和丰度来改变其形态和呼吸能力。在这种方式下,线粒体被调整以满足不同组织类型的能量需要或者响应于特定的环境。在植物突变体的研究中已经观察到线粒体在转录水平和稳态方面的差异以及在不同组织中功能均有所不同。
在近期的一些逆向遗传学研究中,编码线粒体蛋白的核基因突变会使植物器官产生特异性表型,包括通过PPR蛋白质缺失导致的植物延迟发育和开花[16-17],通过沉默线粒体复合物Ⅰ、Ⅱ或线粒体苹果酸脱氢酶改变叶形态和光合能力[18-19]。延胡索酸酶的抑制影响根系形态和呼吸速率并且其气孔功能也会受到抑制[20]。目前已经在转录水平上证明了一些核基因编码的线粒体呼吸成分共同调节植物各种营养和生殖器官[21]。对这些共同调节的基因进行启动子分析发现,这些基因中的启动子近端存在常见位点Ⅱ,该位点可以引导器官特异性分化、代谢、对环境响应和发育等[22]。对基因功能类别分析发现,复合物Ⅰ和Ⅴ在组成型中表达,而编码线粒体光呼吸机制和热休克蛋白的基因在植物组织上进行选择性表达[21]。虽然有很多试验表明组织中转录本丰度和蛋白质丰度/活性之间存在强相关性,但也存在许多特殊状况,特别是NAD-苹果酸酶(NAD-ME)、醛脱氢酶和硫氧还蛋白还原酶[23]。因此,基于单独的转录本数据差异来解释酶活性的组织特异性差异时,必须谨慎。
为了分析线粒体在植物发育过程中的特殊作用,对拟南芥中营养(细胞培养、根、芽)和繁殖(花粉、茎、花)发育阶段的线粒体蛋白质组进行了广泛的比较[23]。通过双向电泳,发现存在83个差异蛋白质,包括TCA循环、呼吸链中的酶以及依赖于来自这些代谢途径的中间体的关键酶。虽然电子传递链中单个亚单位的丰度通常在营养型组织中保持不变,然而呼吸能力则随该特定组织、细胞类型对底物的选择性和其对底物的可用性而改变[21]。测定蛋白质丰度的差异可以预测不同器官/细胞类型之间代谢通量的变化程度[24]。通过在一个预先设计的线粒体图上绘制这些代谢变化,可以精确定位这些由于组织特异化而变化的酶参与的步骤。营养器官/细胞的功能分析揭示了中枢碳代谢的特异性差异,芽线粒体在光呼吸时甘氨酸的分解中具有特殊的作用,细胞培养线粒体主要利用TCA循环中的柠檬酸和过氧化物酶体的β-氧化来驱动TCA循环和ATP形成的脱羧反应。而根线粒体具有较高的将2-氧戊二酸转化为延胡索酸的能力,用于通过复合物Ⅱ产生能量。生殖期器官的线粒体往往在TCA循环以外的代谢中具有特殊的作用,如维持花粉中线粒体的氧化还原环境以及茎中的氮(谷氨酸)代谢。这些线粒体的特异性通常与相应组织类型的主要生理作用相符。例如,芽中苹果酸脱氢酶的上调提供了其在调节氧化还原电位中作用的证据,这在光介导光合和呼吸作用中是至关重要的[18]。
大多数线粒体蛋白质组学研究都通过比较特定蛋白质的总丰度来关注特异性组织的基因转录调控和转录后对功能的影响。虽然蛋白质的丰度有时与其最大催化活性相关,但是由于某些线粒体蛋白质在不同组织中存在同种型丰度差异,因此这种关系不能应用于所有的酶[21,23]。例如,精氨酸酶的异构体1在营养器官中更高表达,而异构体2在生殖器官中表达更高[23]。当4种电压依赖性阴离子通道(VDAC)同种型中的某一种被破坏时,也观察到营养和生殖发育中同种型的特异性差异[25]。基因的表达在调节酶活性以及蛋白质修饰和酶复合物组装的代谢途径中也发挥关键作用。在双向电泳中观察到的一些被修饰的蛋白,特别是等电点发生位移的蛋白通常被认为是制备样品时引入的杂质。然而,在最近对来自不同器官、细胞类型的线粒体蛋白质组的研究中,发现TCA循环、ETC中的许多蛋白质,其组织特异性经过翻译修饰后,在不同的物种和组织中具有高度可重复性,表明这些变化不是随机的。而蛋白质翻译修饰后的差异对不同组织中线粒体代谢功能的影响尚待探讨。
1.3 线粒体活性氧
细胞中的ROS主要来源于线粒体,当ROS的清除机制失效时,线粒体的功能就会发生紊乱,当植物细胞暴露于高浓度的铀环境下时,ROS诱导的氧化酶(如脂肪氧合酶)被激活,对应的基因表达水平也会增高,抗氧化物质的调控和一些代谢活动也会发生改变[26]。线粒体电子传递链中发生电子泄漏是产生ROS的主要因素,在正常的呼吸过程中约有2%的电子发生泄漏[27]。长期以来,复合物Ⅰ和Ⅲ被认为是线粒体内活性氧(ROS)产生的主要来源,但是近来在哺乳动物和植物中的研究表明,复合物Ⅱ也可能是ROS的重要来源[28-29],复合物Ⅰ和Ⅲ中主要由O中心产生电子泄漏而产生ROS[30]。然而,复合物Ⅱ产生ROS的机理尚不清楚,并且在植物中线粒体复合物Ⅱ或其组装因子的敲除会导致植物死亡,从而在很大程度上阻止通过基因敲除的手段进行直接研究[12,31]。但随着研究的深入,该限制也发生了改变,当复合物Ⅱ中的SDH1-1(dsr1)发生突变时,复合物Ⅱ活性降低同时线粒体ROS含量增加[32]。复合物Ⅳ中不能直接产生ROS[30],ROS的产生在植物细胞的信号传导中发挥着重要作用[33],但高含量的ROS将会损伤细胞DNA、RNA、蛋白质和脂质,从而导致线粒功能紊乱[34]。很多研究表明,线粒中ROS会对植物细胞产生氧化损伤[35-36]。
1.4 氧化应激与线粒体功能
线粒体氧化应激能改变线粒体功能,如影响其参与的三羧酸循环,氨基酸代谢,氧化磷酸化过程[37-38]。三羧酸循环中的关键酶通常是辨别氧化应激是否发生的标志物[39]。氧化应激发生时,三羧酸关键酶[如丙酮酸脱氢酶(PDH)、柠檬酸合酶(CSY)、乌头酸酶(Aco)、NAD+依赖性异柠檬酸脱氢酶(IDH)、延胡索酸酶(FUM)和苹果酸脱氢酶(MDH)]的酶活性和酶基因的表达会发生不同程度的改变,但是改变方向却不同,同时氨基酸的含量降低,不过其具体机制尚不清楚[40-41]。
氧化应激发生时,氧化磷酸化途径中的复合物Ⅰ、复合物Ⅱ、复合物Ⅲ、复合物Ⅳ和ATP合成酶的基因表达量和活性会发生改变。同一复合物中不同亚基的基因在发生氧化应激时的表达量不同,并且在不同的植物组织中表达也不同[40],复合物Ⅰ中nda1、ndb2在氧化应激发生时表达量会增加。而在复合物Ⅱ中sdh1通常表现出对氧化应激敏感[42],同时发现SDH6和SDH7在氧化应激发生时对维持线粒体功能有重要作用[43]。COX是氧化磷酸化途径的末端氧化酶,负责将电子传递给受体。在氧化应激发生时COX亚基cox1、cox2、cox17的表达量会发生改变,并且COX17的调节因子AtCOX17对调节植物的氧化应激反应有重要的作用[44-45]。ATP合酶由很多亚基组成,其中由线粒体基因编码的亚基有ATP合酶F0亚基1、6、8,ATP合酶亚基β、γ、δ,ATP合酶亚基O等[46-47]。ATP合酶F0亚基通常会影响氧化应激反应[48]。
2 线粒体抗氧化应激的策略
植物抗氧化系统由许多酶和非酶抗氧化成分组成,与植物体内ROS生成途径一起维持ROS含量的动态平衡。很多研究已经表明抗氧化系统在维持植物体内ROS的稳态中有重要的作用。抗氧化酶系包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)等,主要作用是清除自由基。除此之外,植物体还可以通过其他途径来达到抗氧化损伤的目的,比如通过控制抗氧化酶系基因表达,或者改变体内其他抗氧化物,如改变抗坏血酸盐、谷胱甘肽浓度。
植物体内通常有3道防线用于其线粒体的抗氧化胁迫。第1道防线是防止ROS的产生,可采用维持可利用底物和ATP需求的平衡、AOX的活化、解偶联蛋白的活化等方法。第2道防线则是通过抗氧化酶系、谷胱甘肽还原系统、硫蛋白还原系统清除机体内多余的ROS。第3道防线则是通过切除修复DNA、二硫键的还原、修复蛋白等来修复ROS引起的损伤。
2.1 交替氧化途径
植物线粒体中有2种催化氧还原成水的末端氧化酶(图1)细胞色素(cyt)氧化酶(复合物Ⅳ)和交替氧化酶(AOX)[49],交替氧化途径可以起到电子分流的作用。有研究表明,丙酮酸可以刺激AOX与未饱和的细胞色素通路竞争电子,当主路中的复合物Ⅰ到复合物Ⅳ的活性受到抑制时,AOX的活性会升高数倍[50]。对AOX的电子流量进行生化控制,可以减少电子传递链产生ROS[51]。AOX分流电子的能力具有组织和发育的特异性[52],机体代谢发生紊乱时AOX分流电子能力通常会增加[53],在氧化应激发生时,aox1a基因的表达都会升高[54]。有研究表明,在AOX过量表达的细胞中ROS的量仅为对照细胞的一半,相反通过基因沉默技术减少AOX表达的细胞中的ROS的量是对照细胞的5倍,证明AOX可以降低氧化损伤的程度[55-56]。

2.2 解偶联蛋白(UCP)
UCP是线粒体载体蛋白质家族的成员,能使H+从线粒体内膜渗透到线粒体内,从而消除电子传递链中的电位差,导致氧化磷酸化途径受损,因此将其作为非磷酸化/解偶联呼吸途径的重点研究。UCP可以被ROS激活,表明UCP与AOX一样,可能会降低氧化损伤[57],后来的研究也证明了AOX与UCP共同构成了抵御氧化损伤的防御体系[58]。UCP(AtUCP1)基因进行敲除后,导致局部氧化应激,但不会影响植物承受大部分非生物胁迫的能力。然而,UCP的缺失却导致植物呼吸速率受阻,表明UCP1在叶中主要是维持线粒体电子传递链的氧化还原电位[59]。UCP能保护植物线粒体免受氧化损伤,维持植物细胞中的能量平衡。
2.3 植物中ROS清除剂
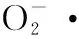

2.4 转录调节因子
转录因子(TF)是抗氧化应激反应的重要调控蛋白之一。它们在应激信号下游发挥着重要的作用,可以同时改变应激反应基因亚型的表达,增强植物对环境胁迫的适应性。AP2/ERF(APETALA2/乙烯应答因子)、锌指结构域(zinc finger)、WRKY、bZIP(碱性-亮氨酸拉链)和NAC(NAM、ATAF、CUC)家族成员在植物受到外界胁迫条件诱导下的氧化应激中具有调节作用[75-76]。
含有锌指结构域(zinc finger)的蛋白质作为调控ROS相关防御基因的关键参与者在拟南芥中已经被报道。在敲除AtAPX1基因的拟南芥中,锌指基因ZAT7、ZAT10、ZAT12的表达加重了拟南芥的氧化损伤[77],表明这些锌指基因参与调控ROS。C2H2锌指蛋白的ZFP36、ZFP1792种类型在调控水稻ROS平衡中发挥着重要作用。ZFP179基因过表达提高水稻中ROS清除能力和应激相关基因的表达水平,表现出显著增强抗氧化应激的作用[78]。ZFP36增强了水稻在由脱落酸(ABA)诱导的氧化应激中的耐受性。此外,ZFP36在ABA信号的传导中参与对NADPH氧化酶、H2O2和MAPK的调节[79]。OsTZF1是一种CCCH-串联锌指蛋白,是胁迫条件下水稻叶片衰老的负调控因子。同时,OsTZF1通过增强氧化还原稳态基因和ROS清除酶基因的表达来提高水稻的氧化应激效应[79]。在拟南芥中CCCH-串联型锌指基因GhTZF1通过介导ROS稳态参与调节由干旱胁迫诱导的氧化应激和叶片的衰老[80]。
WRKY家族蛋白具有1个或2个保守的WRKY结构域,其在N末端包含高度保守的WRKYGQK七肽,在C末端具有锌指状结构域。保守的WRKY结构域通过与目标基因的启动子区域中的W-box元件结合而在各种生理过程中起重要作用。研究表明,在由干旱和盐胁迫诱导的氧化应激中,WRKY基因GmWRKY27能显著降低大豆根中的ROS水平,同时GmWRKY27与GmWRKY174相互作用,可以减少GmWRKY29的启动子活性和基因表达[81]。后来的研究中表明,GmWRKY29是负调控因子,可以增加植物体内ROS的含量,通过直接刺激编码ROS产生酶系基因的表达。另有研究表明,WRKY基因GhWRKY17的过表达降低了烟草对干旱和盐胁迫诱导的氧化应激的耐受性;后来的试验表明,GhWRKY17通过调节ABA信号和ROS的水平参与氧化应激反应[82]。从短柄草中分离出的WRKY基因BdWRKY36,可以通过控制ROS稳态和调节氧化应激相关基因的转录而对氧化应激反应进行调节[83]。
2.5 其他功能性蛋白质
多胺(PA)是在所有活细胞中都存在的低分子量脂族胺。PA在生理pH下具有阳离子的性质,因此对带负电荷的分子(DNA、RNA和蛋白质)具有很强的结合能力,从而稳定它们的结构。PA的生物合成途径已经在许多生物体中进行了深入的研究,而精氨酸脱羧酶(ADC)在PA的合成中起主要作用。在由干旱胁迫下,PtADC基因可以提高烟草和番茄内源性PA水平,减少体内ROS的积累,表现出对氧化应激的耐受性[84]。Jang等在水稻中的插入OsLDC-1序列后,发现该水稻具有高度抗氧化应激的特质,与对照植物相比,该突变体的PA含量更高,表明PA可能通过减少ROS产生和增强ROS降解来介导植物对氧化应激的耐受性[85]。
解螺旋酶是细胞中普遍存在的酶,催化稳定的双链体DNA或RNA二级结构的展开,从而在DNA和RNA代谢过程中起重要作用。OsSUV3是水稻中NTP依赖的RNA和DNA解旋酶。在水稻中OsSUV3可以减少脂质过氧化和H2O2产生,以及增加抗氧化酶的活性,从而表现出较强的抗氧化应激效应[86]。
鸟氨酸δ-氨基转移酶(δ-OAT)是参与脯氨酸和精氨酸代谢的酶。在水稻中,OsOAT的过表达增加了δ-OAT活性和脯氨酸的含量,同时也增强了对干旱、盐和氧化应激的耐受性[87]。
3 展望
线粒体作为真核细胞的一个古老而灵活的细胞器,通过能量代谢参与细胞生长和分裂。虽然现在对植物线粒体的研究正在快速增加,但是针对其功能的研究仍然是从酵母和哺乳动物系统中外推,而没有对植物的直接研究。在以后的研究中,仍然需要对线粒体的组装机制,线粒体氧化应激的信号传导和呼吸频率调节作更详细的研究,以便在恶劣环境中最大限度地保护植物的呼吸作用,并尽量减少呼吸损失以提高植物产量。目前对植物线粒体氧化应激的研究大多是利用各种环境胁迫进行诱导,但对于空间辐射对线粒体影响的研究却没有被报道。随着我国航天事业的蓬勃发展,今后应加大空间辐射对模式植物线粒影响方面的研究,为后续在空间站中对植物的研究奠定基础。
