番鸭细小病毒VP3基因在昆虫细胞中的表达与鉴定
2018-12-05朱善元吴海涛张继玲王安平
吴 萌, 朱善元, 吴海涛, 张继玲, 王安平
(江苏农牧科技职业学院,江苏泰州 225300)
番鸭细小病毒病是由番鸭细小病毒(muscovy duck parvovirus,简称MDPV)引起的雏番鸭的一种急性、败血性传染病[1],主要感染3周龄以内的雏番鸭,俗称三周病[2-3]。该病作为一种病毒病,重在预防,目前疫苗接种是最主要的预防方式。我国多在雏番鸭1日龄时进行MDPV弱毒苗免疫,但由于母源抗体的影响,以致弱毒苗不能对番鸭完全保护,国内外常有该病的报道[4]。因此,研究更为有效安全的MDPV疫苗是目前迫切的任务。
杆状病毒载体表达系统(baculovirus expression vector system,简称BEVS)是一个以昆虫杆状病毒为外源基因载体,以昆虫和昆虫细胞为受体的真核表达系统。该表达系统具有安全性高、对外源基因容量大、较好地转录后加工修饰等优点[5]。在杆状病毒表达系统这些优点的基础上,众多学者对该系统进一步进行研究改进,最为重要的是Bac-to-Bac系统的构建[6],使杆状病毒表达系统能更好地适应基础研究和应用开发的需要。
本研究旨在Bac-to-Bac系统中成功表达番鸭细小病毒的VP3基因,为制备VLPs提供基础。
1 材料与方法
1.1 材料
1.1.1 菌种与血清 MDPV尿囊液、MDPV抗鼠多抗、PFastBac1载体、大肠杆菌DH5α、DH10Bac感受态细胞由笔者所在实验室提供。
1.1.2 酶类和主要试剂pfuDNA聚合酶、限制性内切酶NotⅠ、XhoⅠ及T4DNA连接酶购自加拿大Fermentas公司;质粒抽提试剂盒和胶回收试剂盒购自爱思进生物技术(杭州)有限公司;FITC标记的羊抗鼠二抗购自SouthernBiotech公司;辣根过氧化物酶标记的羊抗鼠IgG购自武汉博士德生物工程有限公司;牛血清白蛋白(BSA)购自美国Sigma公司。
1.2 方法
1.2.1 引物设计与合成 参考GenBank中已发表的MDPVVP3的基因序列(登录号:AY510603.1),设计1对用于扩增VP3基因的引物,引物由英潍捷基(上海)生物技术有限公司合成。引物序列为VP3-FB-F:5′-TATGGATCCATG GCAGAGGGAGGAAGC-3′;VP3-FB-R:5′-TAAGAGCT CCAGATTCTGAGTCAAATACC-3′。序列下划线处分别为上下游引物插入的NotⅠ和XhoⅠ酶切位点。
1.2.2VP3基因的扩增 将MDPV尿囊液煮沸5 min,-20 ℃ 冷冻10 min,4 ℃、12 000 r/min离心5 min,取上清为模板,VP3-FB-F、VP3-FB-R为上下游引物扩增VP3基因。反应体系:模板2 μL、dNTP(2.5 mmol/L)5 μL、10×PCR缓冲液5 μL、上下游引物(25 mmol/L)各2 μL、pfuDNA聚合酶(5 U/μL)1 μL,加双蒸水至50 μL。PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,49 ℃退火30 s,72 ℃延伸 2 min,35个循环;72 ℃延伸10 min。PCR产物经0.8%琼脂糖凝胶电泳检测。
1.2.3 转移载体pFastBac1-VP3的构建与鉴定 按胶回收试剂盒的说明书回收目的基因,经NotⅠ和BamHⅠ酶切后与经同样酶切的pFastBac1载体连接,转化DH5α感受态细胞,涂布于含100 μg/mL氨苄青霉素的LB琼脂平板上,37 ℃培养过夜。挑取可疑单菌落培养,PCR初步鉴定,将鉴定正确的菌落提取质粒,并以NotⅠ和BamHⅠ双酶切鉴定。酶切鉴定正确的菌株送至英潍捷基(上海)生物技术有限公司测序,测序正确的命名为转移载体pFastBac1-VP3。
1.2.4 重组Bacmid DNA的获得与鉴定 将PFastBac1-VP3重组转化DH10Bac感受态细胞,涂布于含有50 μg/mL卡那霉素、7 μg/mL庆大霉素、10 μg/mL四环素、100 μg/mL X-gal及40 μg/mL异丙基硫代-β-D半乳糖苷(IPTG)的LB平板上,37 ℃培养48 h后出现蓝白斑现象。将疑似的白色单菌落接种到含有50 μg/mL卡那霉素、7 μg/mL庆大霉素及10 μg/mL四环素的10 mL抗性LB试管中,37 ℃、250 r/min 摇床培养过夜培养,提取重组Bacmid DNA。
以M13上下游引物对重组Bacmid DNA进行鉴定,反应体系为重组Bacmid DNA 2.0 μL,上下游引物(25 mmol/L)各 1.0 μL,dNTP(2.5 mmol/L)2.5 μL,10×PCR缓冲液2.5 μL,MgCl2(25 mmol/L)2.0 μL,TaqDNA 酶(5 U/μL)0.5 μL,加双蒸水至25 μL。PCR反应条件:93 ℃预变性3 min;94 ℃变性45 s,49 ℃退火45 s,72 ℃延伸3 min,30个循环;72 ℃延伸10 min。PCR产物经0.8%琼脂糖凝胶电泳检测。
1.2.5 重组杆状病毒的获得与扩增 将重组Bacmid DNA转染处于对数生长的昆虫细胞Sf9,27 ℃培养,待Sf9细胞出现明显的病变(细胞核变大,细胞变大变圆,从瓶壁脱落),收集上清即为P1代重组病毒。P1代重组杆状病毒滴度一般比较低,须要用P1代病毒继续传代提高滴度。将P1代病毒感染Sf9细胞,48 h后收集细胞上清,即P2代重组杆状病毒。以P2代病毒感染细胞,得到P3代重组杆状病毒。
1.2.6 重组蛋白的鉴定
1.2.6.1 SDS-PAGE和Western-blot试验 将P3代病毒感染Sf9细胞,正常Sf9细胞作为空白对照,待被感染细胞出现明显病变时,收集细胞沉淀。用适量磷酸缓冲盐溶液(PBS)重悬沉淀,与上样缓冲液混匀,煮沸10 min,进行 SDS-PAGE,考马斯亮蓝染色、脱色,分析结果。
SDS-PAGE结束后,电转印至PVDF膜,5%脱脂奶粉 4 ℃ 封闭过夜,加入1 ∶400稀释的一抗(MDPV多抗),37 ℃孵育2 h,PBS洗涤5遍。加入1 ∶3 000稀释的HRP标记的羊抗鼠IgG二抗,37 ℃孵育1.5 h,PBS洗涤5遍,而二氨基联苯胺(DAB)显色。
1.2.6.2 间接免疫荧光试验 将P3代病毒感染Sf9细胞,以正常Sf9细胞作为空白对照,48 h后,弃培养基上清,PBS洗涤。以预冷的甲醇固定10 min,PBS洗涤后,加入1 ∶400稀释的一抗(MDPV多抗),37 ℃孵育1 h。加入1 ∶500稀释的FITC标记的羊抗鼠IgG二抗,37 ℃孵育45 min,PBS洗涤后,荧光显微镜下观察结果。
2 结果与分析
2.1 VP3基因的克隆
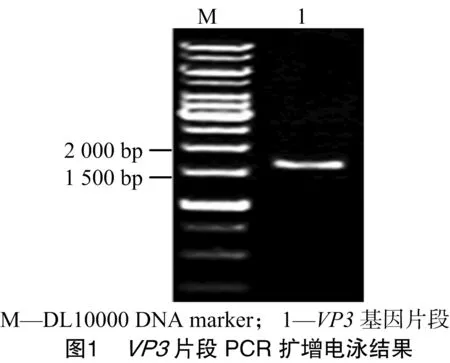
以处理的MDPV尿囊液为模板进行PCR扩增,经0.8%琼脂糖凝胶电泳,结果出现1条约1 602 bp大小的特异性条带(图1),与预期结果相符。
2.2 转移载体pFastBac1-VP3的构建与酶切鉴定
将PCR扩增的VP3基因经琼脂糖凝胶分离后,切胶回收,用BamHⅠ和NotⅠ双酶切,与经同样酶切的pFastBac1质粒连接,获得转移载体pFastBac1-VP3。经BamHⅠ和NotⅠ双酶切得到约1.6 kb和4.7 kb的2条条带(图2),与预期结果相符,且DNA测序结果证明VP3基因克隆正确。
2.3 重组Bacmid DNA的PCR鉴定
以M13上下游引物对重组Bacmid DNA进行PCR鉴定。由图3可知,重组质粒以M13为上下游引物时,出现大小约3.9 kb(2.3 kb+1.6 kb)的条带;以VP3-PFB-F、VP3-PFB-R为上下游引物时,出现大小约 1.6 kb 的条带,与预期结果相符。


2.4 重组蛋白的鉴定
2.4.1 SDS-PAGE分析 以P3代重组杆状病毒感染Sf9细胞,待细胞出现明显病变时,收集细胞,进行SDS-PAGE。染色脱色后,观察结果。由图4可知,被感染的Sf9细胞在约58 ku 处出现特异性条带,空白对照没有。
2.4.2 Western-blot检测 对重组蛋白进行Western-blot检测。由图5可知,重组蛋白在约58 ku处出现特异性条带,与预期结果相符。表明在Sf9细胞中表达的重组蛋白能与MDPV多抗发生特异性反应。
2.4.3 间接免疫荧光试验 以P3代重组杆状病毒感染Sf9细胞,待细胞出现明显病变时,以甲醇固定进行间接免疫荧光试验。由图6可知,P3代病毒感染的细胞出现较强的绿色荧光,而正常细胞中未见荧光。
3 讨论
番鸭细小病毒最早被报道是在1991年,林世堂等认为是类似小鹅瘟的番鸭病毒病的一种新病毒[1],随后程由铨等分离到2株病毒,最后确定本病的病原是细小病毒科的一个新成员[7]。番鸭细小病毒的基因组为单链线性DNA,全长 5 136 bp,包含2个主要的开放阅读框(ORF)。左侧ORF编码非结构蛋白(NS);右侧ORF编码病毒的3种结构蛋白(VP1、VP2、VP3)。其中VP3是主要的衣壳蛋白,约占总蛋白的80%,能刺激机体产生抗体[8-9],是诱导机体产生保护性抗体的主要抗原[10]。



杆状病毒基因组较大,不易通过常规的酶切连接将外源片段插入其中,通常是将外源片段连接到转移载体上[11],然后转移载体与杆状病毒重组,获得重组杆状病毒。最初重组杆状病毒构建时应用的是野生型病毒,该方法重组效率仅 0.1%~1.0%[12],费事费力,因此在应用上有一定的难度。随着杆状病毒载体和筛选方法的不断改进,1993年 Bac-to-Bac技术问世。Bac-to-Bac技术是根据F因子载体原理,构建一种杆状病毒穿梭载体[13],该载体既可像普通质粒一样在大肠杆菌中复制,又能感染昆虫细胞。该方法可使杆状病毒的最大重组率高达100%,并且操作简单,提高了工作效率。
本试验选择MDPV主要衣壳蛋白基因VP3,将其克隆至pFastBac1载体上,构建转移载体pFastBac1-VP3;转化DH10Bac感受态细胞,蓝白斑筛选及PCR鉴定后,获得重组Bacmid DNA。将重组Bacmid DNA感染昆虫细胞,制备重组杆状病毒rBac-VP3,并通过SDS-PAGE分析、Western-blot、间接免疫荧光试验检测重组蛋白的表达。结果证明,VP3基因能在杆状病毒系统中正确表达,为病毒样颗粒在昆虫细胞中的自主装配提供了有力条件和基础。
