Micro RNA-210诱导大鼠急性心肌梗死区域内微血管新生作用机制研究
2018-12-05饶大勇樊仲国邵明学李小波田乃亮
饶大勇,樊仲国,朱 灏,邵明学,李小波,田乃亮*
(1.泗洪县分金亭医院心内科,江苏 宿迁 223900;2.南京医科大学附属南京医院心内科,江苏 南京 210006;3.苏北人民医院心内科,江苏 扬州 225001)
急性心肌梗死(AMI)属心血管疾病,致死率高,患者常伴随并发症,这与心肌纤维化、心室重构等相关[1]。因此,促进血管新生,加速心肌细胞功能复苏或可缓解这一过程。Micro RNAs(miRNAs)与AMI的发生有关,对诊断AMI具有一定价值[2]。MiRNA-210为低氧应答因子,可调节内皮细胞(EC)的凋亡、迁移。目前,miRNA-210在AMI中对血管新生的调节作用仍存在争议,因此,本研究通过研究miRNA-210在心肌梗死中的新生血管调节效应,尝试找出其可能的作用基因靶点并探讨相关机制。现报告如下。
1 材料与方法
1.1 实验设备及试剂
BIOER荧光定量PCR仪(博日,杭州)、Gel Doc 2000成像系统(BIO-RAD,美国)、小动物超声仪(维胜,加拿大);一抗-MHC(#ab 50967)(艾博抗)、一抗-HGF(#BA 0911)(博士德)等。
1.2 动物实验
1.2.1 动物饲养
南京医科大学动物中心提供成年雄性SD大鼠(4周龄,220~240 g),室温:20℃左右,照明:12 h/d,饲养一周后手术操作。
1.2.2 心肌梗死模型建立、分组及慢病毒载体转染
对大鼠行冠脉前降支结扎,建立模型。随机将其分为:假手术组(Sham组):缝针穿过心肌而不行结扎,心肌梗死+阴性病毒对照组(AMI+NV),心肌梗死组(AMI+PBS),心肌梗死+miRNA-210激动剂体内转染组(AMI+miRNA-210 agonist)。MiRNA-210激动剂和和阴性对照病毒分别加入PBS缓冲液中混匀成0.5 mL混合液,其余组大鼠尾静脉注射PBS缓冲液0.5 mL。
1.2.3 大鼠心功能评估及样本获取
术后4周行超声心动图,包括:左室收缩期及舒张期内径(LVDs,LVDd)、左室收缩期及舒张期容积(LV VOLs,LV VOLd)。计算左室射血分数(LVEF)及左室缩短速率(LVFS)。取心脏组织(剪去血管、右心房、心室组织),心尖部以备即时荧光定量聚合酶链反应(qRTPCR)及蛋白印迹实验(WB),其余留作形态学检测等。
1.2.4 qRT-PCR
检测miRNA-210、肝细胞生长因子(HGF)、血管内皮生长因子(VEGF)的表达水平。甘油醛-3-磷酸脱氢酶(GAPDH)为定量内参。Primer 5.0软件设计引物序列。提取总RNA,以(2-ΔΔCt)法定量分析。
1.2.5心脏标本形态学检测及免疫组化分析
对标本进行染色,CD 31抗原结合EC后计算相关指标。计算方法:每个区域选取微血管密集的三处计数并取平均值,平均光密度=累计光密度/区域面积,以两处区域平均光密度的算术平均数为此标本的微血管密度(MVD)。采集图像,以Image-Pro Plus 6.0软件量化分析。
1.3 细胞实验
将人脐静脉内皮细胞(HUVECs)(美国模式培养物研究所(Manassas,VA,美国))按培养状态分为常氧组(normoxia condition)和低氧组(hypoxic condition)。低氧组HUVECs达50%孵育率后分为两组:接受小干扰RNA(siRNA)转染(siHGF组)、平行对照组(control组),以WB分析。
1.4 WB分析
检测心肌内HGF及β-MHC蛋白表达水平。绘制曲线,上样,转膜,洗膜,封闭。稀释一抗,次日洗膜;稀释二抗,反应1h。Actin为内参。检测HUVECs中HGF、CD 31表达水平,步骤基本同上,GAPDH为内参。
1.5 统计学方法
采用SPSS 22.0统计软件完成数据分析,计量资料以均数±标准差(±s)表示,正态分布资料采用t检验进行两组间比较,多组间相互比较采用单因素方差分析法,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠存活情况
术前:48只;术后存活:Sham组12只,AMI+NV组7只,AMI+PBS组8只,AMI+miRNA-210 agonist 组9只。
2.2 心肌内miRNA-210及HGF、β-MHC表达变化情况
AMI+miRNA-210 agonist组miRNA-210表达水平增加最为显著,差异有统计学意义(P<0.001);该组内HGF表达随之亦显著增加;各组VEGF的表达水平无显著差异,见图1。AMI+miRNA-210 agonist组HGF的表达随miRNA-210表达的增加而增加,AMI+NV组β-MHC表达水平增加最为显著,见图2。
Ⅰ:sham组;Ⅱ:AMI+NV组;Ⅲ:AMI+PBS组;Ⅳ:AMI+miRNA-210 agonist组。说明:*:P<0.05 vs.Ⅰ;#:P<0.05 vs.Ⅱ;&:P<0.05 vs.Ⅲ。

图1 术后4周各组大鼠心肌内miRNA-210、HGF及VEGF的表达水平比较。

图2 术后4周各组大鼠心肌内HGF及β-MHC的蛋白表达比较。
2.3 心肌内HGF过表达对HUVECs的影响
siRNA显著抑制HGF蛋白表达,见图3。CD 31表达水平在低氧环境中随HGF的增加而显著升高;siRNA处理后,EC的分化及增殖速度受到明显抑制,CD 31表达随之显著下降,见图4。

图3 经siRNA处理后EC中HGF蛋白表达水平。
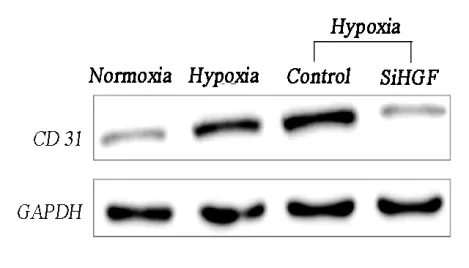
图4 经siRNA处理后EC中CD 31蛋白表达水平。
2.4 心肌内miRNA-210过表达所致心肌组织病理生理及心功能改变
2.4.1 心肌组织内微血管密度计数
与对照组相比,AMI+NV组平均光密度显著衰减(P=0.045);差异有统计学意义(P<0.05)。AMI+miRNA-210 agonist组较AMI+NV组显著增强(P=0.029),差异有统计学意义(P<0.05)。见图5。
Ⅰ:sham组;Ⅱ:AMI+NV组;Ⅲ:AMI+PBS组;Ⅳ:AMI+miRNA-210 agonist组。说明:*:P<0.05 vs.Ⅰ;#:P<0.05 vs.Ⅱ。

图5 CD 31抗原结合EC组化分析法检测术后4周各组大鼠心肌内MVD。图A:Sham组;图B:AMI+NV组;图C:AMI+PBS组;图D:AMI+miR-210 agonist组;图E:定量分析条形图。
2.4.2 梗死心肌病理改变
三组大鼠心肌纤维均被破坏,AMI+NV组破坏程度甚于AMI+PBS组;AMI+miRNA-210 agonist组破坏程度最小,但仍可见大量炎症细胞浸润及结缔组织增生,见图6。

图6 各组大鼠心脏组织病理学观察;图A:Sham组;图B:AMI+NV组;图C:AMI+PBS组;图D:AMI+miR-210 agonist组
2.4.3 超声心动图评估大鼠心功能
AMI+NV组LVDs、LV VOLs增大最为显著,LVEF 、LVFS随之显著降低;AMI+miRNA-210 agonist组LVEF、LVFS升高最为显著,见表1。
表1 超声心动图检测心功能及心脏结构变化特点(±s)

表1 超声心动图检测心功能及心脏结构变化特点(±s)
注:Ⅰ:sham组;Ⅱ:AMI+NV组;Ⅲ:AMI+PBS组;Ⅳ:AMI+miRNA-210 agonist组。*:P<0.05vs.Ⅰ;#:P<0.05 vs.Ⅱ。
检测项目 Ⅰ Ⅱ Ⅲ ⅣLVDs, mm 3.76±0.77 6.64±0.46* 5.24±0.65 4.39±0.90#LVDd, mm 6.40±1.18 8.76±1.19 8.02±0.62 7.44±0.81 LV VOLs,μL 69.92±31.48 227.71±35.30* 133.61±37.85 91.07±45.20#LV VOLd,μL 215.07±90.12 428.11±131.76 348.11±61.50 295.68±70.30 EF, % 71.15±3.46 45.22±8.43* 61.90±6.52# 67.26±5,84#FS, % 41.37±2.87 23.73±5.51* 34.76±4.90 38.45±4.16#
3 讨 论
AMI患者由于心肌细胞缺血、缺氧,心脏收缩力减弱,其预后不佳。有研究表明[3],miRNA相关家系过表达对心肌细胞有多种作用。另外,多种miRNAs已被为诊断AMI的潜在标志物[4]。本实验发现心肌内miRNA-210过表达可刺激HGF过表达,促进血管EC分化、增殖,从而改善心脏收缩功能。
HGF可调节EC的迁移、增殖,可能与增强细胞内某些涉及细胞骨架重塑、细胞迁移等的信号分子相关[5]。本实验发现miRNA-210诱导心肌梗死后血管新生是通过上调HGF表达实现,而非作用于VEGF靶基因。事实上,维持EC及血管平滑肌细胞(VSMCs)增殖、迁移之间的平衡是血管新生的重要条件。碱性成纤维细胞生长因子可激活NFκB信号通路促进诸多炎症因子产生,从而诱导增加VSMCs数量。AMI常合并炎症反应,可打破EC、VSMC之间的平衡,而HGF可抑制有关炎性因子的释放,因此miRNA-210过表达后上调HGF表达,可促进EC增殖、迁移,增加梗死区域内微血管新生。
此外,本研究发现miRNA-210过表达可通过改善LVEF、LVFS水平,抑制β-MHC增长,从而增强心肌收缩力,改善心功能。继发于AMI的心室重构早期可引起短期的心脏收缩能力代偿性增加,且梗死区域内的β-MHC蛋白表达量也显著增加,提示miRNA-210过表达对于改善梗死后心室重构也具有积极作用。
MiRNA-210过表达后可上调HGF表达,从而促进EC增殖、迁移,增加梗死区域内新生血管形成,减少心肌细胞坏死,改善心脏收缩功能。
