水杨酸对两种海洋微藻生长及油脂积累的影响
2018-12-04张诚鹏张仁璇佟少明
张诚鹏,朱 尧,张仁璇,姜 思,佟少明
(辽宁师范大学 生命科学学院 辽宁省植物生物工程重点实验室,辽宁 大连 116081)
绿色、可再生的生物质能源的开发和利用是替代化石能源最有吸引力的途径之一[1]。生物质能源较为清洁,可降低对环境的污染[2]。在过去十年间,随着全球生物柴油和生物乙醇产量的急剧增加,许多跨国公司投资于这一产业,利用大片土地来生产生物燃料。但在最近几年,其中部分公司由于缺少原料以及对原料缺乏一定的了解等原因,已经延缓生产甚至已经停产[3]。因此,要想实现从非可再生能源向生物质能源的可行性转化,寻找廉价、丰富的原料成为了当务之急。
光合微藻以其独特的生长优势受到广泛关注,因为它具有光合效率高、生长繁殖快、环境适应能力强和不占用耕地等优势[4],同时,这些优点还造就了其在除了生物能源生产以外的其他领域的应用价值,如污水净化、高附加值食品及药品的提取和作为水产饵料等等[5]。有研究指出,相同单位面积微藻的产油量高于高等植物的产油量,具有良好的开发价值[6],因此,微藻也被认为是产生三酰基甘油(TAG)最有希望和最环保的来源之一,成为了众多研究者的研究目标[7]。然而,由于用大规模培养藻类来生产生物柴油的方法比较昂贵,导致以生物柴油取代化石燃料的大规模生产在经济上难以实现[8]。因此,基于降低成本的原则,研究人员尝试过许多方案,如筛选脂质含量高的藻类、用合适的废水培养藻类,或者利用其他各种各样的条件,以达到增强藻类脂质积累的目的[9]。
水杨酸(salicylic acid,SA)是植物体内普遍存在的小分子酚类化合物,在逆境条件下会在植物体内积累,提高植物对抗逆境的能力[10]。 SA还可以调节藻类多种生理代谢功能[11],如外源添加SA能够缓解海带叶片的氧化损伤[12],雨生红球藻(Haematococcuspluvialis)经SA诱导后提高了类胡萝卜素相关基因的表达,进一步促进了虾青素的积累[13],SA还能够增加栅藻(Scenedesmus)细胞中的ATP水平[14]。拟微绿球藻(Phaeodactylumt-r-i-c-o-r-n-u-t-u-m)和三角褐指藻(Nannochloropsismaritime)均为单细胞的经济型海洋微藻,且都已完成测序。除了生长周期短和繁殖速度快等特点,最重要的是具有较高的油脂含量,总脂含量分别占细胞干质量的31%~68%和20%~30%[15],可作为生产生物柴油的潜在来源。
本文中,笔者研究不同浓度SA对拟微绿球藻和三角褐指藻生长和油脂积累的影响,以期为提高藻细胞内油脂含量的生产实践提供数据。
1 材料与方法
1.1 藻类的培养
拟微绿球藻和三角褐指藻为辽宁师范大学藻类研究室保存藻种,均用灭菌的f/2培养基在3 L的三角瓶中扩大培养,培养温度为(23±1)℃,光强为40 μmol/(m2·s),光暗比12 h∶ 12 h,每天早晚各手摇1次,培养至对数生长期后在超净工作台下进行分装,每个100 mL三角瓶中加入65 mL藻液,用于加入SA进行实验。
1.2 水杨酸处理
水杨酸SA购自美国Sigma公司。实验共设3组,分别设置不同的浓度梯度加入拟微绿球藻和三角褐指藻中。其中,拟微绿球藻的处理质量浓度为4、8和12 μg/mL,三角褐指藻的处理质量浓度为2.5、10和40 μg/mL。每个实验组设置3个重复及无SA处理的藻液为空白对照。
1.3 藻类生长及光化学活性的测量
加入SA后,每隔两天在超净工作台下取出2 mL藻液,黑暗处理30 min,使藻细胞完全适应黑暗,用Multi-Color PAM(Heinz-Walz,德国)测量实时荧光强度(Ft)、光系统Ⅱ(PSⅡ)的实际光合效率(YⅡ)、调节性能量耗散的量子产额YNPQ等各项光化学活性指标。
藻类生长的测量采用Ft值,通过建立的Ft值与藻细胞数之间的回归方程计算出藻细胞数,再进行比较。
1.4 油脂含量的测定
油脂含量测定采用尼罗红染色法。具体方法为:藻细胞经SA诱导15 d后,取2 mL藻液,5 000 r/min离心5 min去除培养基,加入等体积20%的二甲基亚砜(DMSO)溶液,40 ℃水浴20 min,加入尼罗红染液使其终质量浓度为1 μg/mL,暗处理20 min。未经SA处理的藻细胞作为对照,利用荧光分光光度计进行测定,设置激发波长为530 nm,测定其在波长580 nm处的荧光强度。
2 结果与讨论
2.1 SA对2种藻细胞生长的影响
分别采用Multi-Color PAM及细胞计数方法测定2种藻细胞的Ft值及对应的藻细胞数,建立Ft值与两种藻细胞数的相关曲线分别为:y=556x-179.34,R2=0.992 6(拟微绿球藻);y=216.01x-28.69,R2=0.996 8(三角褐指藻)。
图1为SA对2种藻细胞生长的影响结果。由图1(a)可知:拟微绿球藻经SA诱导3 d后,各浓度处理组与对照组的细胞数基本相同,诱导6天后,除4 μg/mL处理组略高于对照组外,8及12 μg/mL处理组仍与对照组基本相同。第9天之后,4 μg/mL处理组仍然高于对照组,而12 μg/mL处理组开始低于对照组;在诱导第12天之后,8 μg/mL处理组的细胞数与对照组仍然无显著差异,而4 μg/mL的处理组比对照组增加了8.29%,12 μg/mL处理组比对照组减少了5.70%(P<0.05)。
由图1(b)可知:当SA的质量浓度低于2.5 μg/mL,三角褐指藻的生长与对照组相比没有变化,在2.5~40 μg/mL的处理范围内,SA对三角褐指藻的生长均具有抑制作用,且SA浓度越高,抑制作用越明显。诱导12 d后,经不同质量浓度SA(2.5、10和40 μg/mL)处理后的三角褐指藻的细胞数分别比对照组下降了8.51%、22.87%和40.43%(P<0.05)。

图1 不同质量浓度SA对拟微绿球藻和三角褐指藻藻细胞生长的影响Fig.1 Effects of different SA concentrations on the growth of N. maritime and P. tricornutum
SA是普遍存在于植物体内的酚酸类物质之一,作为一类重要的化感物质,SA直接或间接地影响植物的代谢及对逆境胁迫的调控过程,但外源施加SA对植物代谢的影响还没有统一的规律,其作用模式依赖于作用植物的种类、SA的作用浓度及环境因子(如,光和温度等)。如,SA可以促进小麦的种子萌发及幼苗生长,促进大豆幼芽及根的生长;SA既会促进小球藻的生长[16],也会有效抑制铜绿微囊藻的生长[17]。本研究中发现,4 μg/mL的SA处理会对拟微绿球藻具有显著的促进作用,但当SA质量浓度达到12 μg/mL时会抑制拟微绿球藻的生长,这一低促高抑的结果与SA对水华鱼腥藻[18]的作用模式一致。而在2.5~40 μg/mL范围内,SA能够抑制三角褐指藻的生长,浓度越大抑制作用越明显。
2.2 SA对2种藻YⅡ值的影响
图2为不同浓度SA对拟微绿球藻和三角褐指藻的YⅡ值的影响结果。由图2(a)可知:诱导前6天,SA处理组的YⅡ值与对照组相比,无明显变化。诱导9 d之后,12 μg/mL处理组的YⅡ值开始高于对照组,直至诱导第12天后,12 μg/mL处理组明显高于对照组,比对照组增加了20.54%(P<0.05),而4 μg/mL处理组和8 μg/mL处理组均未出现显著性差异。
由图2(b)可知:40 μg/mL的SA对三角褐指藻的Y Ⅱ 值具有显著的抑制作用(P<0.05)。SA诱导3 d后,40 μg/mL处理组的Y Ⅱ 值开始显著低于对照组,直至诱导12 d后,40 μg/mL处理组的Y Ⅱ 值比对照组降低了15.93%,而2.5 和20 μg/mL处理组的无显著性差异。
SA对光合作用的影响对不同植物反应也不尽相同。如SA虽然能够促进大豆幼芽和根的生长,但是其对大豆的光合作用却没有影响,而SA对印度芥茉[19]的光合作用有显著的影响。SA在高等植物中促进光合作用的提高很可能是通过促进气孔开张及光合碳同化相关酶的活性来起作用的,也有报道表明,SA的处理会显著提高植物叶绿素的含量、光合电子传递效率(ETR)及PSⅡ调节性能量耗散(NPQ),YNPQ[16,19]。但对于SA的处理对藻类光合作用的影响还鲜有报道。本研究中发现,SA的处理(12 μg/mL SA)使拟微绿球藻的光合效率提高了20.54%,其光合电子传递效率也提高了20.69%,且YNPQ的值无显著变化,因此,SA促进拟微绿球藻的光合效率的提高可能是通过提高PSⅡ的电子传递效率来实现的。另外,在本研究中也发现,40 μg/mL SA的处理降低了三角褐指藻的光合效率,而SA对三角褐指藻的光合电子传递效率没有显著影响(数据未显示),但其YNPQ显著提高(数据未显示),因此YNPQ的提高是高浓度的SA对三角褐指藻光合效率产生抑制的主要原因。
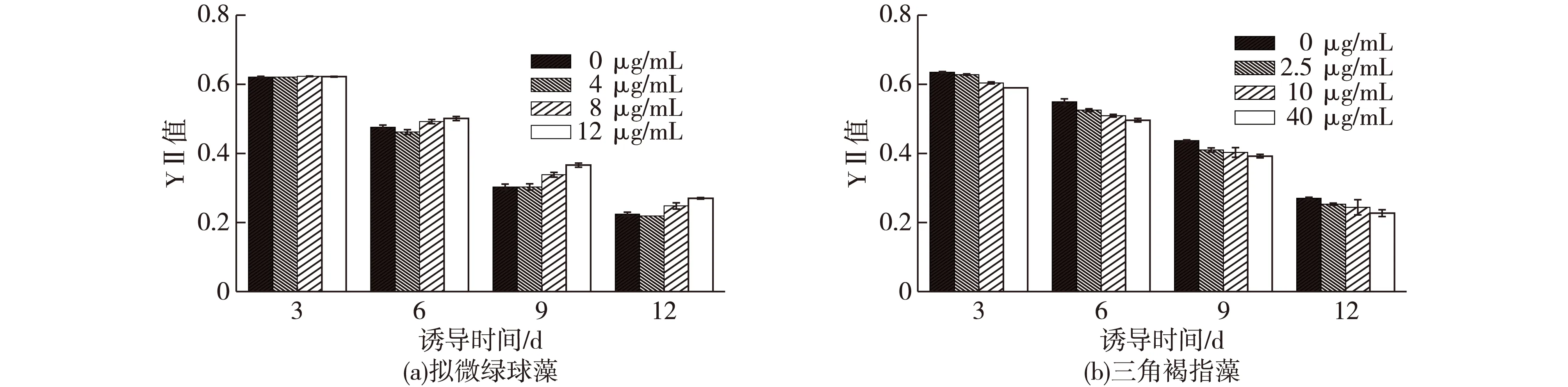
图2 不同浓度SA对拟微绿藻和三角褐指藻的YⅡ值的影响Fig.2 Effects of different SA concentrations on the YⅡ of N. maritime and P. tricornutum
2.3 SA对2种藻油脂积累的影响
图3为SA对2种藻油脂积累的影响结果。由图3可知:经过不同浓度的SA处理后,拟微绿球藻和三角褐指藻的油脂积累都发生了一定的变化。在拟微绿球藻中,8 μg/mL组和12 μg/mL组的油脂含量均明显高于对照组,比对照组分别增加了23.21%和45.87%(P<0.05),而4 μg/mL组则无明显变化。
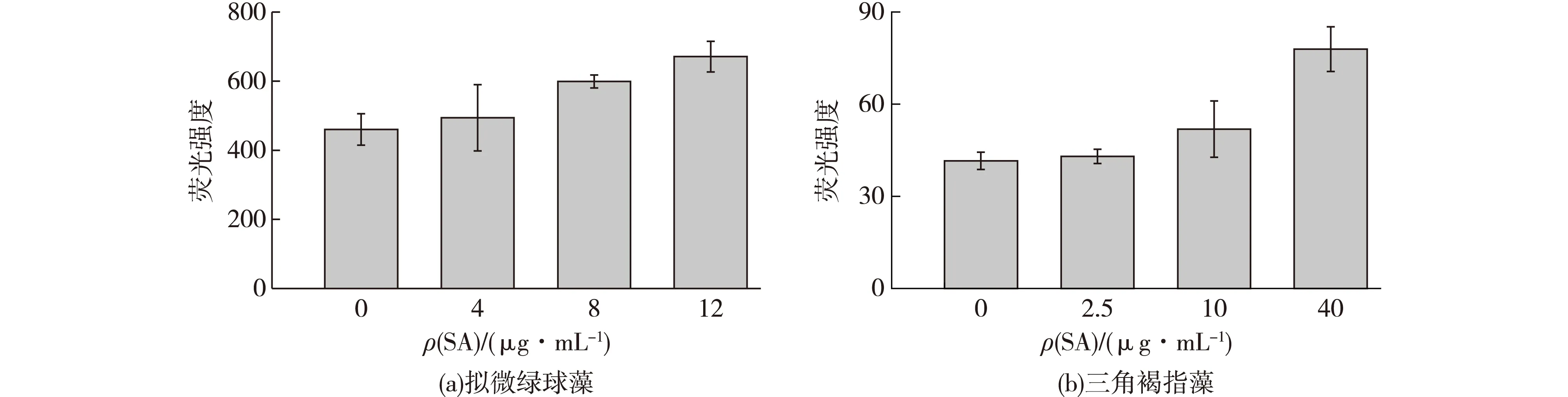
图3 不同浓度SA对拟微绿球藻和三角褐指藻油脂积累的影响Fig.3 Effects of different SA concentrations on the lipid accumulation of N. maritime and P. tricornutum
三角褐指藻经SA诱导后,2.5 μg/mL组和10 μg/mL组的油脂含量与对照组相比均无显著差异,而40 μg/mL组的油脂含量比对照组增加了87.48%,有显著的促进作用(P<0.05)。
目前,植物激素及其类似物已经在几种微藻中发现,尽管对其功能还知之甚少,但这些分子的外源添加会对藻类代谢产生影响。例如,在促进藻类脂质的积累方面,适当浓度的黄腐酸会促进单针藻的生长及油脂含量积累[20],适当浓度的吲哚-3-乙酸(IAA)诱导小球藻2 d和8 d后均能促进小球藻的油脂积累[21],而适当浓度的水杨酸仅能够促进淡水小球藻中的油脂积累[22]。除了促进总脂含量的积累,SA还能够改变脂肪酸的组成结构,如经SA处理的梨叶在感染轮文菌后,不饱和脂肪酸含量上升,而饱和脂肪酸含量下降[23]。亚麻经SA预浸泡后,增加了亚麻酸的比例,减少了棕榈酸的比例[24]。低温下施用 SA 还可以显著提高黄瓜幼苗根系脂肪酸的不饱和程度[25]。在本研究中发现,适当浓度的水杨酸处理能够促进拟微绿球藻及三角褐指藻细胞中中性油脂的积累,但对藻细胞中脂肪酸结构的影响还有待进一步研究。
3 结论
研究了外源添加SA会对拟微绿球藻和三角褐指藻的生长、光化学活性及油脂积累的影响。研究发现SA对于不同藻类的作用效果不尽相同。SA对拟微绿球藻的生长具有低浓度促进、高浓度抑制的作用,而对三角褐指藻的生长具有明显的抑制作用;SA显著提高了拟微绿球藻的光合效率,对三角褐指藻的光合效率却有显著的抑制作用。在油脂积累方面,适当浓度的SA对拟微绿球藻和三角褐指藻的油脂积累都具有显著促进作用,为生物柴油的生产提供了切实可行的方法。
