羊肚菌多糖提取、分离纯化及免疫调节活性
2018-12-04侯怡铃
黄 瑶,蒋 琳,刘 影,刘 露,侯怡铃,丁 祥
(1. 西华师范大学 生命科学学院 西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2. 西华师范大学 环境科学与工程学院,四川 南充 637009)
羊肚菌(Morehellaesculenta)隶属于子囊菌亚门(Ascomycotina)盘菌纲(Discomycetes)盘菌目(Pezizales)羊肚菌科(Morchellaceae)羊肚菌属(Morchella),因其酷似羊肚,从而得名羊肚菌[1]。野生羊肚菌,子实体个头中等或偏小,菌盖椭圆形且表面类似蜂窝状,顶端钝圆,菌柄近白色,味道鲜美,是很好的食用和药用真菌[2-3]。
真菌多糖主要是从真菌的子实体、菌丝体等中提取出来的一种生物多糖,在抗菌、抗肿瘤等方面有重要作用[4]。真菌多糖结构对其活性的影响很大,通常多糖活性好的,其结构相对复杂[5]。目前对于羊肚菌多糖的研究集中在抗肿瘤和抗氧化两方面[6-9],但对羊肚菌多糖免疫方面的活性报道甚少,因此,本研究主要集中在探究羊肚菌多糖对免疫细胞的活性影响,对后续羊肚菌多糖的免疫调节通路提供理论基础。
本实验中,笔者以四川省小金县的野生羊肚菌为研究材料,采用热水浸提法、DEAE-纤维素层析法得到羊肚菌多糖,通过高效凝胶渗透色谱(HPGPC)和傅里叶红外光谱技术(FT-IR)对多糖的结构进行鉴定,并对羊肚菌多糖的免疫调节能力初步探究,以期为羊肚菌的药用价值研究提供一定的理论支撑。
1 材料和方法
1.1 研究材料
1.1.1 实验材料
羊肚菌子实体,由西华师范大学生命科学学院西南野生动植物资源保护教育部重点实验室提供。
1.1.2 实验仪器
DFT-150型高速万能粉碎机,上海鼎广机械设备有限公司;AR2130型电子天平、WBK-3B型电热恒温水浴锅,上海奥豪斯仪器有限公司;Spring-K40型超纯水仪,重庆艾科浦公司;KE-6000型旋转蒸发仪,上海亚荣生化仪器厂;DHG-9140A型电热鼓风干燥箱,上海一恒科学仪器有限公司;台式低温高速离心机,北京医用离心机厂;Epoch 酶标仪,美国基因有限公司;CO2恒温培养箱, Thermo 公司;SE-CJ-1F型超净工作台,苏净安泰空气技术有限公司;96 孔微量培养板,上海凌初环保仪器有限公司;DMI 3000型倒置荧光显微镜,徕卡显微系统(上海)贸易有限公司;HPGPC 220高效凝胶色谱仪,美国Aglient公司。
1.1.3 实验药品
本实验涉及的实验药品均为分析纯。无水乙醇(95%),安徽安特生物化学有限公司;NaOH、HCl、浓H2SO4、苯酚和NaCl,四川生工科技有限公司;DEAE-纤维素,生兴生物技术(南京)有限公司;CCK-8 细胞计数试剂盒(A cell counting kit),上海碧云天生物技术研究所;磷酸盐酸缓冲液(PBS),自制;RPMI1640 培养基、0.5%Trypsin-EDTA,Gibco公司;胎牛血清、双抗, Clark Bioscience ;小鼠巨噬细胞(RAW264.7)、淋巴细胞B、淋巴细胞T,中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 方法
1.2.1 羊肚菌多糖的提取
称取干燥后的羊肚菌子实体200.0 g,放于95%乙醇中浸泡24 h(除去多酚及少量的蛋白质等),烘干备用。用粉碎机将烘干的羊肚菌子实体粉碎后,于装有适量蒸馏水的90 ℃水浴锅中煮6 h(不断搅拌),煮3次[10];12 000 r/min离心后将上清液合并收集(约2 000 mL),高温浓缩至200 mL,加入4倍体积的无水乙醇[11],用玻璃棒搅拌直到产生絮状沉淀,再次12 000 r/min离心收集沉淀,干燥后得到羊肚菌粗多糖[12]。
1.2.2 羊肚菌多糖的分离纯化
采用DEAE-纤维素柱层析法和透析法对羊肚菌粗多糖进一步分离纯化[13-14]。将烘干后的羊肚菌粗多糖加入适量的蒸馏水使其充分溶解,约150 mL离心待用;电子天平称取50.0 g DEAE cellulose 52色谱填料树脂[15],并将其活化待用;配制不同浓度的NaCl溶液(0、 0.1、0.2、0.3、0.4和0.5 mol/L)作为洗脱液待用;配制0.5 mol/L的NaOH和0.5 mol/L的HCl溶液备用;将活化好的纤维素轻轻倒入玻璃柱中,静置12 h让纤维素自然沉淀。静置完成后,沿壁缓缓加入5 mL多糖溶液,依次用不同浓度的洗脱液过柱,用试管收集洗脱液(每管10 mL)并用硫酸苯酚法检测[16],绘制洗脱曲线,合并含多糖的洗脱液浓缩后,用截留分子量为7 000的透析袋透析,浓缩干燥后得到的固体样品即羊肚菌多糖,命名为ME-X。
1.2.3 ME-X分子量测定
参照文献[17-18]采用HPGPC对ME-X纯度进行鉴定,同时测定其分子量。精确称取5.0 mg ME-X样品,在1 mL重蒸水中充分溶解,超声5 min,用HPGPC 220高效凝胶色谱仪进行测定,测得的数据用凝胶色谱(GPC)软件进行分析。
1.2.4 ME-X的红外光谱分析
采用KBr压片法,称取干燥的ME-X样品5.0 mg于研钵,加入适量KBr粉末充分碾碎后压片,在傅里叶红外光谱仪(FT-IR)400~4 000 cm-1的范围检测[19]。
1.2.5 ME-X对淋巴细胞T和B及RAW264.7细胞的增殖作用
用CCK-8(cell counting kit)法检测ME-X对淋巴细胞T和B及RAW264.7细胞的增殖效果[20-21],选取对数生长期且状态良好的细胞,将其细胞密度稀释至1.0×105个/mL,接种到96孔培养板上,每孔100 μL细胞稀释液,边缘的孔加入200 μL PBS缓冲液,保持无菌水环境的同时可消除边缘效应。在37 ℃、5%(体积分数)CO2的培养箱中培养24 h后,加入不同浓度的ME-X溶液[22-23](终质量浓度为1.25、5、10和20 μg/mL),阳性对照组中每孔加入100 μL的脂多糖(LPS)溶液[24-25](终质量浓度为10 μg/mL),空白对照组中则加入等体积的完全培养液。在恒温培养箱中继续培养24 h后,每孔加入CCK-8溶液5 μL放于培养箱孵育3 h后,拍照,并用酶标仪测定波长450 nm处吸光值(A450)[26]。将吸光值转换为增殖率,并绘制以增殖率为纵坐标、ME-X浓度为横坐标的曲线。按式(1)计算细胞增殖率。
(1)
式中:P为细胞增殖率,%;A1为空白对照组孔的平均吸光度值;A2为实验组孔的平均吸光度值;实验组即为阳性对照组和4个ME-X药物组。
1.2.6 ME-X对RAW264.7细胞吞噬中性红能力的影响
选取对数期的RAW264.7细胞,将其细胞密度稀释至1.0×105个/mL,接种到96孔培养板上,每孔100 μL细胞稀释液,边缘的孔加入200 μL PBS缓冲液,保持无菌水环境的同时可消除边缘效应。在37 ℃、5% CO2的培养箱中培养24 h后,加入不同浓度的ME-X溶液[22-23](终质量浓度为1.25、5、10和20 μg/mL),阳性对照组中每孔加入100 μL的LPS溶液[24-25](终质量浓度为10 μg/mL),空白对照组中则加入等体积的完全培养液。在恒温培养箱中继续培养24 h后,用移液枪移除上清液,每孔加入100 μL质量分数为0.075%中性红溶液,恒温培养箱中吞噬15 min。弃中性红,并用200 μL预冷的PBS清洗3次,最后每孔加入100 μL细胞裂解液(乙醇与乙酸体积比为1∶ 1,现配现用),在培养箱中37 ℃下裂解2 h,酶标仪检测波长540 nm处吸光值A540,将吸光值转换为吞噬率,并绘制以吞噬率为纵坐标、ME-X浓度为横坐标的曲线[27]。按式(2)计算细胞吞噬率。
(2)

1.2.7 统计与分析
所有数据均用Mean±SD表示,用t-test检验差异的显著性,与对照组对比显著以*表示(P<0.05),极显著以**表示(P<0.01)。
2 结果与讨论
2.1 羊肚菌多糖的提取及分离纯化
200 g羊肚菌子实体采用热水浸提法和醇沉法后得到粗多糖40 g,得糖率20%。采用DEAE cellulose-52色谱柱,用不同浓度的NaCl溶液作为流动洗脱相,洗脱曲线如图1所示。由图1可知:除0.1 mol/L NaCl洗脱时出现一个较大的洗脱峰外,其他洗脱液段均未出现洗脱峰,说明只有0.1 mol/L NaCl洗脱液含真菌多糖。收集所有0.1 mol/L NaCl段的多糖溶液,浓缩干燥后得到的固体样品即羊肚菌多糖,命名为ME-X。
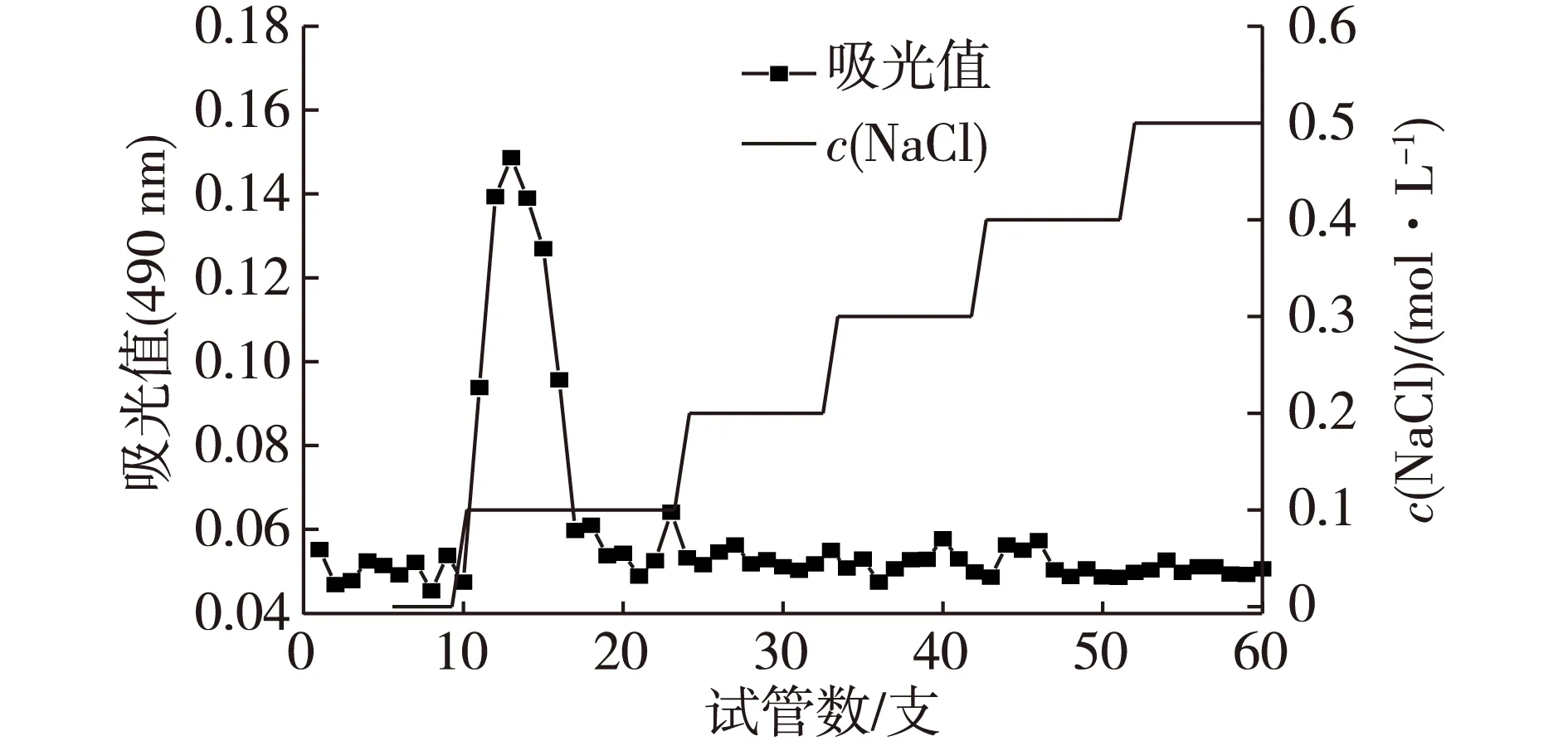
图1 ME-X的DEAE cellulose-52色谱柱层析洗脱曲线Fig.1 Chromatogram of ME-X on a DEAE-cellulose 52 column
2.2 ME-X高效凝胶渗透色谱(HPGPC)结果
采用HPGPC对ME-X的纯度进行鉴定,结果如图2所示。由图2可知,ME-X的HPGPC洗脱曲线中有1个较高对称峰,且峰较高峰面积较宽,提示ME-X是一种比较纯的生物多糖,其重均分子量(Mw)为16 348,数均分子量(Mn)为13 050;峰值分子量(MP)为16 348;Z均分子量(MZ)为1 089 260;Z+1均分子量(MZ+1)为2 166 652。

图2 ME-X的HPGPC洗脱曲线Fig.2 Chromatogram of ME-X on HPGPC
2.3 ME-X的FT-IR分析

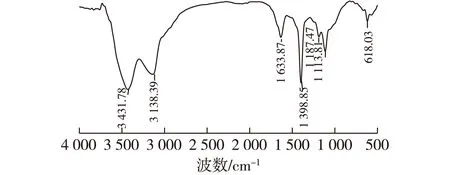
图3 ME-X的红外分析图Fig.3 FT-IR spectra of ME-X
2.4 ME-X的免疫增殖作用
2.4.1 ME-X对淋巴细胞T增殖的影响
淋巴细胞T是由部分骨髓干细胞迁移至胸腺后分化成熟的,具有免疫活性的细胞,简称T细胞,主要参与机体的细胞免疫[30]。ME-X刺激后T细胞增殖效果如图4所示。由图4可知:与空白对照组相比,ME-X药物组与脂多糖(LPS)阳性对照能显著地促进T细胞增殖,并呈一定的剂量关系。当药物质量浓度为1.25~10 μg/mL时,其增殖率和药物浓度成正相关;当药物质量浓度为10 μg/mL时,增殖率最高为31.18%,表明该浓度的ME-X对促进T淋巴细胞增殖效果最好;当药物质量浓度在20 μg/mL时,其增殖率随药物浓度升高反而有所下降。

*表示P<0.05,**表示P<0.01,ME-X组、LPS组均与空白对照组比图4 ME-X对T细胞增殖的影响Fig.4 Effects of ME-X on the proliferation of T cell
T细胞的增殖形态如图5所示。随着ME-X浓度的增大,细胞加速分裂,成团变大。在用10 μg/mL的ME-X刺激T细胞时,细胞成团最大且最多。

图5 ME-X对T细胞形态的影响Fig.5 Effects of ME-X on the cell morphology of T cell
2.4.2 ME-X对淋巴细胞B增殖的影响
淋巴细胞B简称B细胞,来源于骨髓的多功能干细胞,能够分泌抗体,是体液免疫的主要介质[31]。B细胞的增殖效果如图6所示,阳性对照组为10 μg/mL的LPS,ME-X质量浓度为1.25、5、10和20 μg/mL。由图6可知:与空白对照组相比,药物组增殖效果均达到极显著,当ME-X多糖质量浓度为1.25 μg/mL时,其增殖率达到49.60%;当ME-X多糖质量浓度为10 μg/mL时,其增殖率最高,达到63.02%。同时LPS阳性对照组与空白对照组相比,也具有极显著的统计学意义,但其增殖效果比药物组差很多,其增殖率仅19.62%。
B细胞增殖形态如图7所示,正常状态的B细胞呈圆形,悬浮并集簇生长,但成团细胞数较少;经ME-X刺激后,细胞增殖明显加快,细胞数量显著升高,且成团细胞又大又多。

图7 ME-X对B细胞形态的影响Fig.7 Effects of ME-X on the cell morphology of B cell

*表示P<0.05,**表示P<0.01,ME-X组、LPS组均与空白对照组比图6 ME-X对B细胞增殖的影响Fig.6 Effects of ME-X on the proliferation of B cell
2.4.3 ME-X的对巨噬细胞增殖的影响
巨噬细胞来源于血液中的单核细胞,是一种具有多种功能的免疫细胞,可参与机体先天性免疫和细胞免疫[32]。本实验中,笔者采用CCK-8法检测ME-X对巨噬细胞增殖的影响,结果如图8所示。由图8可知:当加药(ME-X和LPS)刺激时,对巨噬细胞增殖效果为极显著(P<0.01);细胞增殖对药物剂量具有一定依赖性,当ME-X质量浓度仅为1.25 μg/mL时,测得的增殖率达到51.44%;值得注意的是,ME-X质量浓度为20 μg/mL时,对巨噬细胞的增殖效果最佳,增殖率达63.12%。

*表示P<0.05,**表示P<0.01,ME-X组、LPS组均与空白对照组比图8 ME-X对巨噬细胞增殖的影响Fig.8 Effects of ME-X on the proliferation of RAW264.7 cell

图9 ME-X对RAW264.7细胞形态的影响Fig.9 Effects of ME-X on the cell morphology of RAW264.7 cell
ME-X刺激巨噬细胞增殖形态如图9所示。由图9可见:空白对照组细胞较少,几乎为圆形,分散生长;在ME-X的刺激下,巨噬细胞快速增殖分裂,细胞体积变大,不同程度伸出伪足,细胞数量明显增多。说明ME-X能显著促进巨噬细胞增殖。
2.5 ME-X对巨噬细胞(RAW264.7)吞噬中性红能力的影响
在ME-X刺激下,巨噬细胞吞噬中性红的能力如图10所示。由图10可知:在低浓度ME-X和LPS作用下,RAW264.7细胞吞噬中性红的能力显著提高;随着药物浓度加大,吞噬效果显著加强,并且和药物浓度呈正相关;值得注意的是,当药物质量浓度达到20 μg/mL时,吞噬率最大,为22.49%,表明该浓度下RAW264.7细胞吞噬中性红的能力最强。
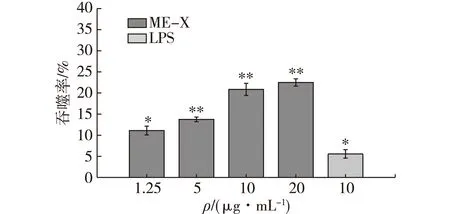
*表示P<0.05,**表示P<0.01,ME-X组、LPS组均与空白对照组比图10 不同浓度的ME-X对RAW264.7 细胞吞噬中性红的影响Fig.10 Effects of different concentration ME-X on neutral red phagocytosis of RAW264.7 cells
3 结论
国内对多糖的研究虽然开始比较晚,但随着各项技术的发展和进步,对真菌多糖的提取、分离纯化工艺的研究越来越成熟,为后续对多糖的结构鉴定、生物活性以及机制奠定了基础。本研究以四川省小金县野生羊肚菌为对象,用热水浸提法,DEAE-cellulose column柱层析法等分离纯化后得到多糖ME-X。分别用ME-X刺激T淋巴细胞、B淋巴细胞和RAW264.7细胞并探究其增殖效果,同时用中性红法检测巨噬细胞的吞噬能力,从而探究ME-X的免疫活性。
傅里叶红外光谱和HPGPC结果显示,ME-X含有多糖的特征峰,且其重均分子量为1.635×104;ME-X能显著提高免疫细胞增殖,且对ME-X浓度具有一定的依赖性。当ME-X质量浓度为10 μg/mL时,淋巴细胞T、B的增殖效果最佳,增值率分别为31.18%、63.02%;当ME-X质量浓度为20 μg/mL时,巨噬细胞增殖效果最佳,增值率为63.12%,同时该浓度刺激巨噬细胞吞噬中性红能力也最强,吞噬率为22.49%。
综上,ME-X作为一类生物大分子,是一种很好的免疫调控资源。但是关于ME-XD具体化学结构及免疫调控作用的相关分子机制,还有待于进一步研究。
