铁对帕金森病相关蛋白LRRK2激活的影响
2018-12-04张学武
苏 晗,张学武
(延边大学医学院,吉林133002)
帕金森病(Parkinson’s disease,PD)是和衰老有关的第二最常见的神经退行性疾病,病理特征为中脑黑质多巴胺能神经元进行性丢失[1]。随着人口老龄化,PD患病人数逐年增加。PD发病原因非常复杂,目前已知与环境因素和遗传因素有关,尚无有效的治愈方法。研究发现,PD患者脑黑质铁异常积聚,黑质中铁的含量与PD病情的严重程度正相关[2-3]。对400多例PD患者的临床研究发现,铁摄入增多与PD发病危险性增加呈正相关,食用富含铁食物人群患PD的危险性增加1.7倍[4]。PD患者黑质铁异常沉积可能与摄入过多外源性铁以及遗传因素相关,异常增多的铁对PD相关基因的功能是否有影响呢?
富含亮氨酸重复序列激酶2(leucine-rich repeat kinase2,LRRK2)与PD的发生密切相关,LRRK2基因突变可导致常染色体显性遗传性PD[5]。LRRK2基因编码一个由2 527个氨基酸残基组成的蛋白激酶,该酶属于ROCO蛋白激酶家族,包括多个功能结构域,其中ROC具有GTP酶活性,MAPKKK是LRRK2的激酶活性区域,参与调节真核翻译起始因子4E 结合蛋白 1(4E-BP1)和蛋白激酶 B(AKT)等底物蛋白的丝氨酸和苏氨酸磷酸化[6]。至今已有8个LRRK2基因错义突变被证实可引起PD的发生,其中G2019S为最常见的突变类型,见于4%~5%家族性PD和1%散发性PD,G2019S突变可增强LRRK2自身的激酶活性,从而产生细胞毒性[7]。LRRK2相关PD与散发PD的临床症状相似,很难区分[8]。而且,最近研究发现即使LRRK2基因没有突变,PD患者脑中由LRRK2基因编码的酶活性比健康人高很多,野生型过量的LRRK2也可导致PD的发生,表明不管是家族性PD还是散发性PD,LRRK2均参与致病过程[9]。本研究将与PD发生密切相关的两个因素铁和LRRK2结合起来,观察在PD发生过程中铁对LRRK2的功能是否有影响,为进一步阐明PD的发病机制提供新的线索。
1 材料与方法
1.1 细胞培养 将人神经母细胞瘤细胞(SHSY5Y)接种于10 cm培养皿、24孔或96孔培养板中,用含10%胎牛血清的高糖DMEM(Life Technologies)培养,在细胞融合度达到70%时开始实验。SH-SY5Y细胞分别用柠檬酸铁铵(ferric ammonium citrate,FAC,终浓度为 5 μg/mL)、6-羟基多巴胺(6-hydroxydopamine,6-OHDA,终浓度为 100 μM)以及两者共同处理SH-SY5Y细胞,检测LRRK2磷酸化(p-LRRK2)及其底物 AKT磷酸化(p-AKT)水平,观察LRRK2在胞内聚集和细胞ROS水平。
1.2 Western blotting 实验采用SDS-PAGE不连续电泳系统进行垂直板电泳,浓缩胶(5%)电压为80 V,分离胶(8%)电压为120 V,直至溴酚兰抵达分离胶底部后20 min,断开电源。采用全湿法(BIORAD电泳仪)稳流350 mA将分离胶上的蛋白条带转移至PVDF膜,用含5%脱脂奶粉的TBS包被2 h,浸入加有一抗(鼠抗p-LRRK2或LRRK2单克隆抗体1∶1 000稀释,兔抗p-AKT或AKT多克隆抗体1∶1 000 稀释,Cell Signaling Technology)的新鲜配制的封闭液中,4℃过夜。次日,用抗鼠或抗兔的HRPIgG二抗室温孵育2 h(1∶5 000稀释)。将Pierce ECL Western Blotting Substrate(Thermo Fisher Scientific)中试剂A和B各吸出0.5 mL,混匀后将膜浸入其中,于压片盒中X光片曝光。
1.3 细胞免疫荧光实验 将带有Flag标记的野生型 LRRK2(WT-LRRK2),G2019S 突变型(G2019SLRRK2) 和 D2017A 突变型(D2017A-LRRK2)的LRRK2质粒转染SH-SY5Y细胞,构建稳定表达的细胞株。将这些细胞接种于放有玻片的24孔培养板中,使细胞在玻片上贴壁生长,2天后在培养基中加入FAC(终浓度为5 μg/mL)作用24 h。用 PBS洗3遍,每孔加入300 μL 4%多聚甲醛固定20 min。将玻片取出放置湿盒,滴加含3%羊血清和0.3%Triton X-100的PBS溶液室温封闭1 h,滴加用1%BSA稀释的一抗(鼠抗Flag单克隆抗体1∶1 000)后4℃过夜。然后避光加入羊抗鼠荧光二抗(1∶1 000)室温孵育2 h。共聚焦显微镜(Leica)观察LRRK2在胞内的分布和聚集。
1.4 DCFH-DA探针检测细胞 ROS水平DCFHDA是检测细胞活性氧常用的荧光探针。DCFH-DA本身无荧光,可以透过细胞膜被胞内的酯酶水解生成DCFH。DCFH可被活性氧氧化成有荧光的DCF,根据DCF的荧光强度判断胞内活性氧的水平。SH-SY5Y细胞用 5 μmol/L DCFH-DA在 37℃孵育 30 min,PBS洗3次,每次5 min。在Synergy 2酶标仪(Bio-Tek)上用488 nm激发波长,525 nm发射波长检测DCF的荧光强度。
1.5 统计学处理 应用SPSS20.0统计学软件进行数据处理分析,计量数据以±s表示,多组间差异性比较采用单因素F检验,两两比较采用Student-Newman-Keuls检验,P<0.05为差异有统计学意义。
2 结 果
2.1 柠檬酸铁铵可促进SH-SY5Y细胞LRRK2激活因为LRRK2激活首先需要自身磷酸化,继而发挥激酶活性催化下游底物磷酸化,因此观察LRRK2及其底物AKT磷酸化水平,从而推测LRRK2激酶活性。分别用FAC(5 μg/mL)处理SH-SY5Y细胞2 h或24 h,用 6-OHDA(100 μmol/L)处理 SH-SY5Y 细胞 24 h建立PD细胞模型,以及用FAC和6-OHDA共同处理SH-SY5Y细胞2 h或24 h。Western blotting结果显示:FAC与6-OHDA处理24 h都能使p-LRRK2和p-AKT水平增加,FAC与6-OHDA共同处理后p-LRRK2和p-AKT水平升高得更加明显。提示铁可诱导LRRK2磷酸化并使其激活,如果与6-OHDA共同作用则LRRK2的激活程度呈现叠加效应。
2.2 柠檬酸铁铵可促进SH-SY5Y细胞LRRK2的聚集 为了观察铁对LRRK2在胞内分布和聚集的影响,我们使用带有Flag标记的WT以及G2019S和D2017A突变型LRRK2高表达SH-SY5Y细胞株,用 FAC(5 μg/mL)处理 24 h,采用细胞免疫荧光检测LRRK2分布。已有报道G2019S突变可使LRRK2激酶升高,而D2017A则可使LRRK2激酶失活[10]。从图2可以看出:在PBS处理的三种细胞中LRRK2(红色)在胞内分布比较均匀;但是经过FAC处理后,WT-LRRK2和G2019S-LRRK2出现明显的聚集,尤其是G2019S突变的LRRK2聚集更显著,但是在D2017A-LRRK2组没有明显的变化。提示FAC可诱导野生型和G2019S突变型的LRRK2在胞内聚集,但对失活型的D2017A-LRRK2没有影响,即铁对LRRK2聚集的诱导与LRRK2激酶的活性相关。
2.3 柠檬酸铁铵可使SH-SY5Y细胞ROS水平增加 氧化应激可能是多巴胺能神经元退行性损伤的共同通路,在此我们观察FAC和6-OHDA对多巴胺能细胞ROS水平的影响。从图3可以看出:FAC和6-OHDA处理SH-SY5Y细胞24 h后,胞内ROS水平明显升高;FAC与6-OHDA共同作用24 h后ROS水平升高更显著。提示6-OHDA诱导的PD模型可引起SH-SY5Y细胞的氧化损伤,铁与6-OHDA一样,也可导致多巴胺能神经细胞ROS水平增加,铁如果与6-OHDA共同作用则ROS量呈现叠加效应。
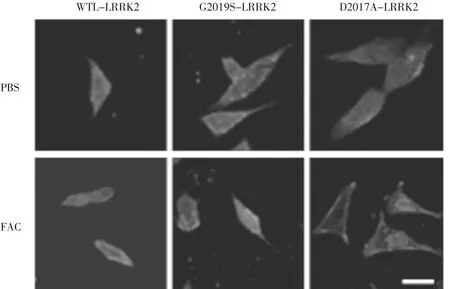
图2 FAC对LRRK2在SH-SY5Y细胞内积聚的影响
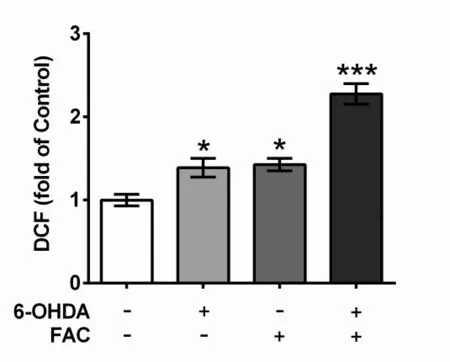
图3 FAC和6-OHDA对SH-SY5Y细胞ROS水平的影响
3 讨 论
本研究在多巴胺能细胞上观察铁对PD相关蛋白LRRK2功能的影响,发现铁和6-OHDA可诱导LRRK2磷酸化,增强其激酶活性,使LRRK2发生积聚,并使胞内ROS水平增高。这些结果提示铁在PD的发生过程中可通过增强LRRK2活性对多巴胺能神经元发挥重要的负性调节作用。
研究发现,PD患者脑黑质部位有铁的沉积,对PD患者的黑质新鲜标本检测发现PD患者黑质神经元铁的含量异常增加,而且铁的含量与残余的多巴胺能神经元数目没有关系,说明铁的异常沉积不是多巴胺能神经元凋亡后的继发性改变,而很有可能是PD的原发性病因[2-3,11]。6-OHDA是多巴胺神经递质的羟基化类似物,可被多巴胺神经元末梢通过轴突逆转运至黑质内的胞体内,造成黑质多巴胺能神经元损伤,是常用的PD模型化学诱导剂[12]。我们成功构建了6-OHDA诱导的细胞PD模型作为阳性对照,与FAC同时使用,发现FAC不但能诱导正常SH-SY5Y细胞中LRRK2激活、ROS升高,而且还可使6-OHDA处理的SH-SY5Y细胞中LRRK2激活更明显、ROS升高更显著。
LRRK2是家族性和散发性PD最常见的致病相关基因,它由几个功能结构域组成,包括ROC、COR和MAPKKK等。在人和鼠的脑、肾、肝等组织中均有LRRK2表达,但是脑中LRRK2激酶活性明显高于其他组织,而且更容易发生自身磷酸化,LRRK2第935位Ser磷酸化可以提高其自身活性[13]。我们的结果显示:FAC和6-OHDA不但可以诱导LRRK2的935位Ser磷酸化,还使其底物AKT的磷酸化水平增加,证明FAC和6-OHDA可激活多巴胺能细胞内的LRRK2,提高其激酶活性。非常有意义的是,LRRK2激活的结果与胞内ROS的升高相一致。LRRK2最常见的有意义的突变位点是G2019S,其位于LRRK2激酶结构域,Ser残基的引入高度模仿了LRRK2激活时的高级结构,从而导致LRRK2一直处于活化的状态,高活性的LRRK2在胞内以积聚的形式存在,使底物蛋白持续磷酸化,进而激活其下游多条信号途径,引发细胞损伤[10,13]。本研究结果显示,铁可诱导高表达的野生型和G2019S突变型LRRK2发生聚集,尤其是G2019S-LRRK2聚集更明显,而LRRK2激酶失活时(D2017A-LRRK2)则不能引发聚集,进一步证明铁可增强LRRK2的活性和功能,从而引起细胞的氧化损伤。
总之,本研究首次将微量元素铁与PD相关蛋白LRRK2结合起来,也即从环境因素与遗传因素角度,证明外源过多摄入的铁可提高LRRK2激酶的活性,加剧多巴胺能神经元的损伤,为寻找有效的PD药物靶标提供了新的理论依据,推测发展稳定的铁离子螯合剂或者LRRK2激酶抑制剂有望成为治疗PD的新手段。
