实时组织弹性成像技术对原发性肝细胞癌切除术后发生肝衰竭的价值分析
2018-12-03陈晓杰黄敬杨洪峻峰
陈晓杰,黄敬杨,翁 亮,王 露,洪峻峰
0 引 言
原发性肝细胞癌(primary hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,大部分与乙型肝炎病毒感染有关,常发展自肝纤维化和肝硬化。目前手术切除仍然是其首选的治疗方式[1],而手术后肝衰竭的发生对患者的预后有显著影响,甚至导致死亡。因此,术前预测肝衰竭的发生对外科医师具有重要的临床价值。术后肝衰竭主要是肝储备功能不足导致,而肝纤维化及肝硬化是影响肝储备功能的最主要原因,因此肝纤维化及肝硬化直接或间接影响着术后肝衰竭的发生。实时组织弹性成像(real-time tissue elastography,RTE)是超声弹性成像技术中的一种,利用超声对肝硬度进行无创检查,并应用内置软件计算肝纤维化指数(liver fibrosis index,LFI),从而实现对于肝纤维化和肝硬化程度的检测[2]。本研究旨在探讨LFI预测HCC手术切除患者发生术后肝衰竭的临床意义。
1 资料与方法
1.1一般资料回顾性分析2015年11月至2017年9月间福州总医院行肝切除术HCC患者116例,术前Child-pugh分级均为A级,无黄疸,无门静脉、肝静脉或胆管癌栓,未行经导管动脉化学栓塞、射频消融等治疗。
1.2临床观察指标①术前1 d空腹查血常规、肝功和凝血指标,包括白细胞(WBC)、血红蛋白(Hb)和血小板(PLT);总胆红素(TBIL)、总胆汁酸(TBA)、清蛋白(Alb)、丙氨酸氨基转移酶(ALT)和天冬氨酸转氨酶(AST);凝血酶原时间(PT)、国家标准化比值(INR)和活化部分凝血活酶时间(APTT)。②术中记录中的指标,包括手术方式(单一肝段切除,联合肝段切除)、有无肝门阻断、术中失血量和有无术中输血。③术后病理中的指标,包括肿瘤位置(左叶,右叶)、肿瘤数目(单发,多发)、是否有包膜和周边肝组织是否有肝硬化。
1.3术前RTE检查使用HI Vision Preirus型彩色多普勒超声诊断仪(日立公司),线阵探头EUP-L52,频率5 MHz,进行实时组织弹性成像检查。患者取平卧位,以腋前线至腋中线第5、8肋间隙行肝检查。选取距离肝包膜约1 cm肝实质区,避开大血管及胆管,感兴趣区(ROI)大小为2.5 cm×2.5 cm,嘱患者屏住呼吸后,利用心血管的搏动进行RTE成像。在压力感受器显示连续5次以上形态一致正弦波曲线后,在波谷处选取不少于ROI区域1/2面积的相对均质区进行测定,由内置软件计算出LFI。每次测量操作重复5次,取平均值。
1.4术后肝衰竭诊断标准根据肝脏外科国际协作小组(ISGLS)提出的标准,综合考虑临床实际情况,出现如下其中任何1种均可被定义为术后肝衰竭(posthepatectomy liver failure,PHLF)[3]。①术后1周后发生顽固性腹水而延迟伤口愈合需要介入引导腹水或腹水排量超过500 mL/d,以及TBIL超过60 μmol/L;②术后5 d或5 d以后INR过高或较术前增高,需要通过输注新鲜冰冻血浆才能将INR维持在正常水平。
1.5统计学分析采用SPSS 18.0及Medcalc 10.0完成。符合正态分布且方差齐性的数据采用两独立样本的t检验进行组间比较,方差不齐时用非参数秩检验。分类变量采用百分比表示,利用卡方检验分析。采用偏最大似然估计的前进法进行自变量的筛选,入选标准为0.05,剔除标准为0.10,进行多元线性回归分析,构建诊断术后肝衰竭模型(model of diagnosis of liver failure,LFM)。运用受试者工作特征曲线(ROC)评价LFM的曲线下面积(AUC),并根据Youden指数最大来确定最佳阈值,根据最佳临界点计算出敏感度、特异度,所有的统计分析均为双边检测,以P≤0.05为差异有统计学意义。
2 结 果
2.1基本情况见表1。
表1116例原发性肝细胞癌患者基本情况

指标数值男/女(n)97/19年龄(岁)50.9±9.6BMI(kg/cm2)22.79±2.74白细胞计数(×109/L)5.57±2.36血红蛋白(g/L)142.72±17.03血小板计数(×109/L)157(42~409)总胆红素(μmol/L)14.18±5.44总胆汁酸(μmol/L)10.50±8.90清蛋白(g/L)41.85±3.04ALT(U/L)29(11~280)AST(U/L)29(12~210)PT(s)11.9(10~14.3)INR0.99(0.84~11.0)APPT(s)19.45(17.3~23.8)LFI3.00±0.76手术术式(单一肝段切除/联合肝段切除)62/54(53.44%/46.56%)肝门阻断(有/无)89/27(75.86%/24.14%)出血量(mL)300(50~3400)术中输血(有/无)9/107(7.76%/92.24%)肿瘤位置(左叶/右叶)28/88(24.14%/75.86%)肿瘤数目(单发/多发)81/35(69.83%/30.17%)肿瘤大小(cm)6.41±4.52肿瘤包膜(有/无)82/34(70.69%/29.31%)肝硬化(有/无)38/78(32.76%/67.24%)
2.2单因素分析116例HCC患者中术后发生肝衰竭17例(14.7%),未发生肝衰竭99例(85.3%)。肝衰竭组LFI显著高于无肝衰竭组[(3.46±0.86)vs(2.92±0.71),P=0.006)。单因素分析表明,总胆汁酸、INR、LFI、肝硬化及术中出血量为影响术后发生肝衰竭的因素。见表2。
表2HCC术后肝衰竭相关的单因素分析

因数无肝衰竭组(n=99)肝衰竭组(n=17)P值男/女(n)81/1816/10.208年龄(岁)50.52±9.2953.35±11.230.264BMI(kg/cm2)22.78±2.7922.85±2.510.914白细胞计数(X109/L)5.62±2.455.28±1.780.586血红蛋白(g/L)142.46±17.62144.18±13.510.704血小板计数(X109/L)165.92±66.61151.82±68.380.424总胆红素(umol/L)14.45±5.6712.61±3.580.198总胆汁酸((umol/L))9.69±8.0815.78±11.660.008清蛋白(g/L)42.03±3.1340.79±2.270.122ALT(U/L)39.22±43.4847.35±28.480.459AST(U/L)37.42±29.0548.17±44.650.199PT(s)12.04±0.9211.85±0.800.426INR0.98±0.661.04±0.110.002APPT(s)19.56±1.5019.38±1.490.662LFI2.92±0.713.46±0.860.006术式(单一肝段切除/联合肝段切除)48/516/110.297阻断肝门(有/无)86/133/140.619术中出血量(mL)200(50~3400)300(50~3100)0.013术中输血(有/无)8/911/160.599肿瘤位置(左叶/右叶)21/787/100.071肿瘤数目(多发/单发)33/662/150.075肿瘤大小(cm)6.02±4.587.68±4.040.212肝硬化(有/无)26/7312/50.000
2.3多元线性回归分析将总胆汁酸、INR和LFI为自变量进行多元线性回归分析显示,INR和LFI是影响术后肝衰竭发生的风险因素,预测方程LFM=1.075×INR+2.050×LFI-11.738。见表3。
2.4ROC曲线分析以出现ISGLS提出的术后肝衰竭临床表现为标准,将INR、LFI和LFM进行ROC曲线分析,显示LFM的曲线下面积大于INR和LFI。根据约登指数最大原则,INR、LFI和LFM诊断肝衰竭的截断值分别为1.02、3.31和-3.856,其诊断敏感性分别为58.8%、58.8%和88.24%,特异性分别为84.9%、73.7%和72.73%。见表4、图1。
表3HCC术后肝衰竭相关多因素分析
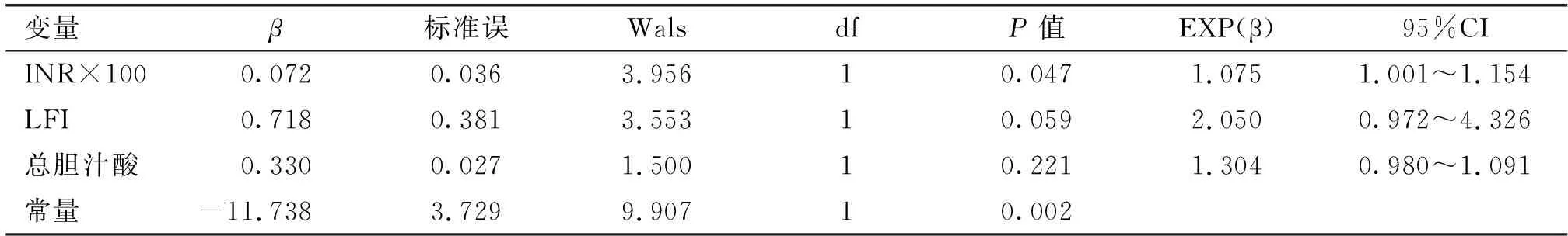
变量β标准误WalsdfP值EXP(β)95%CIINR×1000.0720.0363.95610.0471.0751.001~1.154LFI0.7180.3813.55310.0592.0500.972~4.326总胆汁酸0.3300.0271.50010.2211.3040.980~1.091常量-11.7383.7299.90710.002
表4INR、LFI和LFM预测HCC术后肝衰竭ROC曲线分析
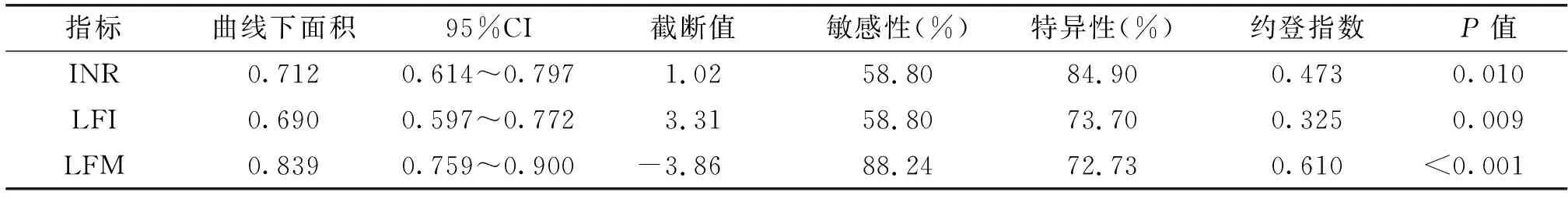
指标曲线下面积95%CI截断值敏感性(%)特异性(%)约登指数P值INR0.7120.614~0.7971.0258.8084.900.4730.010LFI0.6900.597~0.7723.3158.8073.700.3250.009LFM0.8390.759~0.900-3.8688.2472.730.610<0.001

图1 INR、LFI和LFM预测诊断HCC术后肝衰竭的ROC曲线
3 讨 论
3.1超声弹性成像超声弹性成像包括瞬时弹性成像(fibroscan,FS)、实时组织弹性成像(RTE)、声辐射力脉冲成像(acoustic radiation force impulse,ARFI)和超音速剪切波成像(supersonic shear imaging,SSI),常用于乳腺等浅表脏器的良恶性肿瘤鉴别[4-5],而在肝脏中的应用主要测量肝组织硬度来评价肝纤维化和硬化程度,其中FS被欧洲肝病研究学会(European Association for the Study of Liver,EASL)写入丙型肝炎的临床实践指南[6],而本研究中采用的RTE技术也被广泛应用于乙型肝炎和丙型肝炎的检查[7-8]。
3.2肝储备功能评估作为治疗HCC的首选方式,肝切除术的技术水平不断提高,但手术后发生的肝衰竭仍然是影响生存率的一个重要原因[9]。影响HCC手术预后的因素比较多,包括肿瘤因素、手术因素及肝本身的储备功能,其中最重要的是评价肝本身的储备功能[10]。2017版肝癌诊疗规范[11]引用了美国东部肿瘤协作组提出的功能状态评分(ECOG PS)来评估患者的全身情况:采用Child-Pugh评分、吲哚氰绿(ICG)清除试验或FS测定肝硬度评价肝功能储备情况,认为Child-Pugh A级、15 min的潴留率(ICG15)<20%~30%是实施手术切除的必要条件。本研究中均为Child-pugh A级的患者,术后仍然有17例肝衰竭发生,因此该指标并不能精确评估肝储备功能,需要进一步寻找一种简单易行的评价方法。而ICG清除试验要求多次抽血,操作时间较长,作为一种成本较高的自费项目,在我国并未大规模实施。相比而言,肝的弹性测定无创且更为简便,Cescon等[12]认为FS测量肝硬度可预测HCC术后预后,而RTE作为另一种弹性成像技术,同样可通过对肝硬度检查得出的肝纤维化指数LFI,判断肝纤维化或肝硬化程度[13],间接评估肝储备功能。
3.3影响术后肝衰竭的因素分析术后肝衰竭的定义目前无明确标准,本研究采用ISGLS提出的术后肝衰竭临床标准,该评价标准较为被广泛接受[14-15],其以总胆汁酸和INR为主要实验室指标,结合其他临床表现,作为本研究的终点值。INR为凝血功能的指标,由于肝功能损害造成凝血因子的破坏,因此凝血异常预示肝储备功能减退,凝血功能的降低与肝衰竭有相关性[16]。总胆汁酸为反映肝实质损伤的重要生化指标,但HCC本身也会引起其升高[17],并且其肝肠循环过程中也有可能引起异常,因此其作为体现肝实时功能状态的指标时意义较大,但对预后判定意义有限。
王守光等[18]认为术中出血量多合并严重肝硬化是HCC手术后发生肝衰竭的重要原因。本研究的多因素分析中,虽然肝硬化严重影响手术后肝的预后,是术后肝衰竭最重要的原因[19],但其诊断的确立需要依靠手术或者穿刺活检后的组织病理,因此不适合作为一个术前检查的预测指标,在本研究建立的预测方程中未将其纳入。而术中出血量由于其为术中指标,受影响因素比较多,包括凝血机制异常、手术时间、手术难度和术者技巧水平等,也未将其纳入多因素分析研究。
最后本研究将总胆汁酸、INR和LFI进行多元回归分析,表明INR和LFI为术后发生肝衰竭的独立风险因子,构建诊断肝衰竭模型LFM=1.075×INR+2.050×LFI-11.738。当LFM以-3.856为界值,其预测HCC患者术后发生肝衰竭的效能良好(AUC:0.839),其综合诊断结果要较于单独使用INR(AUC:0.712)或者LFI(AUC:0.690)诊断肝衰竭的效能高,这表明术后肝衰竭的发生是多因素作用的结果,与临床及既往研究一致[20-21]。这些研究数据都表明,利用LFI及INR构建诊断术后肝衰竭具有一定的临床价值,相比于其他预测肝储备功能的指标,此两者简单易获得,临床医师也更容易判断及预测术后患者的状况,从而做出更为客观的治疗方案。
3.4本研究局限性在研究中发现:RTE易受检查者肥胖程度的影响,皮下脂肪厚的患者成像质量较差;发生肝衰竭的样本量较少,有些相关的参数无法做亚组分析;预测方程的相关参数较少,有些相关因素由于条件限制未纳入研究,比如剩余肝体积比。因此,进一步进行技术改进,扩大样本量和指标收集,将提高研究质量和可信度。
综上所述,RTE所测量出来的LFI作为一个评估肝组织硬度的指标,有助于外科医师术前判断HCC术后的肝衰竭预后及选择合适的治疗方案。
